文章信息
- 王青龙, 姜希娟, 范英昌, 庞晓丽
- WANG Qinglong, JIANG Xijuan, FAN Yingchang, PANG Xiaoli
- 雷帕霉素对动脉粥样硬化小鼠斑块面积影响及机制探讨
- Researching the mechanism of rapamycin on area of plaque in atherosclerotic mice
- 天津中医药, 2018, 35(8): 613-615
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(8): 613-615
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.08.16
-
文章历史
- 收稿日期: 2018-05-23
2. 天津中医药大学中西医结合学院, 天津 300193;
3. 天津中医药大学护理学院, 天津 300193
动脉粥样硬化(AS)是冠心病、脑梗死、外周血管疾病的主要原因。研究显示炎症反应可以促进粥样斑块进行性发展,继而破裂出血引发急性心脑血管事件[1]。因此,控制炎症反应可抑制斑块的发生发展。近年来,很多学者认为AS属于慢性免疫-炎症反应[2-3],从免疫角度探讨AS发生发展中的炎症反应机制成为目前研究的热点之一。雷帕霉素作为一种免疫抑制剂,在抗AS方面的研究已经取得了一些进展[4-5]。然而,其具体作用机制尚未完全阐明。故实验通过建立小鼠动脉粥样硬化模型,探讨雷帕霉素对粥样斑块面积的影响及机制,以期为临床研究提供借鉴。
1 材料与方法 1.1 药物准备根据说明书,基于体表面积换算人鼠等剂量,并将药物溶入适量生理盐水中。
1.2 实验动物与分组选取健康ApoE基因敲除(ApoE-/-)雄性小鼠30只,体质量25~30 g,6~8周龄(国家卫生研究院提供)。动物适应性喂养2周后,采用随机数字表法将小鼠分为3组:模型组10只、雷帕霉素组(RAPA)10只,阳性药物(瑞伐他汀)组10只,另饲养C57小鼠10只作为空白对照组。空白对照组给予正常饮食,其他3组均给予高脂饮食12周。12周后,RAPA组和阳性药物组给予相应剂量药物灌胃4周,模型组与空白对照组给予等剂量生理盐水灌胃4周。4周后处死取材。
1.3 观察方法与指标1)处死小鼠后取主动脉窦斑块,冰冻连续切片后油红O染色,观察各组斑块内脂质情况。2)取主动脉窦及主动脉弓斑块,石蜡连续切片后苏木精-伊红(HE)染色, 利用图像分析仪评估斑块面积。3)取小鼠外周血,离心后取上清,采用酶联免疫吸附(ELISA)法测定外周血中肿瘤坏死因子α(TNF-α)、γ干扰素(INF-γ)、白介素-6(IL-6)、白介素-10(IL-10)、转化因子β(TGF-β)含量。
1.4 统计学分析采用SPSS 19.0统计软件包进行分析,计量数据采用均数±标准差(x±s)表示,组间比较采用单因素方差分析,两两比较采用LSD法行配对t检验,以P<0.05定为有统计学差异。
2 结果 2.1 油红O染色模型组、雷帕霉素组及阳性药物组均形成动脉粥样硬化斑块,其中模型组形成的粥样斑块具有较大脂核,见图 1。
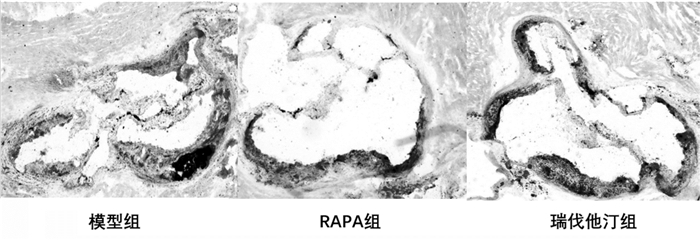
|
| 图 1 各组斑块主动脉窦油红O染色(×40) Fig. 1 Aortic sinus imaging of Oil red staining among groups (×40) |
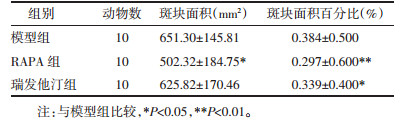
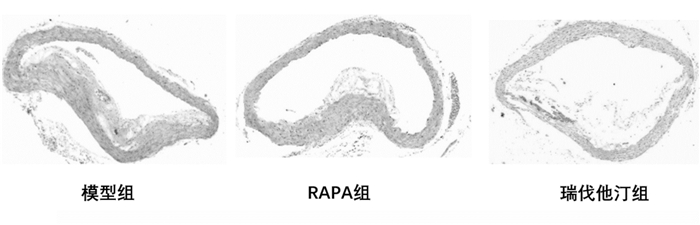
基于HE染色利用图像分析仪计算各组斑块面积及占管腔的百分比。结果显示,与模型组比较,雷帕霉素组斑块面积及狭窄程度明显小于模型组,有统计学意义(P<0.05);瑞伐他汀组虽然斑块面积与模型组比较无统计学意义(P>0.05),但在狭窄程度方面有统计学意义(P<0.05),见表 1。雷帕霉素组与瑞伐他汀组比较,两组差异无统计学意义(P>0.05)。见图 2。
|
|
| 图 2 各组斑块主动脉弓HE染色(×40) Fig. 2 Aortic arch imaging of Hematoxylin and eosin among groups(×40) |
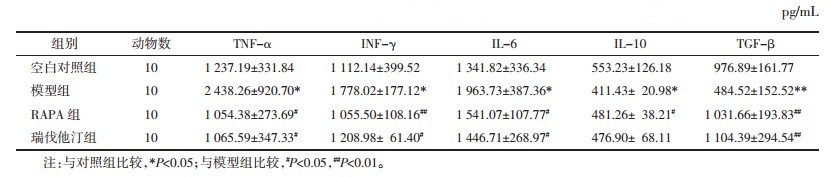
结果显示,模型组与空白对照组比较,促炎因子明显升高,而抗炎因子明显降低,差异有统计学意义(P<0.05);雷帕霉素组与模型组比较能有效降低促炎因子含量,增加抗炎因子表达,差异有统计学意义(P<0.05);瑞伐他汀组与模型组比较除IL-10外,差异均匀统计学意义(P<0.05)。见表 2。
|
近年来很多学者认为AS属于慢性免疫-炎症性疾病,斑块内大量巨噬细胞、淋巴细胞(主要为CD4+T细胞)、炎症因子聚集引发免疫炎症反应,可导致斑块进行性发展[6-7]。研究显示,雷帕霉素靶蛋白(mTOR)信号通路激活后可促进巨噬细胞增殖、迁移及CD4+T淋巴细胞向效应性T细胞分化,进而导致AS炎症反应放大[5, 8]。因此,调控mTOR通路可抑制免疫炎症反应,进而抑制AS斑块进展。
雷帕霉素为免疫抑制剂,可通过抑制mTOR通路达到控制免疫反应的作用[4]。本研究油红O及HE染色显示,雷帕霉素组斑块脂核明显小于模型组。基于HE染色图像分析结果证明,该药可有效减小动脉粥样硬化小鼠体内斑块面积,降低血管狭窄程度,与临床治疗AS阳性药物-他汀类效果相同。说明一方面,AS进展过程中确实存在免疫反应;另一方面,这种免疫反应与mTOR通路关系密切。
在免疫引发的炎症反应方面,研究表明mTOR通路激活后,一方面可促进巨噬细胞增殖,增殖的巨噬细胞会释放大量炎症因子如TNF-α、INF-γ、IL-6等,加剧AS炎症反应[6, 9]。另一方面,可促进CD4+T亚群细胞向效应性T细胞分化,降低调节性T细胞(Treg)数量,进而导致Treg细胞分泌的抗炎因子IL-10、TGF-β表达降低,炎症反应放大[10-11]。本研究结果显示,雷帕霉素可有效降低动脉粥样硬化小鼠外周血中TNF-α、INF-γ、IL-6含量,增加IL-10、TGF-β含量。因此,推测这可能与该药抑制巨噬细胞增殖、增加Treg细胞数量有关。综上所述,雷帕霉素可通过增加抗炎因子含量、降低促炎因子含量来调控炎症反应,进而抑制斑块发展,降低血管狭窄程度。
总之,雷帕霉素为抗真菌感染、抗移植免疫反应药物,在治疗AS方面的研究尚处于起步阶段。本研究从炎症角度探讨该药对AS的作用机制,但在免疫炎症具体作用靶点方面还需进一步研究。
| [1] | Hansson GK, Libby P, Tabas I. Inflammation and plaque vulnerability[J]. Journal of internal medicine, 2015, 278 : 483–493. DOI:10.1111/joim.12406 |
| [2] | Taleb S. Inflammation in atherosclerosis[J]. Archives of cardiovascular diseases, 2016, 109 : 708–715. DOI:10.1016/j.acvd.2016.04.002 |
| [3] | Ou HX, Guo BB, Liu Q, et al. Regulatory T cells as a new therapeutic target for atherosclerosis[J]. Acta Pharmacoloqica Sinica, 2018, 39 : 1–10. DOI:10.1038/aps.2017.77 |
| [4] | 刘丽乔, 王群. mTOR抑制剂抗动脉粥样硬化的研究进展[J]. 基础医学与临床, 2017, 37 (2): 265–269. DOI:10.3969/j.issn.1001-6325.2017.02.040 |
| [5] | Martinet W, De Loof H, De Meyer GR. mTOR inhibition:A promising strategy for stabilization of atherosclerotic plaques[J]. Atherosclerosis, 2014, 133 : 601–607. |
| [6] | Groh L, Keating ST, Joosten LA, et al. Monocyte and macrophage immunometabolism in atherosclerosis[J]. Semin Immunopathol, 2018, 40 : 203–214. DOI:10.1007/s00281-017-0656-7 |
| [7] | Kevin T, Harley T, John S, et al. T cells in atherosclerosis[J]. International Immunology, 2013, 25 (11): 615–622. DOI:10.1093/intimm/dxt043 |
| [8] | Zhai C, Cheng J, Mujahid H, et al. Selective inhibition of PI3K/Akt/mTOR signaling pathway regulates autophagy of macrophage and vulnerability of atherosclerotic plaque[J]. PloS one, 2014, 9 (3): e90563. DOI:10.1371/journal.pone.0090563 |
| [9] | Babaev VR, Huang J, Ding L, et al. Loss of Rictor in monocyte/macrophages suppresses in their proliferation and viability reducing atherosclerosis in LDLR null mice[J]. Frontiers in immunology, 2018 : 1–14. |
| [10] | Kurdi A, Martinet W, De Myer GRY. mTOR Inhibition and Cardiovascular Diseases:Dyslipidemia and Atherosclerosis[J]. Transplantation, 2018 : 1–11. |
| [11] | Amanda CF, Andrew HL, Johan K. Treating Atherosclerosis with Regulatory T Cells[J]. Arterioscler Thromb Vasc Biol, 2015, 35 (2): 280–287. DOI:10.1161/ATVBAHA.114.303568 |
2. Combine Traditional Chinese and Western Medicine Institute of Tianjin University of Traditional Chinese Medixine, Tianjin 300193, China;
3. Nursing School, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2018, Vol. 35
2018, Vol. 35




