文章信息
- 李延珍
- LI Yanzhen
- 银杏二萜内酯葡胺注射液对离体心脏缺血再灌注损伤保护作用的实验研究
- Experimental study on the protective effect of Diterpene Ginkgolides Meglumine injection on isolated heart ischemia-reperfusion injury
- 天津中医药, 2018, 35(8): 616-620
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(8): 616-620
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.08.17
-
文章历史
- 收稿日期: 2018-03-24
心脏缺血再灌注损伤是急性心肌梗死溶栓后以及多种心脏手术术后常见并发症,严重影响患者预后,是临床上亟待解决的难题。银杏二萜内酯葡胺注射液(DGMI)主要成分为银杏内酯,其中银杏内酯A占35%、银杏内酯B占60%、银杏内酯C占2%、银杏内酯K占2%,DGMI能够通过修复血脑屏障、调节脑内氨基酸类和单胺类神经递质的水平、改善脑组织血液循环、抑制氧化应激损伤等而对脑组织缺血性疾病具有一定的治疗作用[1-3],但DGMI对心肌缺血再灌注损伤是否能够起到一定的保护作用的文献报道尚不多见。本实验采用Langendorff灌流系统,建立大鼠离体心脏缺血再灌注损伤模型,以维拉帕米为阳性对照药物,研究DGMI对离体心脏的保护作用并探讨其可能的机制。
1 材料与方法 1.1 实验动物健康清洁级雄性SD大鼠(8周龄,220~260 g)购自河北省实验动物中心[SCXK(冀)2013-1-003]。饲养环境:23~25 ℃、相对湿度55%~60%,适应性饲养1周后进行实验。
1.2 试验药物与试剂DGMI购自江苏康缘药业股份有限公司(规格:25 mg:5 mL,批号:20170416);维拉帕米注射液购自上海禾丰制药有限公司(批号:43170116);2,3,5-氯化三苯基四氮唑(TTC)购自美国Sigma公司(批号:M2128);苏木精-伊红(HE)试剂盒购自南京建成生物工程研究所(批号:161029);谷草转氨酶(AST)、乳酸脱氢酶(LDH)、磷酸肌酸同工酶(CK-MB)试剂盒购自北京博奥森生物技术有限公司(批号:170101018、161209011、170117008);超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)、Na+-ATP、Ca2+-ATP试剂盒购自南京建成生物工程研究所(批号:161207、161124、160916、170118、160910);K-H液:用NaCl 20.67 g、NaHCO 36.27g、KCl 1.05 g、KH2PO4 0.48 g、葡萄糖5.99 g、MgSO4·7H2O 0.87 g、CaCl2 0.85 g溶解于1 L蒸馏水,调节pH=7.40(自制)。
1.3 实验方法 1.3.1 分组、给药与造模将100只实验用大鼠根据体质量随机分为正常对照组,模型组,DGMI低(1.5 mg/kg)、中(3 mg/kg)、高(6 mg/kg)剂量组和维拉帕米2.5 mg/kg组(阳性药物对照组),其中DGMI中剂量组相当于人临床常规剂量,各组均20只;手术前2 h,DGMI各剂量组和维拉帕米2.5 mg/kg组分别腹腔注射给予相应药物,正常对照组和模型组均给予生理盐水。参照郭丽丽等[4]报道的实验方法制备大鼠离体心脏缺血再灌注模型:腹腔注射20%乌拉坦实施麻醉后,迅速开胸,切断主动脉后取出心脏,置预冷(4 ℃)K-H液中,分离主动脉,釆用Langendorff法逆灌含氧K-H液(充以95% O2+5% CO2),切开左心耳并由此置入带测压导管的球囊,测压导管连接生物信号采集系统。正常对照组持续以7 mL/min恒速平衡灌注K-H液(37 ℃)110 min,模型组、DGMI各剂量组和维拉帕米组依次行7 mL/min恒速平衡灌注K-H液(37 ℃)20 min、停灌30 min后恢复灌注60 min,然后取材行各指标检测。
1.3.2 心肌酶(AST、LDH、CK-MB)活性检测分别取各组大鼠心脏冠脉流出液,采用生化分析法检测心肌酶AST、LDH、CK-MB活性。
1.3.3 TTC染色法测定心脏组织梗死面积每组随机选取6只大鼠离体心脏,-20 ℃冻存20 min,置于2%TTC溶液恒温(37 ℃)、避光孵育15 min,红色为正常组织、灰白色为梗死区,通过BI-2000医学图像分析系统(成都泰盟软件公司)计算梗死面积百分率。
1.3.4 HE染色法观察心脏组织病变每组另随机取6只大鼠离体心脏,置4%多聚甲醛溶液固定72 h,经常规脱水、石蜡包埋、切片和脱蜡水化处理后,按照染色试剂盒操作步骤行HE染色,然后通过倒置光学显微镜观察心脏组织病变。
1.3.5 血流动力学指标检测通过连接测压导管的生物信号采集系统记录各组大鼠离体心脏组织心率(HR)、左室舒张末压(LVEDP)、左室收缩压(LVSP)、左室收缩压最大上升速率(+dP/dtmax)、左室舒张压最大下降速率(-dP/dtmin)。
1.3.6 心脏组织抗氧化酶活性,MDA含量及Na+-ATP、Ca2+-ATP活性检测取各组剩余的8只大鼠离体心脏组织,于4 ℃环境剪碎、加入适量冷裂解液后研磨匀浆, 制备10%组织匀浆液,3 500 rpm离心10 min取上清液,按照各检测试剂盒操作方法,通过紫外-可见分光光度计检测心脏组织中抗氧化酶SOD、CAT活性,MDA含量以及Na+-ATP、Ca2+-ATP活性。
1.4 统计学方法所有实验数据均采用SPSS17.0进行分析,计量资料以均数±标准差(x±s)表示,多组间均数比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
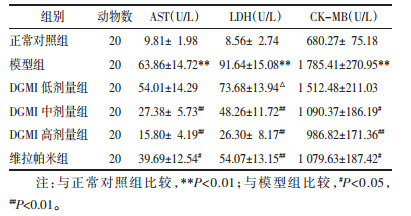
2 结果 2.1 心肌酶活性测定结果结果如表 1所示:与正常对照组比较,模型组大鼠离体心脏冠脉流出液心肌酶AST、LDH、CK-MB活性显著升高(P<0.01);与模型组比较,DGMI中、高剂量组和维拉帕米组冠脉流出液AST、LDH、CK-MB活性显著降低(P<0.05或P<0.01)。
|
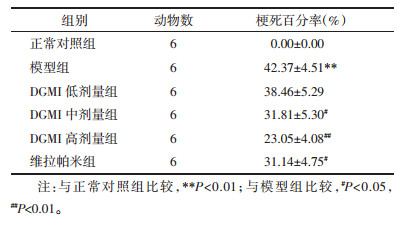
结果如表 2所示:与正常对照组比较,模型组大鼠离体心肌组织梗死面积百分率显著升高(P<0.01);与模型组比较,DGMI中、高剂量组和维拉帕米组心肌组织梗死百分率显著降低(P<0.05或P<0.01)。
|
结果如图 1所示:正常对照组大鼠离体心脏组织细胞形态未见异常;模型组心脏组织呈现肌原纤维断裂、间隙增宽、排列紊乱,细胞空泡变性、细胞质着色不均、胞核深染等病变;较模型组,DGMI中、高剂量组和维拉帕米组离体心脏组织病变呈现不同程度改善,其中以DGMI高剂量组效果较为显著。

|
| 图 1 各组大鼠离体心脏组织形态(HE×200) Fig. 1 Heart tissue morphology of the rat in each group (HE×200) A-正常对照组;B-模型组;C-DGMI低剂量组;D-DGMI中剂量组;E-DGMI高剂量组;F-维拉帕米2.5mg/kg组 |
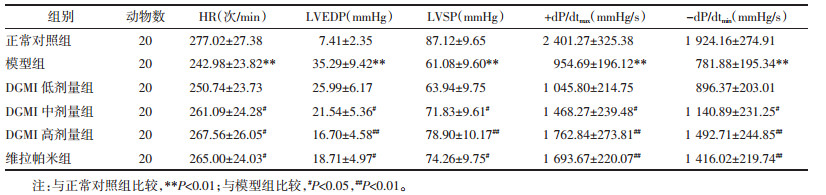
结果如表 3所示:与正常对照组比较,模型组大鼠离体心脏血流动力学指标(HR、LVSP、+dP/dtmax、-dP/dtmin)显著下降而LVEDP显著升高(P<0.01);与模型组比较,DGMI中、高剂量组和维拉帕米组HR、LVDP、+dP/dtmax、-dP/dtmin显著升高且LVEDP显著降低(P<0.05或P<0.01)。
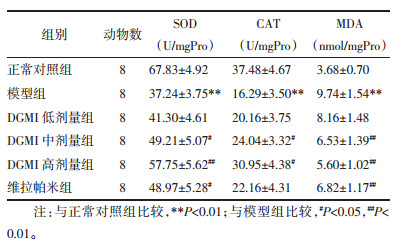
结果如表 4所示:与正常对照组比较,模型组大鼠离体心脏组织SOD、CAT显著降低且MDA含量显著升高(P<0.01);与模型组比较,DGMI中、高剂量组和维拉帕米组SOD、CAT活性显著升高(P<0.05或P<0.01),MDA含量显著降低(P<0.01)。
|
结果如表 5所示:与正常对照组比较,模型组大鼠离体心脏组织Na+-ATP、Ca2+-ATPase活力显著降低(P<0.01);与模型组比较,DGMI中、高剂量组和维拉帕米组Na+-ATPase、Ca2+-ATPase活力显著降低(P<0.05或P<0.01)。
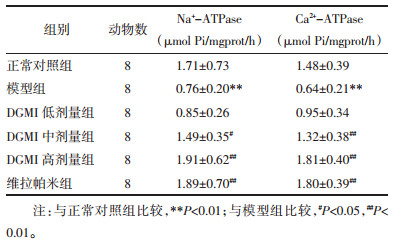
|
随着高血压、高脂血症等患病人群的增多,冠心病以及由其所引发的急性心肌梗死发病率逐年升高,严重危害着人类的生命健康。目前,临床上以使冠状动脉再通、恢复血流再灌注是治疗缺血性心脏病的首选方案,但缺血再灌注损伤并发症严重影响着患者预后。近年来,郭志祥[5]和刘家袁等[6]研究发现血流动力学改变、氧化应激损伤以及ATPase活性降低是心肌缺血再灌注损伤主要病理机制,这也为研发能够有效降低缺血再灌注损伤的新型药物提供了思路。
银杏叶为银杏科银杏属多年生落叶乔木银杏的叶,是中国传统中药品种,《本草纲目》和《中药志》中均有记载,其性味甘苦涩平,具有益心敛肺、化湿止泻之功效。现代药学研究发现,银杏二萜内酯类化合物为银杏叶的主要有效成分,包括银杏内酯A、B、C、K等,既往研究发现银杏二萜内酯具有多种生物学活性并且对脑组织缺血性损伤具有一定的保护作用。本实验釆用Langendorff离体心脏灌流技术,模拟心肌缺血再灌注损伤模型,研究发现经DGMI预处理能够有效降低离体心脏冠脉流出液AST、LDH、CK-MB活性、降低心肌组织梗死面积、抑制心肌组织病变,表明DGMI能够减轻心肌组织细胞损伤、改善心功能,提示DGMI对离体心脏缺血再灌注损伤具有一定的保护作用。
血流动力学指标正常是保证心脏功能的基础,其中HR、LVEDP、LVSP、+dP/dtmax、-dP/dtmin是衡量血流动力学的重要指标;其中,HR能够反应心脏的整体功能,LVEDP能够反映舒张期左室内压变化、LVSP反映收缩期左室内压变化,LVEDP和LVSP能够体现心肌顺应性;+dp/dtmax反映心肌收缩程度、-dp/dtmax反映心肌舒张功能,两者是评价心肌收缩性能和舒张性能的敏感指标[7-8]。心肌缺血/再灌注可能降低心肌舒缩功能,而表现为心输出量减少及±dp/dtmax指标降低[9]。本研究发现,经DGMI预处理能够有效提高离体心脏HR、LVDP、+dP/dtmax、-dP/dtmin并降低LVEDP,提示DGMI具有改善离体心脏缺血再灌注损伤后血流动力学的药理学作用。
氧化应激损伤是心脏组织缺血再灌注损伤的重要病理机制之一[10],体内氧自由基代谢失衡是氧化应激损伤的病理基础,SOD、CAT是体内清楚氧自由基的关键还原酶[11-12],MDA为脂质过氧化反应终产物,因此SOD、CAT活性和MDA含量能够间接反应心肌组织损伤的程度[13]。本研究发现,经DGMI预处理能够有效改善抗氧化酶(SOD、CAT)活性并降低MDA含量,提示DGMI具有抑制离体心脏缺血再灌注后氧化应激损伤的作用。
心肌缺血再灌注将导致细胞内Na+浓度升高,促进Na+-Ca2+交换而导致导致大量Ca2+内流而致细胞内Ca2+超载[14],进而引起细胞结构损伤而致细胞死亡,是心脏组织缺血再灌注损伤的另一重要病理机制[15-17]。本实验研究发现,经DGMI预处理能够有效提高Na+-ATPase、Ca2+-ATPase活性,从而有效缓解细胞内Na+、Ca2+超载,这可能是DGMI对离体心脏缺血再灌注损伤能够起到一定保护作用的机制之一。
综上所述,DGMI能够减轻心肌组织细胞损伤、改善心功能,提示DGMI对大鼠离体心脏缺血再灌注损伤具有一定的保护作用,可能与DGMI能够改善血流动力学、抑制氧化应激损伤以及改善Na+-ATPase、Ca2+-ATPase活性有关。
| [1] | 陈春苗, 周军, 陈健, 等. 银杏二萜内酯葡胺注射液对大鼠急性脑缺血再灌注损伤的影响[J]. 中国实验方剂学杂志, 2014, 20 (17): 133–136. |
| [2] | 张雯, 宋俊科, 何国荣, 等. 银杏二萜内酯对缺血/再灌注大鼠脑组织中神经递质的影响[J]. 中国药理学通报, 2016, 32 (12): 1648–1656. DOI:10.3969/j.issn.1001-1978.2016.12.005 |
| [3] | 肖展翅, 倪小红, 李钢, 等. 银杏二萜内酯葡胺注射液对脑梗死恢复期患者血液流变学的影响[J]. 中西医结合心脑血管病杂志, 2015, 13 (16): 1828–1830. DOI:10.3969/j.issn.1672-1349.2015.16.005 |
| [4] | 郭丽丽, 王阶, 陈雯, 等. 制备大鼠离体心脏损伤模型的最佳缺血再灌注时间[J]. 中国药理学与毒理学杂志, 2012, 26 (3): 353–356. DOI:10.3867/j.issn.1000-3002.2012.03.018 |
| [5] | 郭志祥, 汪欢, 张成鑫, 等. 大鼠心肌缺血再灌注损伤过程中血流动力学及炎症因子的表达变化[J]. 山东医药, 2014, 54 (44): 45–47. DOI:10.3969/j.issn.1002-266X.2014.44.017 |
| [6] | 刘家袁, 梁贵友, 王红阳. 腺苷酸活化蛋白激酶与心肌缺血再灌注损伤的研究进展[J]. 山东医药, 2017, 57 (17): 93–95. DOI:10.3969/j.issn.1002-266X.2017.17.033 |
| [7] | 陈亚萍, 张彬, 刘桂艳, 等. 杨梅苷对大鼠离体心脏缺血再灌注损伤的保护作用[J]. 中国比较医学杂志, 2016, 26 (5): 31–37. |
| [8] | 王静, 姜玉新, 崔凤娟, 等. 银杏达莫注射液抑制大鼠离体心脏缺血/再灌注损伤的机制研究[J]. 中国病理生理杂志, 2013, 29 (9): 1573–1578. DOI:10.3969/j.issn.1000-4718.2013.09.006 |
| [9] | 张红霞, 吴勇杰, 高明堂. 1-(2, 6-二甲基苯氧基)-2-(3, 4-二甲氧基苯乙氨基)丙烷盐酸盐对大鼠离体心脏缺血再灌注损伤的保护作用[J]. 中国临床药理学与治疗学, 2010, 15 (2): 160–165. |
| [10] | 张卫萍, 邓杨阳, 任建勋, 等. 淫羊藿总黄酮对大鼠心肌急性缺血再灌注损伤氧化应激干预机制的研究[J]. 中国中药杂志, 2016, 41 (18): 3400–3405. |
| [11] | Yildirim T, Alp R. The role of oxidative stress in the relation between fibromyalgia and obstructive sleep apnea syndrome[J]. Eur Rev Med Pharmacol Sci, 2017, 21 (1): 20–29. |
| [12] | Sravanthi KN, Rao NR. Cerebroprotective activity of Pentapetes phoenicea on global cerebral ischemia in rats[J]. Indian J Pharmacol, 2016, 48 (6): 694–700. DOI:10.4103/0253-7613.194849 |
| [13] | Kaminski K, Bonda T, Wojtkowska I, et al. Oxidative stress and antioxidative defense parameters early after reperfusion therapy for acute myocardial infarction[J]. Acute Card Care, 2008, 10 (2): 121–126. DOI:10.1080/17482940701744334 |
| [14] | Yongsheng K, Hegui W, Deguo W, et al. Endoxin-mediated myocardial ischemia reperfusion injury in rats in ritro[J]. Can J Physiol Pharmacol, 2004 (82): 402–408. |
| [15] | Choi E, Cha MJ, Hwang KC. Roles of calcium regulating microRNAs in cardiac ischemia-reperfusion injury[J]. Cells, 2014, 3 (3): 899–913. DOI:10.3390/cells3030899 |
| [16] | 李俊平, 郭丽丽, 陈中, 等. 钙超载与心肌缺血再灌注损伤及中药干预策略[J]. 中国中药杂志, 2016, 41 (11): 2168–2173. |
| [17] | 程永生, 陈宇, 李冬. 钙超载及其在心肌缺血/再灌注损伤中的作用机制研究现状[J]. 中国医学创新, 2013, 10 (3): 137–140. |
 2018, Vol. 35
2018, Vol. 35