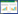文章信息
- 王朔, 梁如, 冯曼, 王鹏伟, 高树明, 李琳, 高杉, 殷佳, 于春泉
- WANG Shuo, LIANG Ru, FENG Man, WANG Pengwei, GAO Shuming, LI Lin, GAO Shan, YIN Jia, YU Chunquan
- 冠心病痰瘀互结证小鼠模型的建立与评价研究
- Establishment and evaluation of phlegm and blood-stasis syndromn on coronary heart disease model in mice
- 天津中医药, 2018, 35(9): 649-654
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(9): 649-654
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.09.04
-
文章历史
- 收稿日期: 2018-06-02
编者按:国家重点基础研究计划(973计划)中医证候临床辨证的基础研究由项目首席科学家胡镜清研究员主持,以冠心病痰瘀互结证为实例开展了中医临床辨证基础的示范研究,有助于揭示冠心病痰瘀互结证的病证关系及其生物学基础,对于充分发挥中医药防治心血管疾病的优势,提高中医药临床服务能力,创新中医药现代科学体系,具有十分重要的现实意义和深远的历史意义。
该项目选择临床常见、具有代表性的冠心病痰瘀互结证候,规范其术语表达,客观量化证候表征,研究冠心病痰瘀互结证的临床表征的演变,明确辨证依据;结合现代科技成果,从整体-细胞-分子水平验证冠心病痰瘀互结证与脂质代谢紊乱、微循环障碍、炎症介质等关联病理生理过程,研究其生物学基础,探讨冠心病的病理过程以及与痰瘀互结证的联系,揭示病证关系;总结临床辨证经验,解析冠心病痰瘀互结证从临床表征辨证候发生(辨征)、复杂网络关系识证候枢机(识机)、证机对应治法方药(论治)基本环节,在实践过程中不断完善,探索提出新的辨证方法。
该项目自2014年立项至今历时5年,研究工作获得了丰硕的研究成果。为了推广项目的研究成果,展示先进的研究经验,本刊现增设“中医证候研究”专栏,以此作为专题进行组稿,进一步梳理中医证候临床辨证相关研究新标准、新方法、新理论等973项目的研究新进展,以期为后续中医证候研究提供客观依据。
项目首席科学家简介:
胡镜清,男,1965年12月出生,医学博士、博士后,二级研究员,博士生导师,博士后合作导师。现任中国中医科学院中医基础理论研究所所长兼党委书记,中国中医科学院首席研究员,享受国务院政府特殊津贴。国家中医药管理局中医临床研究方法重点研究室主任,中国中医科学院临床流行病学学科带头人。兼任中华中医药学会中药临床药理学分会主任委员、世界中医药学会联合会临床疗效评价专业委员会会长。
先后主持包括973、863、国家支撑计划、国家自然科学基金在内的国家级/省部级课题20余项,包括2014年国家重点基础研究计划(973计划)项目“中医证候临床辨证的基础研究”任项目首席科学家。获得国家科技进步奖省部级及以上科技成果奖励10余项,发表论文100余篇。主要研究方向为老年病证与健康,研究专题包括中医证候规范与辨证方法、老年疾病防治与健康服务等。
近年来心血管疾病的发病率逐年上升,已成为全球人口死亡的主要原因[1-3],其致死率约占所有疾病的30%,其中冠心病随人群年龄增长而升高,成为世界上发病率、病死率、致残率和经济损失较高的主要疾病。冠心病属于中医学“胸痛”、“心痛”、“真心痛”等范畴,为本虚标实之证,本虚多为气虚、血虚、阴虚和阳虚,标实多为气滞、血瘀、痰浊和寒凝,冠心病中医证候临床流行病学调查[4]结果显示,最常见的证候大多与痰和瘀相关,痰瘀互结证已经成为冠心病现代临床的基本证候之一。
本研究采用冠状动脉左前降支结扎联合高脂饲料喂养载脂蛋白E基因敲除(ApoE-/-)小鼠建立冠心病痰瘀互结证小鼠模型,模型建立后,通过一般状态、左心室功能、血脂水平、血管内皮因子和病理改变等多方面对冠心病痰瘀互结证发病产生的影响进行探讨,为开展方证对应关系研究及中药作用机制研究提供可参考的动物模型。
1 材料6周龄SPF级健康雄性纯合子ApoE-/-小鼠40只,由北京维通利华实验动物技术有限公司提供,合格证号为11400700206247,许可证号为SCXK(京)2016-0011;6周龄SPF级健康的雄性C57BL/6J小鼠30只,由北京维通利华实验动物技术有限公司提供,合格证号为11400700206246,许可证号为SCXK(京)2016-0011。高脂饲料由江苏美迪森医药有限公司提供,产品货号为MD12015。
小动物超声实时影像系统vevo2100(加拿大)、日本数码拍摄系统(Olympus DP71)、美国Flex Station 3多功能微孔板分析仪(Molecular Devices公司)、异氟烷(河北九派制药公司)、胆固醇(TC)检测试剂盒(南京建成生物工程研究所)、甘油三酯(TG)检测试剂盒(南京建成生物工程研究所)、低密度脂蛋白(LDL)检测试剂盒(南京建成生物工程研究所)、高密度脂蛋白(HDL)检测试剂盒(南京建成生物工程研究所)、异丙醇(天津科密欧化学试剂有限公司)、叔戊醇(天津科密欧化学试剂有限公司)、油红O染液(北京索莱宝科技有限公司)。
2 方法 2.1 实验分组实验动物饲养于天津市南开医院实验动物中心SPF级动物房,饲养期间保持环境温度(22±2)℃,湿度(50±10)%,明暗交替各周期为12 h,分笼饲养,随机分组,自由进食和饮水。
适应性喂养1周,将40只ApoE-/-小鼠随机分成血瘀组(15只)、痰浊组(10只)和痰瘀互结组(15只),将30只C57BL/6J小鼠随机分成空白组(15只)和假手术组(15只)。实验期间痰浊组和痰瘀互结组喂养高脂饲料12周,其余各组全程给予普通饲料喂养12周。
2.2 模型制备方法痰浊组:采用高脂饲料喂养12周,期间死亡2只。血瘀组:在8周末行冠状动脉左前降支结扎术,脱去胸前毛发,使用异氟烷麻醉并进行仰卧位固定,碘伏消毒,沿心脏搏动最明显处开胸,暴露心脏,在左心耳和肺动脉圆锥之间结扎,术后立即将心脏送回胸腔,迅速挤压关闭胸腔,缝合创口,使其自行恢复自主呼吸。剔除死亡小鼠5只,继续饲养至12周。痰瘀互结组:手术方法同血瘀组,同时给予高脂饲料喂养,造模过程中死亡6只,后期饲养过程中死亡2只。假手术组:手术方法同血瘀组,但只进行穿线不结扎。
2.3 指标采集方法 2.3.1 一般状态观察观察并记录小鼠体质量变化、活动情况、毛发光泽、厌食情况、二便情况等。
2.3.2 超声心动检测小鼠心功能采用三溴乙醇进行腹腔麻醉,脱去胸前毛发,并固定于操作台上,调节探头垂直于小鼠左胸壁,在超声长轴切面下,可见心脏沿二尖瓣口至心尖方向的左室长轴像。主要检测指标:左心室射血分数(EF)、左心室短轴收缩率(FS)、左心室质量(LV Mass)、流出道血流速度(LVOT)。分别于第8周末行冠状动脉左前降支结扎术后和第12周末进行心功能检测。
2.3.3 血清血脂水平检测第12周末进行摘眼球取血,3 500 r/min,10 min离心,取血清,检测TC、TG、LDL-C、HDL-C。
2.3.4 心脏组织苏木精-伊红(HE)染色将心脏组织置于10%中性缓冲福尔马林固定24 h,经脱水,浸蜡包埋,切片(5 μm)烘干后,进行HE染色。在显微镜下选取合适视野采集并观察。
2.3.5 主动脉组织油红O染色沿脊柱完整剥离主动脉至双侧髂总动脉,去掉主动脉外壁上脂肪和结缔组织,并包于滤纸,放入10%中性福尔马林固定。将主动脉从10%福尔马林中取出,用蒸馏水漂洗,经异丙醇浸洗,油红O染色,异丙醇分化,直至血管壁透明。选取合适角度采集图像,对主动脉的脂质沉积情况进行描述与分析。
2.4 统计学方法统计软件采用SPSS 22.0进行统计。实验各数据以均数±标准差(x±s)表示。多组间比较采用单因素方差分析法(One-Way ANOVA),组间两两比较若方差齐采用LSD法,若方差不齐采用Dunnett’s T3法。P<0.05为差异有统计学意义。
3 结果 3.1 一般状态观察情况各组小鼠的体质量在第12周均比第0周显著增加,符合小鼠正常生长规律,有统计学意义(P<0.01)。空白组、假手术组和血瘀组小鼠的进食量、活动度和二便均正常,未出现下肢水肿。痰浊组和痰瘀互结组由于喂养高脂饲料,从第7周开始进食量有所减少,出现一定的厌食症状,活动度有所减少,痰浊组小鼠体质量开始下降,直至第12周明显降低。痰浊组和痰瘀互结组均未出现下肢水肿,且二便正常,由于喂养高脂饲料,大便呈绿色,相较于空白组、假手术组和血瘀组,毛皮更油腻。见图 1。
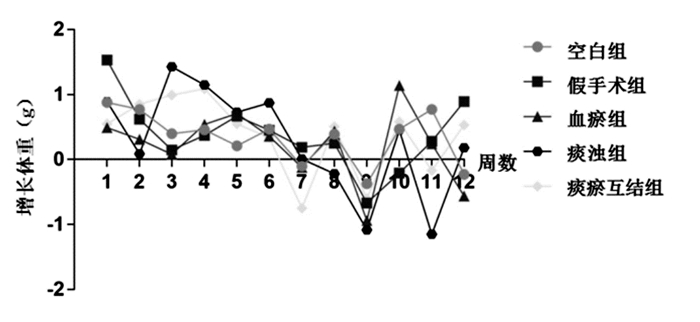
|
| 图 1 小鼠体质量变化 Fig. 1 Changes of the weight in mice |
造模8周,行冠状动脉结扎术后,与空白组或假手术组比较,血瘀组、痰浊组和痰瘀互结组EF、FS值均显著降低(P<0.01),血瘀组和痰瘀互结组左心室质量显著增大(P<0.01或P<0.05),流出道血流速度显著降低(P<0.01);与血瘀组比较,痰瘀互结组的EF、FS值显著降低(P<0.05);与血瘀组相比,痰瘀互结组心功能指标明显降低(P<0.05或P<0.01)。见表 1。
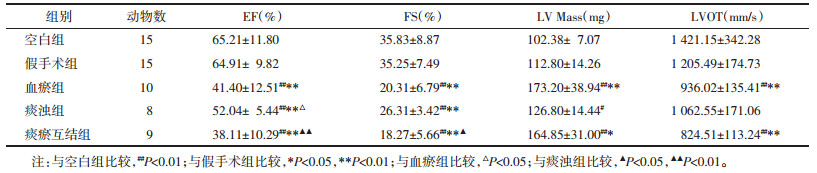
|
造模12周后,与空白组或假手术组比较,血瘀组、痰浊组和痰瘀互结组EF、FS值显著降低(P<0.01或P<0.05),左心室质量显著增加(P<0.01或P<0.05),痰瘀互结组流出道血流速度显著降低(P<0.01)。见表 2。
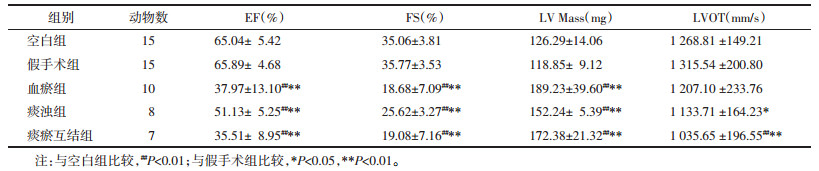
|
与空白组或假手术组比较,血瘀组、痰浊组和痰瘀互结组TG、LDL显著升高(P<0.01或P<0.05),痰瘀互结组TC、HDL显著升高(P<0.01);与血瘀组比较,痰浊组TG、LDL显著升高(P<0.05或P<0.01),痰瘀互结组TC、HDL显著升高(P<0.01);与痰浊组比较,痰瘀互结组TC、HDL-C显著升高(P<0.01)。见表 3。
空白组及假手术组主动脉窦内膜完整光滑,主动脉厚薄均匀,未见脂质条纹或纤维斑块,主动脉瓣形态正常,细胞排列整齐,瓣膜附着处见正常心肌细胞。血瘀组主动脉内膜明显增厚,管壁厚度不均,部分管壁向管腔内突出,外膜可见炎症细胞浸润和水肿,部分瓣膜上有纤维斑块形成。痰浊组主动脉内膜显著增厚、广泛纤维化,内膜下有大量脂质沉淀,可见大面积的粥样斑块,斑块中有大量泡沫细胞和粥样斑块病灶,外膜出现明显的炎细胞、浆细胞浸润。痰瘀互结组主动脉内膜显著增厚,主动脉壁厚薄程度不均匀,主动脉瓣变形、增厚,可见成熟的粥样斑块,管腔显著狭窄,瓣膜附着处出现大面积的粥样斑块,有大量泡沫细胞,斑块中大量脂质融合成片,可见大片粥样坏死核和大量梭状胆固醇结晶,外膜出现明显的炎细胞、浆细胞浸润。见图 2。
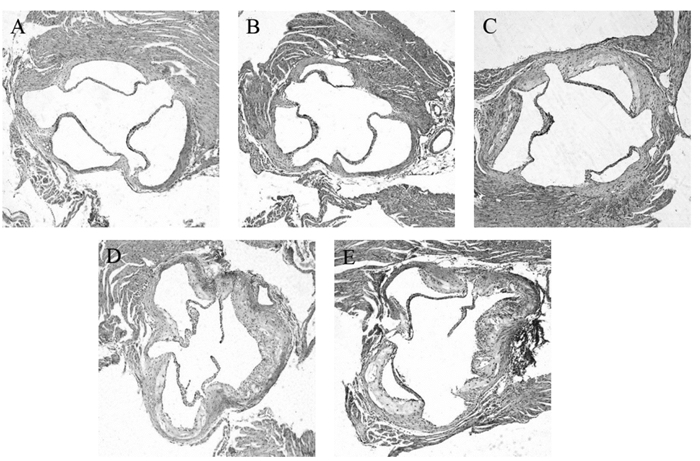
|
| 图 2 主动脉窦病理变化结果(×100) Fig. 2 Results of pathological changes of aortic sinus(×100) A:空白组;B:假手术组;C:血瘀组;D:痰浊组;E:痰瘀互结组 |
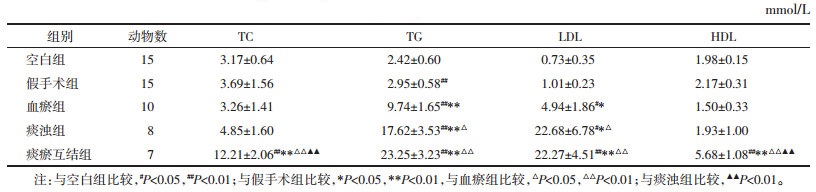
与空白组比较,血瘀组、痰浊组和痰瘀互结组斑块面积和斑块占管腔面积的百分比均明显升高(P<0.01),与假手术组比较,血瘀组、痰浊组和痰瘀互结组的斑块面积显著增大,斑块占管腔面积百分比均显著升高(P<0.01),与血瘀组相比,痰浊组斑块面积增大(P<0.01),痰瘀互结组的斑块面积和斑块占管腔面积比值明显升高(P<0.05或P<0.01)。见表 4。
经油红O染色后,空白组和假手术组主动脉内膜光滑平整,可见少量红色点状脂斑散在分布。血瘀组红色块状脂斑分布于整个主动脉,且斑块主要集中在主动脉弓分叉处及主动脉中部,主动脉弓部斑块最集中,呈块状分布,病变处的动脉壁增厚。痰浊组主动脉内膜上有较多斑块,较集中于主动脉弓部及腹主动脉以下的部位,腹主动脉部位可见大片红色块状脂斑,面积较大,斑块沉积部位管壁明显增厚。痰瘀互结组主动脉红色斑块主要集中分布在主动脉弓部及腹主动脉以下的部位,病变部位管壁显著增厚,主动脉弓部可见大量斑块集中分布,面积较大,腹主动脉区域也可见较多块状斑块。见图 3。
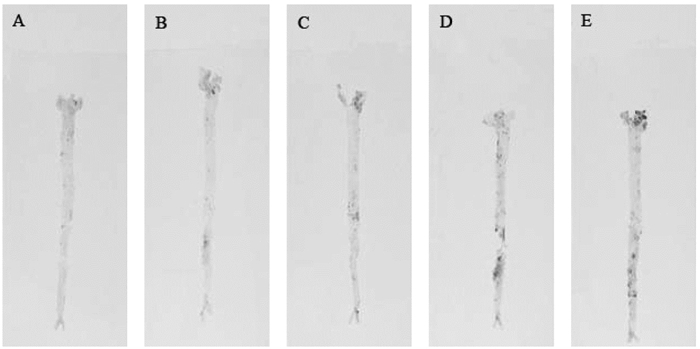
|
| 图 3 主动脉油红O染色结果 Fig. 3 Aortic oil red O staining results A:空白组;B:假手术组;C:血瘀组;D:痰浊组;E:痰瘀互结组 |
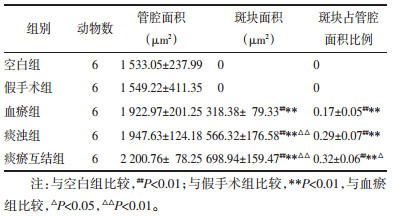
与空白组比较,血瘀组、痰浊组和痰瘀互结组主动脉内膜的斑块面积显著增大(P<0.01),与假手术组相比,血瘀组、痰浊组和痰瘀互结组主动脉内壁上斑块的面积显著增大(P<0.01),与血瘀组比较,痰瘀互结组主动脉所沉积的斑块面积显著增大(P<0.05)。见表 5。
冠心病有动脉粥样硬化与心肌缺血的双重病理特征,中医将动脉粥样硬化与血脂的升高作为“痰”的表现,将心肌缺血和血液流变学的变化作为“瘀”的表现,故冠心病易表现出痰瘀等病理症状[5]。冠心病是由于冠状动脉粥样硬化引发的,而脂质代谢异常则是导致动脉粥样硬化的主要原因,研究结果显示,因脂质代谢异常引起的高脂血症是导致动脉粥样硬化的主要因素,为冠心病的启动因子和促进因子[6],同时,动脉粥样硬化的形成、发展和斑块的破裂是冠心病发展的病理基础,因此,血脂代谢紊乱,痰阻血脉可看作冠心病的诱因,为血液流变方面的异常变化,瘀血阻碍气机,可看作冠心病的促进因素,痰瘀两者相互搏结、互为因果,影响津液的运化,形成痰瘀相随、痰瘀病损的发展过程,最终引发冠心病。这也从脂质代谢的角度对中医理论中“痰”和“瘀”的产生和转归进行了解释[7-8]。
ApoE是血浆中一种重要的载脂蛋白[9],主要通过调节CM残粒受体及LDL受体的配体功能发挥作用,影响机体脂代谢功能及胆固醇平衡,因此与动脉粥样硬化的发生、发展密切相关。ApoE-/-小鼠是公认的研究AS发病机制较理想的动物模型[10],由于缺乏ApoE基因,残粒代谢速度加快,导致LDL合成增加,LDL受体下降,分解降低,使LDL代谢障碍,表现为血脂水平明显异常,脂质沉积于血管壁,容易形成AS病灶,因此更容易形成是冠心病、动脉粥样硬化,故本研究采用ApoE-/-小鼠作为冠心病痰瘀互结证的研究对象[11]。
本实验采用冠状动脉左前降支结扎联合喂养高脂饲料ApoE-/-小鼠建立冠心病痰瘀互结证小鼠模型,通过结扎冠状动脉左前降支,造成冠心病中心肌缺血的病理特征,以模拟冠心病痰瘀互结证中“瘀” [12]的症状,通过喂养高脂饲料,使ApoE-/-小鼠脂质代谢紊乱,形成冠心病中动脉粥样硬化的病理特点,以模拟冠心病痰瘀互结证中“痰” [13]的特征。研究结果表明,相较于假手术组,痰瘀互结组的心功能明显损伤,符合冠心病痰瘀互结证“瘀”的病理症状;相较与假手术组,痰瘀互结组血清中血脂水平异常,主动脉窦处有明显的粥样斑块,主动脉管腔显著狭窄,主动脉大体油红O染色斑块面积显著,具有明显的动脉粥样硬化的特点,符合冠心病痰瘀互结证“痰”的病理特征。综上所述,本次实验通过冠状动脉左前降支结扎联合高脂饲料喂养ApoE-/-小鼠成功建立冠心病痰瘀互结证小鼠模型。
| [1] | Bagheri B, Shokrzadeh M, Mokhberi V, et al. Association between Serum Iron and the Severity of Coronary Artery Disease[J]. International Cardiovascular Research Journal, 2013, 7 (3): 95–98. |
| [2] | Yang Y, Liu X, Xia Y, et al. Impact of spatial characteristics in the left stenotic coronary artery on the hemodynamics and visualization of 3D replica models[J]. Scientific Reports, 2017, 7 : 15452. DOI:10.1038/s41598-017-15620-1 |
| [3] | Kelly BB, Narula J, Fuster V. Recognizing global burden of cardiovasculardisease and related chronic diseases[J]. Mt Sinai J Med, 2012, 79 (6): 632. DOI:10.1002/msj.v79.6 |
| [4] | 毛静远, 牛子长, 张伯礼. 近40年冠心病中医证候特征研究文献分析[J]. 中医杂志, 2011, 52 (11): 958–961. |
| [5] | 袁蓉, 王阶, 郭丽丽. 冠心病痰瘀互结证的近代研究及中医治疗进展[J]. 中国中药杂志, 2016, 41 (1): 35–37. |
| [6] | 陶旭光, 胡镜清, 柏冬, 等. 冠心病痰瘀互结证脂质与脂蛋白研究评析[J]. 环球中医药, 2015, 8 (6): 663–666. DOI:10.3969/j.issn.1674-1749.2015.06.006 |
| [7] | 刘建勋, 林成仁, 任建勋, 等. 小型猪痰瘀互结证冠心病"痰、毒、瘀"病机演变规律的实验研究[J]. 中国中药杂志, 2013, 38 (23): 4138–4143. |
| [8] | 林成仁, 李磊, 任建勋, 等. 痰瘀同治方对小型猪痰瘀互结证冠心病血液流变性及血脂的改善作用[J]. 中国中药杂志, 2014, 39 (2): 300–303. |
| [9] | 罗风, 冯磊. 载脂蛋白E基因多态性与冠心病相关性研究进展[J]. 医学综述, 2018, 24 (6): 1047–1051. DOI:10.3969/j.issn.1006-2084.2018.06.002 |
| [10] | Zhang SH, Reddick RL, Piedrahita JA, et al. Spontaneous hypercholesterolemia and arterial lesions in mice lacking apolipoprotein E[J]. Science, 1992, 258 (5081): 468–471. DOI:10.1126/science.1411543 |
| [11] | 高杉, 殷佳, 宋彦奇, 等. 冠心病痰瘀互结证小鼠模型的初步实验研究[J]. 天津中医药, 2017, 34 (2): 117–119. |
| [12] | 卢红蓉, 杜松. 冠心病病因病机理论研究概述[J]. 环球中医药, 2015, 8 (2): 186–189. DOI:10.3969/j.issn.1674-1749.2015.02.017 |
| [13] | 袁宏伟, 朱明丹, 冯利民, 等. 冠心病患者血脂水平与冠心病中医证型关系的研究[J]. 四川中医, 2014, 32 (4): 93–97. |
 2018, Vol. 35
2018, Vol. 35