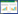文章信息
- 赵晰, 杨熙凯, 王耀光, 李蔓
- ZHAO Xi, YANG Xikai, WANG Yaoguang, LI Man
- 糖肾方含药血清对高糖诱导肾小管上皮细胞增殖作用及对TGF-β1、HO-1干预作用的研究
- Study on effect of Tangshen prescription-containing serum on proliferation of renal tubular epithelial cells induced by high glucose and intervention of TGF-β1 and HO-1
- 天津中医药, 2018, 35(9): 694-698
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(9): 694-698
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.09.15
-
文章历史
- 收稿日期: 2018-04-15
2. 天津中医药大学, 天津 300193;
3. 天津市北辰区中医医院, 天津 300400
糖尿病肾病(DN)是糖尿病常见的慢性微血管并发症之一[1],研究发现多种肾脏局部生长因子均与DN的发生、发展密切相关,如转化生长因子β(TGF-β)等,它可以刺激肾系膜细胞增殖、系膜外基质沉积增加,因此,认为其在DN发病中可能起着关键性作用[2]。DN的另一个重要病理机制是肾小管上皮细胞转分化;上皮细胞受损后细胞增殖能力增强,形成其他类型的细胞,转移到肾间质后分泌大量细胞外基质,加速DN的病理进程[3],因此推测,通过抑制细胞增殖实验,可以间接解释肾小管上皮细胞转分化的问题。
同时氧化应激也被认为是DN的发病中心环节,血红素氧合酶-1(HO-1)是细胞氧化应激过程一个非常敏感的指标。糖尿病时,肾脏组织HO-1可被显著诱导,起到抗氧化应激、抗纤维化、抗炎症反应的作用[4]。
目前对DN的治疗,主要是积极治疗并发症,保护肾功能和综合治疗,但对肾脏病进展的影响尚不清楚,对此中医药在治疗DN方面显示出了明显的优势[5],本课题组近年来在临床上发现活血化瘀法糖肾方在治疗DN上取得了很好的效果,展示出了良好的肾脏保护作用。本研究旨在探讨糖肾方含药血清对高糖诱导肾小管上皮细胞增殖作用及转化生长因子β1(TGF-β1)、HO-1表达的干预;阐明糖肾方延缓肾间质纤维化的机制,为中医药临床防治DN提供实验依据。
1 材料与方法 1.1 实验材料 1.1.1 主要仪器与试剂FORMA3111 CO2恒温培养箱,美国Thermo Fisher公司;ALPHA细胞培养基(批号:C12571500BT),gibco公司;胎牛血清(批号sv30087.03),HyClone公司;胰蛋白酶1:250(Genview,货号:GP3108);4-甲基偶氮唑蓝(MTT)(Beyotime,货号/批号:C0009/081817171103);HO-1、TGF-β1、α-平滑肌肌动蛋白(α-SMA)抗体,均为Abcam公司产品。
1.1.2 实验药物与细胞糖肾方(黄芪30 g,白术15 g,丹参30 g,生地12 g,山药30 g,防风15 g,防己15 g,川芎12 g,萆薢15 g,石菖蒲15 g,鬼箭羽15 g,地龙12 g),天津中医药大学第一附属医院国医堂提供,用时旋蒸浓缩,批号:2018002;人肾皮质近曲小管上皮细胞(HK-2):购自武汉普诺赛生命科技有限公司。
1.2 实验方法 1.2.1 制备含药血清SPF级SD大鼠12只,雄性,体质量(210±10)g,购于北京维通利华实验动物技术有限公司,大鼠饲养于中国医学科学院放射医学研究所,普通饲料喂养。
将大鼠随机分为空白组、糖肾方低浓度组、糖肾方高浓度组,每组4只。按照成人临床用药剂量计算,糖肾方高浓度组中药9 g/kg灌胃,糖肾方低浓度组1.8 g/kg灌胃,空白组灌服同体积生理盐水。每次10 μL/g,上、下午各1次,灌胃3 d。末次灌胃前8 h禁食、不禁水,灌胃30 min后大鼠股动脉采血,静置2 h后3 000 r/min冷冻离心20 min,取上清,-20 ℃保存,用时与培养基配成所需浓度。
1.2.2 细胞传代HK-2细胞用含10%胎牛血清的MEM ALPHA培养基培养于37 ℃、5% CO2的细胞培养箱中。每隔1~2 d换新鲜培养基1次,培养融合至80 %以上,用含0.25 %胰蛋白酶、0.05%乙二胺四乙酸(EDTA)的消化液消化后传代培养。实验前,无血清培养基饥饿培养24 h同步细胞,并进行3次重复实验。
1.2.3 实验分组细胞分为5组:1)空白对照组:MEM ALPHA培养基。2)高糖组:MEM ALPHA培养基+30 mmol/L葡萄糖。3)空白血清组:MEM ALPHA培养基+30 mmol/L葡萄糖+10%空白血清。4)糖肾方低剂量血清组:MEM ALPHA培养基+ 30 mmol/L葡萄糖+10%低剂量含药血清。5)糖肾方高剂量血清组:MEM ALPHA培养基+30 mmol/L葡萄糖+10%高剂量含药血清。
1.2.4 MTT法检测细胞增殖待HK-2细胞生长达80%左右时,使用胰酶对细胞进行消化,按每孔100 μL常规培基3 000左右个细胞配成细胞悬液,种植于96孔培养板上,每组设6个复孔,板周边孔用无菌磷酸盐缓冲液(PBS)填充,留空白孔调零,置37℃、5%CO2培养箱培养24 h,吸出培养液,换无血清培养基每孔100 μL培养,同步24 h;吸弃培养基,按以下分组加入药物,实验分4组:空白血清组(10%正常大鼠血清);高糖组(30 mmol/L葡萄糖);糖肾方低剂量血清组(30 mmol/L葡萄糖+10%低剂量含药血清);糖肾方高剂量血清组(30 mmol/L葡萄糖+10%糖肾方高剂量含药血清),每组设6个复孔,置37 ℃、5%CO2培养箱继续培养24 h,每孔加20 μl MTT溶液(5 mg/mL)培养4 h,弃上清,加入二甲基亚砜(DMSO)溶液150 μL,培养10 min,酶标仪上测其吸光度值(A490 nm)。根据公式计算细胞生长抑制率:细胞生长抑制率=(空白对照组A值-实验组A值)/空白对照组A值×100%。
1.2.5 逆转录聚合酶链式反应(RT-PCR)细胞培养后,对各实验组细胞进行收集,用Trizol提取细胞样本中总RNA,之后将总RNA进行反转录合成cDNA。取产物以β-actin为内参照进行定量PCR扩增。各指标引物序列见表 1。反应结束后进行软件分析。
采用Western blot检测各组肾小管上皮细胞中TGF-β1、HO-1、α-SMA蛋白的表达。
1.2.7 图像分析采用Image J分析软件对Western blot图像进行分析。见图 1。

|
| 图 1 各组目的蛋白表达水平 Fig. 1 Levels of target protein in each group 1:空白对照组;2:高糖组;3:空白血清组;4:中药低剂量组;5:中药高剂量组。 |
以上实验均重复3次,图像分析数据用均数±标准差(x±s)表示,用SPSS 17.0统计软件进行统计分析,多组间比较用单因素方差分析,组间两两比较采用LSD法,P<0.05认为组间差异有统计学意义。
2 结果 2.1 肾小管上皮细胞形态正常肾小管上皮细胞呈圆形或多边形,镜下呈“铺路石”样,高糖诱导下,肾小管上皮细胞失去固有形态,呈成纤维细胞样的长梭形,核也呈梭形改变。结果见图 2。
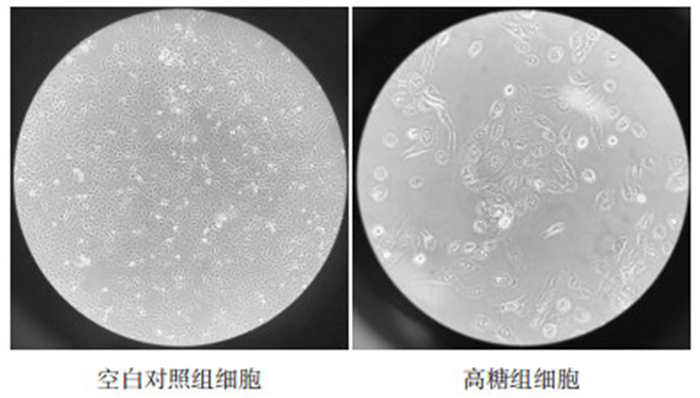
|
| 图 2 细胞形态变化 Fig. 2 Morphological changes |
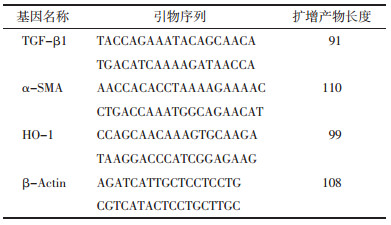
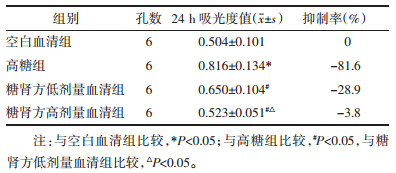
与空白血清组比较,高糖组吸光度值明显增高(P<0.05);与高糖组比较,糖肾方高、低剂量血清组在培养24 h后吸光度值均有下降,吸光度差异有统计学意义(P<0.05),且糖肾方高剂量血清组吸光度值下降强于糖肾方低剂量血清组(P<0.05)。糖肾方高剂量血清组抑制率最高。见表 2。
|
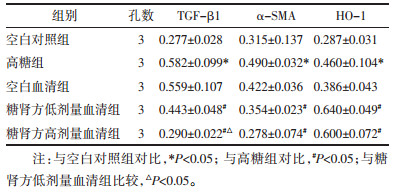
高糖组与空白对照组相比较,高糖组肾小管上皮细胞中TGF-β1以及α-SMA mRNA表达增加(P<0.01);空白血清组与高糖组相比,差异没有统计学意义(P>0.05);与高糖组相比,糖肾方低剂量血清组以及糖肾方高剂量血清组中TGF-β1、α-SMA的mRNA表达均降低(P<0.05),且糖肾方血清高、低剂量血清组间比较,在降低TGF-β1方面,糖肾方高剂量血清组效果最优(P<0.05);两组在降低α-SMA方面没有统计学差异(P>0.05)。见表 4。
高糖组与空白对照组相比较,高糖组中的HO-1 mRNA表达增加(P<0.05);空白血清组与高糖组相比,差异没有意义(P>0.05);与高糖组相比,糖肾方低剂量血清组以及糖肾方高剂量血清组中HO-1的mRNA表达升高(P<0.05),且两剂量组在效果上没有统计学差异(P>0.05)。见表 3。
高糖组与空白对照组相比较,高糖组肾小管上皮细胞中TGF-β1以及α-SMA蛋白表达增加(P<0.01);空白血清组与高糖组相比,差异没有统计学意义(P>0.05);与高糖组相比,糖肾方低剂量血清组以及糖肾方高剂量血清组中TGF-β1、α-SMA蛋白表达均降低(P<0.05),且糖肾方高低剂量血清组间比较,在降低TGF-β1方面,糖肾方高剂量血清组效果最优(P<0.05);两组在降低α-SMA方面没有统计学差异(P>0.05)。见表 4。
2.6 HO-1蛋白表达高糖组与空白对照组相比较,高糖组中的HO-1蛋白表达增加(P<0.05);空白血清组与高糖组相比,差异没有统计学意义(P>0.05);与高糖组相比,糖肾方低剂量血清组以及糖肾方高剂量血清组中HO-1的mRNA表达升高(P<0.05),且两剂量组在效果上没有统计学差异(P>0.05)。见表 4。
3 讨论DN是最常见的微血管并发症之一,大约有30%的糖尿病患者发展为DN,是导致终末期肾脏病主要原因之一[6]。
TGF-β1在肾纤维化中占有很重要的地位,如TGF-β1/Smad、TGF-β1/P38MAPK等[7-9]。α-SMA是肾小管上皮细胞间质细胞转化的特征性蛋白,是细胞外基质合成的主要来源,并可通过α-SMA降低表达,来缓解肾间质纤维化的进程[10]。
目前抗氧化剂治疗DN成为临床研究热点[11],HO-1是一种拮抗氧化应激的抗氧化酶,也是氧化应激过程中一个非常敏感的指标,肾脏损伤可能由于HO-1的缺失,导致TGF-β的高表达、炎症反应以及细胞外基质的产生,进一步加重了肾间质纤维化[9, 12]。病理状态下,如糖尿病时,肾脏组织中体外氯自由基(ROS)明显增多,HO-1被诱导,而且HO-1还可能通过下调TGF-β1的表达,起到抗纤维化抗炎症反应的作用[13],急性肾损伤时,HO-1基因敲除的小鼠,上皮细胞-间充质转化(EMT)增加。
在高糖诱导的肾小管上皮细胞实验中,TGF-β1导致了细胞外基质的增多,糖肾方的含药血清能有效抑制TGF-β1导致的EMT,同时还可上调HO-1表达,糖肾方可诱导HO-1发生抗氧化作用,这在课题组的研究中得到了证实。因此,推测糖肾方含药血清能抑制TGF-β1可能和其抗氧化机制存在相关性,表明糖肾方含药血清可上调HO-1表达,下调TGF-β1表达,从而改善肾间质纤维化,保护肾脏功能。
本实验所用糖肾方为王耀光教授临床经验用药,王教授认为肾纤维化,其病机应属“本虚标实”,故糖肾方以扶正祛邪为主,方中黄芪补中益气、实卫固表为主药;白术补气健脾祛湿,防风、防己祛风胜湿两药合用,生地、山药脾肾同补,共为臣药;川芎、丹参、鬼箭羽活血化瘀为佐药;地龙活血消癥,直达肾络,萆薢、石菖蒲利湿化浊共为佐使。
4 结论本实验结果表明,24 h高糖诱导下的肾小管上皮细胞增殖活跃。与空白血清组对比,HK-2细胞在高糖刺激后,细胞外基质成分TGF-β1、α-SMA差异有统计学意义,HO-1含量上升,用糖肾方含药血清干预后,TGF-β1、α-SMA的含量开始下降,HO-1开始升高,与高糖组对比,差异有统计学意义,说明糖肾方在一定程度上起到了减轻细胞外基质成分沉积、减轻细胞损伤、抑制肾间质纤维化的作用。
实验结果表明高糖诱导的肾小管上皮细胞TGF-β1和α-SMA蛋白呈现高水平表达,HO-1一定程度升高。糖肾方含药血清可以降低高糖诱导的肾小管上皮细胞蛋白TGF-β1、α-SMA表达并且升高HO-1蛋白表达水平,糖肾方对肾小管上皮细胞增殖有明显的抑制作用。因此,糖肾方可以通过抑制细胞增殖和HO-1、TGF-β1,逆转肾小管上皮细胞转分化过程,抑制DN肾间质纤维化,延缓病情进展。
| [1] | Dronavalli S, Duka I, Bakris GL. Pathogenesis of diabetic nephropathy[J]. Mature Clinical Practice Endocrinology & Metabolism, 2008, 4 (8): 444. |
| [2] | Samarakoon R, Overstreet JM, Higgins SP, et al. TGF-β1→SMAD/p53/USF2→PAI-1transcription axis in ureteral obstruction-induced renal fibrosis[J]. Cell Tissue Res, 2012, 347 (1): 117–128. DOI:10.1007/s00441-011-1181-y |
| [3] | Huang S, Susztak K. Epithelial plasticity versus EMT in kidneyfibrosis[J]. Trends Mol Med, 2016, 22 (1): 4–6. DOI:10.1016/j.molmed.2015.11.009 |
| [4] | Traylor A, Hock T, Hill-Kapturczak N. Specificity protein 1 and Smad-dependentregulation of human heme oxygenase-1 gene by transforming growth factor-beta1 in renal epithelial cells[J]. Am J Physiol Renal Physiol, 2007, 293 : 885–894. |
| [5] | 王之琳, 赵宗江. 赵宗江教授治疗糖尿病肾病的学术思想及临床经验撷英[J]. 世界科学技术-中医药现代化, 2015, 17 (10): 2162–2166. |
| [6] | Farag YMK, Wakeel JSA. Diabetic nephropathy in the arab gulf countries[J]. Nephron, 2011, 119 (4): c317–c323. |
| [7] | 朱亚利, 关凤军, 安娜, 等. 白芍总苷通过下调TLR4/NF-κB/TGF-β1信号通路改善阿霉素肾病大鼠肾纤维化[J]. 中国生化药物杂志, 2015, 35 (7): 43–46. |
| [8] | 马晓燕, 崔峥, 闫渊. 肾衰饮对肾纤维化大鼠TGF-β1/Smad信号通路的作用研究[J]. 中国中西医结合肾病杂志, 2015, 16 (12): 1059–1062. |
| [9] | 吴金玉, 周倍伊, 唐宇, 等. 三七注射液对阿霉素肾纤维化大鼠TGF-β1/P38MAPK信号通路的影响[J]. 中国现代医学杂志, 2015, 25 (10): 1–5. DOI:10.3969/j.issn.1005-8982.2015.10.001 |
| [10] | 高翔, 邢玲玲, 刘淑霞, 等. SOCS3在糖尿病小鼠肾小管间质病变中的作用[J]. 临床与实验病理学杂志, 2015, 31 (8): 900–903. |
| [11] | Rains JL, Jain SK. Oxidative stress, insulin signaling, and diabetes[J]. Free RadicalBiology and Medicine, 2011, 50 (5): 567–575. DOI:10.1016/j.freeradbiomed.2010.12.006 |
| [12] | 徐瑞, 张爱平. 原发性肾小球疾病患者血红素氧合酶-1的表达及其与患者临床特征的关系研究[J]. 中国全科医学, 2013, 16 (27): 2434–2437. |
| [13] | Yamagishi S, Nakamura K, Matsui T. Regulation of advanced glycation end product(AGE)-receptor (RAGE) system by PPARgamma agonists and its implication incardio vascular disease[J]. Pharmacol Res, 2009, 60 : 174–178. DOI:10.1016/j.phrs.2009.01.006 |
2. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
3. Beichen Hospital of Traditional Chinese Medicine, Tianjin 300400, China
 2018, Vol. 35
2018, Vol. 35