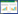文章信息
- 李敏, 杨君君, 杨静, 王跃飞, 柴欣
- LI Min, YANG Junjun, YANG Jing, WANG Yuefei, CHAI Xin
- 补骨脂果皮和种子中化学成分的分布规律研究
- Distribution rule of compounds in pericarp and seed of Fructus Psoralea
- 天津中医药, 2018, 35(9): 706-709
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(9): 706-709
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.09.18
-
文章历史
- 收稿日期: 2018-05-25
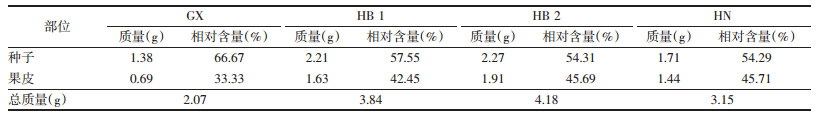
补骨脂为豆科植物补骨脂(Psoralea corylifolia L.)的果实,是中国传统中药,临床应用广泛。补骨脂具有温肾助阳、纳气平喘、温脾止泻的功效,内用治疗腰膝冷痛、滑精、遗尿、虚寒咳嗽,外用治疗白癜风[1]。现代药理研究表明,补骨脂具有增加心肌收缩力、增强免疫[2]、扩张血管、抗菌[3-4]、抗炎[5-6]、抗氧化[7]、抗肿瘤[8-9]、雌激素样等作用[10-11]。生补骨脂由果皮和种子构成,果皮中含有壁内腺、维管束等;种子由种皮、子叶、胚等组成,具体结构见图 1[12]。文献报道补骨脂中含有100多种化合物,主要包括香豆素、黄酮、单萜酚类化合物[13-15]。
|
| 图 1 补骨脂横切面简图 Fig. 1 Cross-section diagram of Fructus Psoralea |
中药安全性问题日益引起人们的关注,关系中医药的健康持续发展[16]。随着补骨脂的临床应用不断扩大,其肝脏毒性问题也倍受关注。周昆等研究表明补骨脂水提取液具有肝毒性,且水提液中主要成分为补骨脂苷、异补骨脂苷、补骨脂素和异补骨脂素[17];Cheung等报道了补骨脂中相关化学成分可导致肝脏毒性[18]。补骨脂苷和异补骨脂苷在肠道菌群作用下转化为补骨脂素和异补骨脂素,导致补骨脂素和异补骨脂素的大量吸收,可能是导致肝脏毒性的原因[19]。
本研究采用超高效液相色谱法系统研究补骨脂香豆素、黄酮、单萜酚等化学成分在果皮和种子中的分布情况,以期阐明其化合物的分布规律,为补骨脂的成分研究、加工炮制工艺研究奠定基础。
1 仪器与材料 1.1 仪器超高效液相色谱仪:Waters ACQUITYTM UPLC system(美国沃特世公司),XS 205型十万分之一电子天平(瑞士Mettler-Toledo公司),AL 204型电子天平(瑞士Mettler-Toledo公司),SCIENTZ SB 25-12DTN型超声波清洗器(宁波新芝生物有限公司,功率:300 W,频率:40 kHz),TGL-16C型高速台式离心机(上海安亭科学仪器厂),Milli-Q型超纯水系统(美国Millipore公司)。
1.2 药品及试剂补骨脂素(批号110738-201313)、异补骨脂素(批号110739-201115)均购自中国食品药品检定研究院;补骨脂苷、异补骨脂苷、补骨脂香豆雌烷B、补骨脂定、4″,5″-去氢异补骨脂定、补骨脂甲素、补骨脂乙素、新补骨脂异黄酮、巴库查尔酮、补骨脂宁、Corylifol A、Corylifol C、补骨脂查尔酮、补骨脂酚均为实验室自制[NMR、MS鉴定化合物结构,超高效液相色谱-紫外法(UPLC-UV)分析纯度≥98%]。甲醇、乙腈均为色谱纯,甲酸为分析纯,水为超纯水。
生补骨脂:由天津中医药大学李天祥教授鉴定为豆科植物补骨脂(Psoralea corylifolia L.)的干燥成熟果实,产地分别为广西(GX)、河北1(HB 1)、河北2(HB 2)、河南(HN)。
生补骨脂果皮、种子:取生补骨脂药材,用刀片将果皮和种子剥离,备用。
2 方法 2.1 色谱条件色谱柱:ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 μm);流动相:甲醇(A)-0.1%甲酸水(B)溶液,梯度洗脱(0~20 min,10%→74% A;20~25 min,74%→90% A);柱温60 ℃;流速0.3 mL/min;检测波长:246 nm;进样量:2 μL。
2.2 对照品溶液制备分别取补骨脂苷、异补骨脂苷、补骨脂素、异补骨脂素、补骨脂香豆雌烷B、Corylifol C、巴库查尔酮、补骨脂甲素、新补骨脂异黄酮、补骨脂宁、补骨脂乙素、补骨脂定、4″,5″-去氢异补骨脂定、Corylifol A、补骨脂查尔酮、补骨脂酚标准品适量,精密称定,制成质量浓度分别为1 mg/mL的对照品储备液,备用。
分别取上述对照品储备液适量,混匀,得对照品工作液,其浓度为补骨脂苷40.80 μg/mL、异补骨脂苷41.20 μg/mL、补骨脂素106.00 μg/mL、异补骨脂素104.00 μg/mL、补骨脂香豆雌烷B 40.83 μg/mL、Corylifol C 46.67 μg/mL、巴库查尔酮42.92 μg/mL、补骨脂甲素42.08 μg/mL、新补骨脂异黄酮41.25 μg/mL、补骨脂宁50.42 μg/mL、补骨脂乙素47.08 μg/mL、补骨脂定45.00 μg/mL、4″,5″-去氢异补骨脂定43.33 μg/mL、Corylifol A 44.17 μg/mL、补骨脂查尔酮42.08 μg/mL、补骨脂酚41.67 μg/mL。
2.3 供试品溶液制备取果皮,粉碎,取粉末0.3 g,精密称定,置于100 mL的容量瓶中,加适量甲醇,密塞,60 ℃超声处理(功率300 W,频率40 kHz)30 min,放冷,甲醇定容至刻度,摇匀,14 000 r/min离心10 min,取上清液1 mL,加1 mL 30%甲醇水溶液,摇匀,即得果皮供试品溶液,备用。
取种子,粉碎,取粉末0.25 g,精密称定,置于100 mL的容量瓶中,加适量甲醇,密塞,60 ℃超声处理(功率300 W,频率40 kHz)30 min,放冷,甲醇定容至刻度,摇匀,14 000 r/min离心10 min,取上清液1 mL,加1 mL 30%甲醇水溶液,摇匀,即得种子供试品溶液,备用。
3 结果与讨论 3.1 补骨脂果皮和种子质量分布情况取4批生补骨脂药材,按“1.2”项下方法处理生补骨脂,分离生补骨脂果皮和种子,分别称取质量,结果见表 1。
由表 1可知,产地分别为广西、河北、河南的生补骨脂,种子占生补骨脂总质量的54.29%~66.67%;果皮占生补骨脂总质量的33.33%~45.71%。
3.2 补骨脂果皮和种子中化合物分布规律研究取生补骨脂果皮、种子,按“2.3”项下供试品制备方法制备果皮、种子供试品溶液,每种样品称取2份,按“2.1”项下方法分析供试品溶及对照品溶液中主要成分,每份样品平行进样2次,色谱图见图 2。
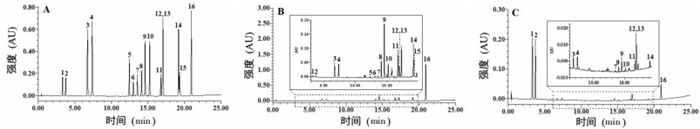
|
| 图 2 对照品溶液(A)、补骨脂果皮(B)、种子(C)供试品溶液色谱图 Fig. 2 Chromatograms of the standard solution (A) and sample solution of pericarp (B) and seed (C) of Fructus Psoralea 注:1:补骨脂苷;2:异补骨脂苷;3:补骨脂素;4:异补骨脂素;5:补骨脂香豆雌烷B;6:Corylifol C;7:巴库查尔酮;8:补骨脂甲素;9:新补骨脂异黄酮;10:补骨脂宁;11:补骨脂乙素;12:补骨脂定;13:4″,5″-去氢异补骨脂定;14:Corylifol A;15:补骨脂查尔酮;16:补骨脂酚 |
为了获得生补骨脂中化合物分布情况,分别读取果皮和种子供试品溶液中各化合物的峰面积,按照下式计算生补骨脂果皮和种子中化合物的相对含量,分别标记为Pi%和Pi′%,计算公式如下:
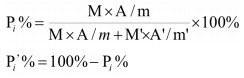 |
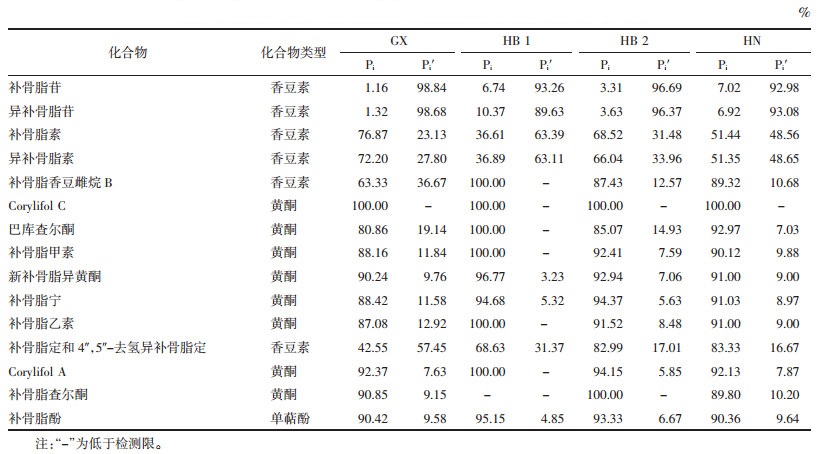
其中,i代表化合物,Pi%为化合物i在果皮中的量占该化合物总量的百分比;M为生补骨脂的果皮质量;M′为生补骨脂的种子质量;A为果皮供试品溶液中化合物i的峰面积;A′为种子供试品溶液中化合物i的峰面积;m为制备果皮供试品溶液时的果皮粉末取样量;m′为制备种子供试品溶液时的种子粉末取样量。Pi′%为化合物i在种子中的量占该化合物总量的百分比。计算结果见表 2。
|
由表 2可知,生补骨脂种子中主要含有补骨脂苷、异补骨脂苷,分别占生补骨脂果实中补骨脂苷、异补骨脂苷总量的89.63%以上;补骨脂素、异补骨脂素、补骨脂定、4″,5″-去氢异补骨脂定分别占其总量的16.67%~63.39%;含有少量黄酮和单萜酚类化合物。果皮中主要含有黄酮和单萜酚类化合物,果皮中Corylifol C、巴库查尔酮、补骨脂甲素、补骨脂宁、补骨脂酚等黄酮和单萜酚类化合物分别占其总量的80.86%以上;补骨脂苷、异补骨脂苷分别占其总量的10.37%以下,补骨脂素、异补骨脂素占其总量的36.61% ~ 76.87%,补骨脂香豆雌烷B占其总量的63.33%,补骨脂定和4″,5″-去氢异补骨脂定占其总量的42.55%~83.33%。
生补骨脂中补骨脂苷、异补骨脂苷主要存在于生补骨脂的种子中,而黄酮、单萜酚、脂溶性香豆素主要存在于生补骨脂的果皮中,因此可以通过分离补骨脂果皮和种子快速富集补骨脂中化学成分。此外,除去种子可去除大量补骨脂苷、异补骨脂苷,大幅减少提取物中补骨脂苷、异补骨脂苷的含量,从而减少补骨脂苷、异补骨脂苷在肠道菌群作用下转化为补骨脂素、异补骨脂素[19],降低肝脏毒性风险。
4 结论本实验采用超高效液相色谱法测定生补骨脂果皮、种子中化合物相对含量,阐释香豆素、黄酮、单萜酚在果皮和种子中分布规律,研究发现补骨脂苷和异补骨脂苷主要存在于种子中,黄酮和单萜酚类化合物主要存在于果皮中,脂溶性香豆素类成分在果皮和种子中均有分布。
| [1] | Quayson E, Berman AJ, Regina AC, et al. Hepatotoxicity associated with the use of Fructus Psoraleae used to treat vitiligo[J]. Clin Toxicol, 2015, 53 (7): 741. |
| [2] | Szliszka E, Skaba D, Czuba ZP, et al. Inhibition of inflammatory mediators by neobavaisoflavone in activated RAW264.7 macrop- hages[J]. Molecules, 2011, 5 (16): 3701–3712. |
| [3] | Yang XY, Li J, Wang XW, et al. Psc-AFP, an antifungal protein with trypsin inhibitor activity from Fructus Psoraleae seeds[J]. Peptides, 2006, 27 (7): 1726–1731. DOI:10.1016/j.peptides.2006.01.020 |
| [4] | Cui YM, Taniguchi S, Kuroda T, et al. Constituents of Fructus Psoraleae fruits and their effects on methicillin-resistant staphylococcus aureus[J]. Molecules, 2015, 20 (7): 12500–12511. DOI:10.3390/molecules200712500 |
| [5] | 杨柳, 王业秋, 张宁, 等. 异补骨脂素对人皮肤角质形成细胞光老化模型p-ERK1/2及炎症因子影响[J]. 中药新药与临床药理, 2016, 27 (6): 775–778. |
| [6] | 张引红, 李美宁, 王春芳, 等. 补骨脂素对类风湿性关节炎小鼠模型的免疫调节作用[J]. 中国实验动物学报, 2017, 25 (2): 207–210. DOI:10.3969/j.issn.1005-4847.2017.02.017 |
| [7] | Xiao G, Li G, Liang C, et al. Isolation of antioxidants from Psoralea corylifolia fruits using high-speed counter-current chromatography guided by thin layer chromatography-antioxidant autographic assay[J]. Journal of Chromatography A, 2010, 1217 (34): 5470–5476. DOI:10.1016/j.chroma.2010.06.041 |
| [8] | Wang Y, Hong CT, Zhou CG, et al. Screening antitumor compounds Psoralen and Isopsoralen from Psoralea corylifolia L. Seeds[J]. Evid Based Complement Alternat Med, 2011 (1): 1–7. |
| [9] | Jana F, Faini F, Lapier M, et al. Tumor cell death induced by the inhibition of mitochondrial electron transport:the effect of 3-hydroxybakuchiol[J]. Toxicol Appl Pharm, 2013, 272 (2): 356–364. DOI:10.1016/j.taap.2013.06.005 |
| [10] | Liu X, Nam JW, Song YS, et al. Psoralidin, a coumestan analogue, as a novel potent estrogen receptor signaling molecule isolated from Fructus Psoraleae[J]. Bioorg Med Chem Lett, 2014, 24 (5): 1403–1406. DOI:10.1016/j.bmcl.2014.01.029 |
| [11] | 韦妍妍, 张紫佳, 徐颖, 等. 补骨脂对去卵巢大鼠雌激素样作用研究[J]. 中国实验方剂学杂志, 2011, 17 (13): 158–161. |
| [12] | 康延国. 中药鉴定学[M]. 北京: 中国中医药出版社, 2007: 326. |
| [13] | 谭伟.补骨脂化学成分和药理作用研究[D].上海: 东华大学, 2017. |
| [14] | Li CC, Wang TL, Zhang ZQ, et al. Phytochemical and Pharmacological Studies on the Genus Psoralea:A Mini Review[J]. Evid Based Complement Alternat Med, 2016 (2): 1–17. |
| [15] | Zhang X, Zhao W, Wang Y, et al. The chemical constituents and bioactivities of Psoralea corylifolia linn:a review[J]. Am J Chin Med, 2016, 44 (1): 35–60. DOI:10.1142/S0192415X16500038 |
| [16] | 肖小河. "健康中国"战略下的中药安全性研究与思考[J]. 中国中药杂志, 2018, 43 (5): 857–860. |
| [17] | 王安红, 周昆, 柴丽娟. 补骨脂素对HepG2细胞BSEP、NTCP的影响[J]. 时珍国医国药, 2015, 26 (7): 1563–1565. |
| [18] | Cheung WI, Tse ML, Ngan T, et al. Liver injury associated with the use of Fructus Psoraleae (Bolgol-zhee or Bu-gu-zhi) and its related proprietary medicine[J]. Clin Toxicology, 2009, 47 (7): 683. DOI:10.1080/15563650903059136 |
| [19] | Wang YF, Liu YN, Xiong W, et al. A UPLC-MS/MS method for in vivo, and in vitro, pharmacokinetic studies of psoralenoside, isopsoralenoside, psoralen and isopsoralen from Fructus Psoraleae, extract[J]. J Ethnopharmacol, 2014, 151 (1): 609–617. DOI:10.1016/j.jep.2013.11.013 |
 2018, Vol. 35
2018, Vol. 35