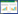文章信息
- 朱涛, 王永翠
- ZHU Tao, WANG Yongcui
- 萝卜硫素通过Traf6/TAK1信号通路介导人胃癌细胞凋亡的机制研究
- Mechanism study of sulforaphane on cell apoptosis in human gastric cancer cells through Traf6/TAK1 signaling pathway
- 天津中医药, 2018, 35(9): 710-713
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(9): 710-713
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.09.19
-
文章历史
- 收稿日期: 2018-05-20
2. 恩施州妇幼保健计划生育服务中心, 恩施 445000
胃癌是比较常见的消化道恶性肿瘤,在全球恶性肿瘤发病率中居前列,而且其病死率也较高,位于肿瘤致死率的第2位。调查发现,由于食品安全及环境生化毒性物质的累积,消化道肿瘤的发病率呈逐年上升的趋势。胃癌的早期诊断率较低,而且是一种多因素导致、致病机制复杂的肿瘤,在胃癌研究与诊治方面仍然需要大量研究[1-3]。萝卜硫素主要提取于十字花科蔬菜中的一种异硫氰酸酯类活性物质,包括西兰花、花椰菜及甘蓝菜等[4]。近年来较多的研究发现萝卜硫素可以预防、延缓及逆转肿瘤发生之前的病理改变,并且对多种肿瘤表现出较好的药理作用[5-8],也许会成为临床上常用的抗肿瘤药物。早期报道肿瘤坏死因子受体相关分子6(Traf6)/转化生长因子-β活化激酶1(TAK1)信号通路的活化在细胞凋亡中起着重要的作用,Traf6作为一种衔接蛋白可以介导LTR4信号的传导,最终激活核转录因子-κB(NF-κB)信号通路,诱导细胞凋亡的发生[9-10]。贺云冲等[11]研究发现萝卜硫素可以抑制胃癌细胞的生长和侵袭,抑制炎症因子的表达,也许是胃癌辅助治疗的新途径,但对其作用机制目前尚不清楚。因此,本实验研究Traf6/TAK1信号通路在萝卜硫素诱导胃癌细胞(HGC27)凋亡中的作用。
1 材料及方法 1.1 药品及试剂萝卜硫素(上海宝曼生物科技有限公司,批号:4478-93-7,纯度≥99%);DMEM培养基及0.25%胰酶(上海谷歌生物有限公司);胎牛血清(美国Gibco公司,批号:110524);CCK8试剂盒(江苏碧云天生物科技研究所,批号:WH1175);Annexin-FITC细胞凋亡试剂盒(江苏凯基生物有限公司,批号:KGA106);BCA试剂盒(上海威奥生物科技有限公司,批号:WB0123);SDS-PAGE试剂盒(武汉谷歌生物有限公司,批号:P1320);兔抗人Traf6、TAK1、p-TAK1、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)、B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)及β-actin等多克隆一抗(英国Abcam公司),HRP标记山羊抗兔IgG(武汉谷歌生物科技有限公司)。
1.2 细胞培养与药物处理人胃癌细胞株HGC27购自武汉巴菲尔生物有限公司,HGC27细胞用1640培养基进行培养,包含10%胎牛血清和1%青霉素-链霉素,然后置于37 ℃、5% CO2的恒湿培养箱中进行培养。待细胞生长至培养瓶底的90%左右时便可进行消化传代培养。然后取对数生长期的细胞接种于96孔板或6孔板,待细胞贴壁后加入不同浓度的萝卜硫素(15、30、60 mg/L)处理细胞,再进行后续实验。
1.3 细胞活力检测取生长对数期细胞,0.25%Trypsin+0.02%EDTA消化离心,计数后,以1×104/孔细胞铺96孔板,37 ℃、5% CO2的恒湿培养箱中孵育培养过夜。然后分别加药(正常组、15、30、60 mg/L组),分别培养24、48、72 h后,使用CCK8试剂盒检测细胞活力。独立重复实验4次。
1.4 细胞凋亡检测取生长对数期细胞,然后以1×105/孔细胞数接种于6孔板中,培养过夜后,吸尽旧培养基,然后加入含不同浓度萝卜硫素(15、30、60 mg/L)的新鲜培养基继续孵育处理24 h后,除去孔内培养基,用磷酸盐缓冲液(PBS)清洗细胞3次,加入不含乙二胺四乙酸(EDTA)的胰酶进行消化收集细胞,再用PBS清洗细胞3次,5 000 r/min离心6 min,收集细胞。然后将细胞重悬后加入5 μL PI混匀,利用流式细胞仪检测细胞凋亡率。
1.5 蛋白免疫印迹(Western Blot)检测蛋白表达取生长对数期细胞,然后以1×105/孔细胞数接种于6孔板中,培养过夜后,吸尽旧培养基,然后加入含不同浓度萝卜硫素(15、30、60 mg/L)的新鲜培养基继续孵育处理24 h后,收集细胞裂解,检测蛋白浓度,然后每孔以50 μg蛋白量上样进行凝胶电泳分离,电压设置为70 V;待分离完成后进行转膜,电流设定为275 mA、时间为70 min。接着将膜放入5%脱脂奶粉中封闭1 h,孵育一抗过夜,用TBST洗膜3次后室温条件孵育对应HRP标记二抗1 h,再次洗膜3次,ECL显影后便可进行蛋白表达分析。
1.6 统计学分析采用SPSS 20.0软件进行统计分析,实验数据用均数±标准差(x±s)表示,细胞增殖抑制实验采用重复测量方差分析,其他实验结果组间比较采用单因素方差分析,P < 0.05表示差异具有统计学意义。
2 结果 2.1 HGC27细胞增殖抑制实验结果经不同剂量萝卜硫素作用后的HGC27细胞,生长活性受到不同程度的抑制,见表 1。以正常细胞为对照,低剂量萝卜硫素对HGC27细胞的抑制率较低,差异有统计学意义(P < 0.05)。随着药物浓度和处理时间的增加,HGC27细胞的增殖抑制率明显升高,相对于对照组而言差异均有统计学意义(P < 0.05),且细胞的增殖抑制率呈时间-浓度依赖性。

|
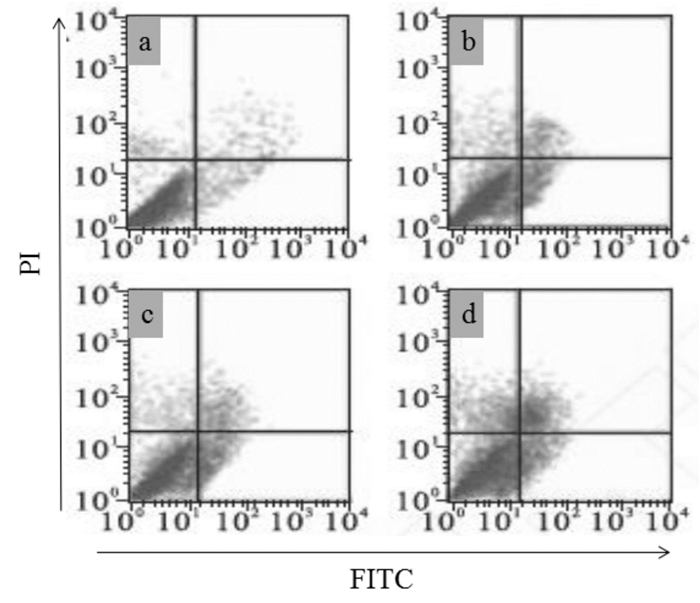
不同剂量的萝卜硫素对HGC27细胞凋亡率的影响结果如图 1、表 2所示。药物处理细胞24 h后,与正常对照组相比,3种浓度药物干预组中细胞的凋亡率显著升高(P < 0.05)。正常细胞的凋亡率为(5.42±0.42)%,而低、中、高剂量萝卜硫素组中细胞的凋亡率上升至(12.52±1.21)%、(21.46±2.14)%及(33.41±3.94)%。
|
| 图 1 萝卜硫素对HGC27细胞凋亡的影响 Fig. 1 The effect of sulforaphane on the apoptosis of HGC27 cells a:对照组;b:15 μg/mL萝卜硫素组;c:30 μg/mL萝卜硫素组;d:60 μg/mL萝卜硫素组 |
|
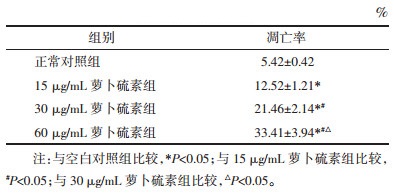
采用Western Blot方法,以未加药物处理细胞为对照,HGC27细胞经低、中、高剂量萝卜硫素作用24 h后,凋亡相关蛋白发生不同程度的变化,如图 2。其中促凋亡蛋白Caspase-3和Bax表达随着药物浓度的升高而增强,而抗凋亡蛋白Bcl-2表达水平则随药物剂量的升高而降低,他们与空白对照组相比差异均有统计学意义(P < 0.05),表现出浓度依赖性。
|
| 图 2 萝卜硫素对Caspase-3、Bax及Bcl-2蛋白表达水平的影响 Fig. 2 The effect of sulforaphane on the expression of Caspase-3, Bax and Bcl-2 protein a:空白对照组;b:15 μg/mL萝卜硫素组;c:30 μg/mL萝卜硫素组;d:60 μg/mL萝卜硫素组。与空白对照组比较,*P < 0.05;与15 μg/mL萝卜硫素组比较,#P<0.05;与30 μg/mL萝卜硫素组比较,ΔP < 0.05 |
采用Western blot方法,以未加药物处理细胞为对照,HGC27细胞经低、中、高剂量萝卜硫素作用24 h后,Traf6/TAK1信号通路蛋白表达量发生不同程度的变化,如图 3。Traf6蛋白在萝卜硫素的诱导下,其表达量随着药物浓度的升高而增强,说明萝卜硫素可以促进Traf6表达;与此同时,TAK1的磷酸化水平也显著升高,呈现出剂量依赖性,与正常对照组相比差异有统计学意义(P < 0.05)。由此说明,萝卜硫素可以通过活化Traf6/TAK1信号通路诱导细胞凋亡的发生。
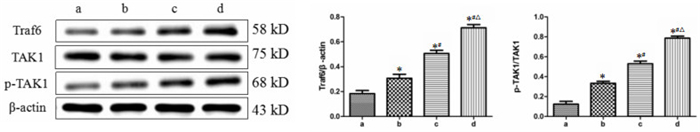
|
| 图 3 萝卜硫素对Traf6/TAK1信号通路的影响 Fig. 3 The effect of sulforaphane on the Traf6/TAK1 signaling pathway a:空白对照组;b:15 μg/mL萝卜硫素组;c:30 μg/mL萝卜硫素组;d:60 μg/mL萝卜硫素。与空白对照组比较,*P < 0.05;与15 μg/mL萝卜硫素组比较,#P < 0.05;与30 μg/mL萝卜硫素组比较,ΔP < 0.05 |
细胞凋亡是机体保证内环境平衡的自我调控机制[12],细胞增殖与凋亡相互之间的稳定在多种肿瘤的发生发展中有着重要作用[13],细胞凋亡是一种程序化、多基因调节的细胞死亡过程,这一过程在抗肿瘤的治疗方面上已成为研究的主要方向。本实验结果发现,萝卜硫素在15~60 μg/mL浓度范围内,均可以表现出对胃癌HGC27细胞增殖的抑制作用,并且随着药物剂量及药物作用时间的延长,细胞增殖抑制率也随之显著升高,呈现出一定浓度和时间依赖性。接着采用流式细胞仪对HGC27细胞凋亡的情况进行研究发现,细胞凋亡率随着药物剂量的升高而增加,表现出明显的剂量依赖性。实验结果说明萝卜硫素可以抑制胃癌细胞的增殖,并促使其发生早期凋亡。
TAK1受多种因素的刺激可以介导胞外信号的传导,转化生长因子-β(TGF-β)、Toll样受体(TLR)、CD4及B细胞受体等细胞因子介导的信号均可由TAK1的磷酸化发挥相应的生物学效应[14]。研究报道Traf6表达水平上升可促使TAK1的磷酸化,进而诱导细胞炎症、凋亡及氧化应激损伤的发生[15]。并且Trfa6/TAK1通路可介导TLR4信号传导激活NF-κB通路介导细胞凋亡的发生[9-10]。其中TAK1的磷酸化可以活化或者阻滞多条信号传导,如Bcl-2/Bax、mTOR及Caspase-9等。其中Bcl-2/Bax通路蛋白在细胞凋亡发生过程中起着关键的作用,也是TAK1信号传导的重要下游靶标[16]。Bcl-2家族包括抗凋亡相关蛋白(如Bcl-2)和促凋亡相关蛋白(如Bax)等,在细胞凋亡中起着关键作用,其中Bcl-2/Bax蛋白含量的平衡在细胞是否发生凋亡中起着决定性作用。本实验结果也发现萝卜硫素可以明显诱导Traf6及p-TAK1水平,还抑制了抗凋亡蛋白Bcl-2的表达,并诱导了促凋亡蛋白Caspase-3、Bax的表达。于是,萝卜硫素可以活化Traf6/TAK1的信号传导,使Bcl-2/Bax蛋白表达量出现失衡,活化凋亡信号,诱导胃癌细胞的凋亡。
综上所述,萝卜硫素能够抑制人胃癌细胞的增殖,诱导其凋亡,其作用机制可能与活化Traf6/TAK1信号通路相关。
| [1] | 陈宗营. 胃癌的发病机制及治疗的研究进展[J]. 社区医学杂志, 2012, 10 (4): 56–58. |
| [2] | 王婕敏, 林三仁. 胃癌研究及诊治新进展[J]. 胃肠病学和肝病学杂志, 2012, 21 (1): 3–5. DOI:10.3969/j.issn.1006-5709.2012.01.002 |
| [3] | 廖毅, 邓媛, 傅建伟. 胃癌分子机制的研究进展[J]. 中国肿瘤, 2014, 23 (4): 58–62. |
| [4] | Zhang Y, Talalay P, Cho CG, et al. A major inducer of anticarcinogenic protective enzymes from broccoli:Isolation and elucidation of structure[J]. Proc Natl Acad Sci USA, 1992, 89 (6): 2399–2403. DOI:10.1073/pnas.89.6.2399 |
| [5] | Wang L, Tian Z, Yang Q, et al. Sulforaphane inhibits thyroid cancer cell growth and invasiveness through the reactive oxygen species-dependent pathway[J]. Oncotarget, 2015, 6 (28): 25917–25931. |
| [6] | Alumkal JJ, Slottke R, Schwartzman J, et al. A phase Ⅱ study of sulforaphane-rich broccoli sprout extracts in men with recurrent prostate cancer[J]. Invest New Drugs, 2015, 33 (2): 480–489. DOI:10.1007/s10637-014-0189-z |
| [7] | Appari M, Babu KR, Kaczorowski A, et al. Sulforaphane, quercetin and catechins complement each other in elimination of advanced pancreatic cancer by miR-let-7 induction and K-ras inhibition[J]. Int J Oncol, 2014, 45 (4): 1391–1400. DOI:10.3892/ijo.2014.2539 |
| [8] | Jo GH, Kim GY, Kim WJ, et al. Sulforaphane induces apoptosis in T24 human urinary bladder cancer cells through a reactive oxygen species-mediated mitochondrial pathway:the involvement of endoplasmic reticulum stress and the Nrf2 signaling pathway[J]. Int J Oncol, 2014, 45 (4): 1497–1506. DOI:10.3892/ijo.2014.2536 |
| [9] | Jung SM, Lee JH, Park J, et al. Smad6 inhibits non-canonical TGF-β1 signalling by recruiting the deubiquitinase A20 to TRAF6[J]. Nat Commun, 2013, 4 (14): 2562–2571. |
| [10] | Várady G, Sarkadi B, Fátyol K. TTRAP is a novel component of the non-canonical TRAF6-TAK1 TGF-β signaling pathway[J]. PLoS One, 2011, 6 (9): e25548. DOI:10.1371/journal.pone.0025548 |
| [11] | 贺云冲, 贾侃, 王川, 等. 西兰花提取物萝卜硫素抑制胃癌和胰腺癌的生长与侵袭[J]. 科技通报, 2015, 31 (9): 62–68. DOI:10.3969/j.issn.1001-7119.2015.09.014 |
| [12] | LaCasse EC, Mahoney DJ, Cheung HH, et al. IAP-targeted therapies for cancer[J]. Oncogene, 2008, 27 (28): 6252–6275. |
| [13] | Huang WS, Wang JP, Wang T, et al. ShRNA-mediated gene silencing of beta-catenin inhibits growth of human colon cancer cells[J]. World J Gastroenterol, 2007, 13 (48): 6581–6587. DOI:10.3748/wjg.v13.i48.6581 |
| [14] | Landstrom M. The TAK1-TRAF6 signalling pathway[J]. The International Journal of Biochemistry & Cell Biology, 2010, 42 (21): 585–589. |
| [15] | Gong J, Li ZZ, Guo S, et al. Neuron-specific tumor necrosis factor receptor-associated factor 6 is a central regulator of neuronal death in acute ischemic stroke[J]. Hypertension, 2015, 23 (12): 604–615. |
| [16] | Kimura N, Matsuo R, Shibuya H, et al. BMP2-induced apoptosis is mediated by activation of the TAK1-p38 kinase pathway that is negatively regulated by Smad6[J]. J Biol Chem, 2000, 275 (23): 17647–17652. DOI:10.1074/jbc.M908622199 |
2. Enshi Maternal and Child Health Care and Family Planning Service Center, Enshi 445000, China
 2018, Vol. 35
2018, Vol. 35