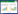文章信息
- 李芮琳, 刘文杰, 袁庆, 张彤, 徐耀, 胡利民, 柴丽娟
- LI Ruilin, LIU Wenjie, YUAN Qing, ZHANG Tong, XU Yao, HU Limin, CHAI Lijuan
- 心脑舒通胶囊对氧糖剥夺/复氧星形胶质细胞神经营养因子分泌的影响及对神经元的保护作用
- Effect of Xinnao Shutong Capsules on secretion of neurotrophic factor in oxygen-glucose deprivation/reoxyge nation astrocytes and protection of neurons
- 天津中医药, 2019, 36(1): 63-66
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(1): 63-66
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.01.17
-
文章历史
- 收稿日期: 2018-08-28
2. 方剂学教育部重点实验室, 天津 300193;
3. 天津市中药药理学重点实验室, 天津 300193
星形胶质细胞是中枢神经胶质细胞中数量最多功能最复杂的一类细胞[1]。近年来的研究发现,星形胶质细胞除有维持血管、神经元胞体、轴突和突触结构稳定的功能外[2],还有分泌神经营养因子,如脑源性神经营养因子(BDNF)、胶质源性神经营养因子(GDNF)、睫状神经营养因子(CNTF)等的功能[3]。BDNF、GDNF、CNTF对氧糖剥夺/复氧(OGD/R)处理后神经细胞的存活、分化及神经再生、空间认知能力等方面起重要作用,对脑缺血缺氧所致的脑损伤有保护作用,可促进周围神经损伤的轴突生长、髓鞘的形成和突触形成[4-5]。
心脑舒通胶囊的主要成分为蒺藜总皂苷,具有活血化瘀,舒利血脉等生理活性,主要用于中风恢复期半身不遂、语言障碍等心脑血管缺血性疾患[6]。本实验通过建立可靠的体外OGD/R损伤模型,研究心脑舒通对星形胶质细胞的影响及对神经营养因子表达的影响,以及经心脑舒通处理的星形胶质细胞条件培养液对神经元存活的影响。初步探讨心脑舒通的神经保护作用,为临床用药提供一定的理论依据。
1 材料 1.1 实验细胞星形胶质细胞株C8-D1A(武汉大学细胞保藏中心);Neuro-2A神经元细胞(美国ATCC公司)。
1.2 实验仪器及试剂心脑舒通胶囊(吉林敖东有限公司,批号为Z22021965);MEM培养基(美国Corning公司,批号为10-022-CVR);胎牛血清(美国Biological Industries公司,批号为1552680);0.25%胰蛋白酶(美国Gibco公司,批号为1894156);CCK-8试剂盒(日本同仁化学公司,批号为CK04);酶免疫吸附(ELISA)试剂盒(武汉华美生物,批号分别为CSB-E04501h、CSB-E04566r、CSB-EL005683CH);CO2恒温培养箱(美国Thermo公司);低温高速离心机(美国Beckman公司),多功能读板机(瑞士Tecan公司);缺氧小室(加拿大Stemcell公司)。
2 方法 2.1 药物配制准确称量心脑舒通胶囊中的药粉质量,用细胞培养液配制成10 mg/mL浓度,用0.75 μm一次性过滤器过滤药液,之后用细胞培养液稀释为不同浓度的工作液。
2.2 小鼠胶质细胞株C8-D1A、神经元细胞株Neuro-2A的培养复苏C8-D1A胶质细胞株,MEM全培基(10%胎牛血清;1%丙酮酸钠;1%双抗)培养,待细胞生长至汇合后用0.25%胰酶消化传代。待细胞稳定3~4代后用于实验。每4~5日细胞传代1次。
复苏Neuro-2A神经元细胞株,MEM全培基(MEM,10%胎牛血清,1%双抗,2 mmol/L的L-谷氨酰胺)培养,待细胞生长至汇合后用0.25%胰酶消化传代。待细胞稳定3~4代后用于实验。每4~5日细胞传代1次。
2.3 对正常培养胶质细胞活力的影响将生长稳定的C8-D1A种植于96孔板,细胞覆盖约60%时,置换细胞培养液为含有不同浓度心脑舒通(10 pg/mL、100 pg/mL、1 ng/mL、10 ng/mL、100 ng/mL、1 μg/mL、10 μg/mL)的无血清MEM培养基孵育24 h,培养24 h弃去培养液,加入CCK-8后于450 nm处测定吸光度,记录数据进行统计分析。
2.4 对氧糖剥夺/复氧处理胶质细胞活力的影响将生长稳定的C8-D1A种植于96孔板,细胞覆盖约60%时,弃去原培养液,用无糖KRP缓冲液洗涤细胞2次后加入无糖KRP缓冲液放入缺氧小室中,而后将缺氧小室中充注95%N2+5%CO2,密封放入37 ℃、5% CO2培养箱培养4 h。4 h后将KRP置换为含有不同浓度心脑舒通(0 pg/mL、10 pg/mL、100 pg/mL、1 ng/mL、10 ng/mL、100 ng/mL、1 μg/mL、10 μg/mL)无血清MEM培养基孵育,0 pg/mL为模型组(Mod);对照组(Con)用含糖KRP缓冲液清洗细胞2次后,加入含糖KRP缓冲液,放入37 ℃、5% CO2培养箱正常孵育4 h,而后加入无血清全培进行培养。培养20 h后弃去培养液,CCK-8法测定细胞活力,多功能读板机450 nm波长处测定吸光度。
2.5 对体外OGD/R胶质细胞神经营养因子(BDNF、GDNF、CNTF)释放的影响将生长稳定的C8-D1A细胞种植于24孔板,待细胞覆盖约80%时,细胞按上述步骤进行OGD/R及加药处理。48 h后收集细胞上清液,3 000 r/min,15 min,25 ℃离心,吸取上清液于新的200 μL离心管中。参照ELISA试剂盒相关操作说明进行操作,均在540 nm波长处测定吸光度,记录数据进行统计分析。
此部分胶质细胞培养上清液同时也收集备用为胶质细胞条件培养液,用于后续对OGD/R神经元细胞保护作用的研究。细胞分组如下:正常对照组(Con)、模型组(Mod)、心脑舒通不同浓度组(0.1、1、10 μg/mL)。
2.6 心脑舒通处理C8-D1A细胞条件培养液对OGD/R神经元的保护作用将Neuro-2A细胞用神经元完全培养液(MEM,10%胎牛血清,1%双抗,0.5% L-谷氨酰胺)悬浮,以6.25×104个/cm2接种于96孔板中,待细胞生长融合约80%时,进行实验。按2.3步骤对Neuro-2A细胞进行OGD/R处理,模型组在复氧的同时加入经心脑舒通处理过的胶质细胞条件培养液培养20 h后,CCK-8法测定神经元细胞活力。细胞具体分组如下:正常对照组(Con)、模型组(Mod)、不同浓度心脑舒通处理胶质细胞条件培养液组(0.1、1和10 μg/mL)。
2.7 统计学分析所有实验数据采用SPSS 19.0进行统计处理,组间差异性比较采用单因素方差分析,P < 0.05为差异具有统计学意义。
3 结果 3.1 心脑舒通对正常及OGD/R损伤C8-D1A细胞活力的影响见图 1(A),与对照组相比,心脑舒通在不同浓度范围内对正常培养C8-D1A细胞活力均没有影响,表明实验所选用心脑舒通的各浓度对胶质细胞均无毒副作用。
|
| 与Con组比较,#P<0.05;与Mod组比较,*P<0.05。 图 1 心脑舒通对正常(A)及OGD/R损伤胶质细胞(B)增殖的影响(n=18) Fig. 1 Effects of Xinnao Shutong on normal (A) and OGD/R injury (B) astrocytes cell viability(n=18) |
见图 1(B),与对照组相比,模型组及心脑舒通不同浓度组均能提高OGD/R损伤C8-D1A细胞的增殖。与模型组相比,心脑舒通在10 μg/mL时对OGD/R损伤的C8-D1A细胞有保护作用。
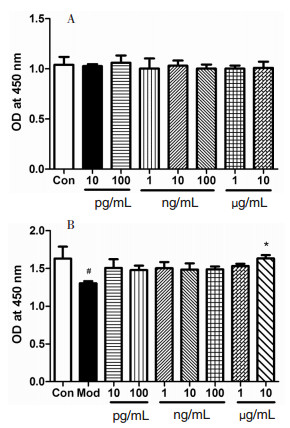
3.2 对OGD/R损伤的C8-D1A细胞BDNF、GDNF、CNTF合成分泌的影响从图 2可以看出,与对照组相比,模型组BDNF有少许升高,不同浓度心脑舒通可以显著促进OGD/R损伤C8-D1A细胞BDNF的释放。与模型组相比,心脑舒通0.1 μg/mL可以显著提高胶质细胞BDNF的释放。与对照组相比,模型组胶质细胞GDNF、CNTF的分泌释放有升高趋势,但不具有统计学差异。与模型组比较,不同浓度心脑舒通对OGD/R损伤C8-D1A细胞BDNF的分泌促进作用也不明显。
|
| 与Mod组比较,*P<0.05。 图 2 心脑舒通对OGD/R胶质细胞BDNF、GDNF、CNTF释放的影响(n=6) Fig. 2 Effects of Xinnao Shutong on the release of BDNF, GDNF and CNTF from OGD/R astrocytes (n=6) |
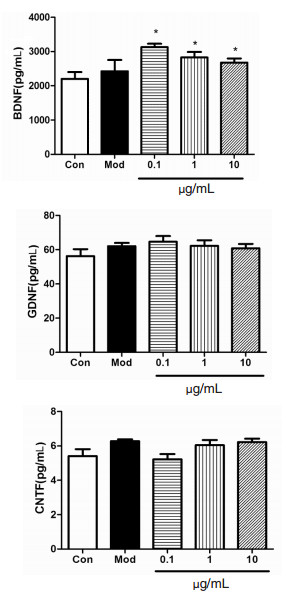
从图 3可以看出,与对照组比较,来源于胶质细胞模型组的条件培养液显著降低了OGD/R神经元的细胞活力,显著抑制了神经元细胞的活力。而用心脑舒通处理过的胶质细胞条件培养液培养缺氧复氧的神经元20 h后,0.1 μg/mL心脑舒通可以明显提高OGD/R神经元的存活能力。
|
| 与Con组比较,#P<0.05;与Mod组比较,*P<0.05。 图 3 心脑舒通处理的胶质细胞条件培养液对神元细胞的保护作用(n=18) Fig. 3 Protective effect of conditioned medium of glial cells treated with Xinnao Shutong on neurons(n=18) |
神经营养因子在缺血性脑损伤的发生和发展方面有着重要作用,脑缺血可导致神经元凋亡甚至死亡[7]。研究表明,脑缺血再灌注损伤中,反应性星形胶质细胞分泌BDNF、GDNF、CNTF等的能力增强,并通过分泌这些神经营养因子来促进神经元的修复和再生[8]。郭大志等[9]通过实验表明,BDNF可通过抵抗一氧化氮(NO)介导的谷氨酸细胞毒性和抑制细胞凋亡来保护神经元,从而减少缺血性脑损伤。GDNF不仅能提高神经元抗损伤能力,并且具有促进轴突生长作用[10]。在神经系统发育过程中,CNTF作为促进胶质细胞和神经元存活和分化的一种营养因子,对胶质细胞和神经元起到保护作用[11]。
从实验结果可以看出,心脑舒通对正常培养胶质细胞系C8-D1A细胞活力没有显著影响,但可以提高OGD/R的胶质细胞增殖,其中10 μg/mL时对OGD/R后的C8-D1A胶质细胞有明显促增殖作用。另外,心脑舒通在0.1 μg/mL时可以显著提高OGD/R后胶质细胞BDNF的释放,而对具有抵抗缺血损伤能力的GDNF、CNTF因子来说,心脑舒通对其释放量均无显著影响。从心脑舒通处理的胶质细胞条件培养液对OGD/R损伤神经元的作用结果看,与对照组比较,模型组条件培养液显著降低损伤神经元的细胞活力,表明星形胶质细胞的过度活化可能参与促进缺血后神经细胞的损伤过程,从而加重了神经细胞的损伤。而心脑舒通在0.1 μg/mL时可以显著提高损伤后神经元的活力,该保护作用有可能是通过胶质细胞释放BDNF而发挥作用。
总之,本研究表明心脑舒通可以促进OGD/R损伤后的胶质细胞增殖及生长因子的释放,促进OGD/R损伤神经元的存活,为临床治疗提供了一些理论依据,但其机制有待进一步的深入研究。
| [1] |
Ziemka-Nalecz M, Jaworska J, Zalewska T. Insights into the neuroinflammatory responses after neonatal hypoxia-ischemia[J]. J Neuropathol Exp Neurol, 2017, 76(8): 644-654. DOI:10.1093/jnen/nlx046 |
| [2] |
Jakovcevski M, Akbarian S, Di Benedetto B. Pharmacological modulation of astrocytes and the role of cell type-specific histone modifications for the treatment of mood disorders[J]. Curr Opin Pharmacol, 2016(26): 61-66. |
| [3] |
Schizas N, Konig N, Andersson B, et al. Neural crest stem cells protect spinal cord neurons from excitotoxic damage and inhibit glial activation by secretion of brain-derived neurotrophic factor[J]. Cell Tissue Res, 2018, 372(3): 493-505. DOI:10.1007/s00441-018-2808-z |
| [4] |
Wei H, Sun T, Tian Y, et al. Ginkgolide B modulates BDNF expression in acute ischemic stroke[J]. J Korean Neurosurg Soc, 2017, 60(4): 391-396. DOI:10.3340/jkns.2016.1010.018 |
| [5] |
Li W, Li X, Du Q, et al. Effect of tongluojiunao injection made from sanqi (Radix Notoginseng) and zhizi (Fructus Gardeniae) on brain microvascular endothelial cells and astrocytes in an in vitro ischemic model[J]. J Tradit Chin Med, 2014, 34(6): 725-732. DOI:10.1016/S0254-6272(15)30088-1 |
| [6] |
杜宝奎. 心脑舒通胶囊治疗脑血栓形成后遗症的临床效果[J]. 中国实用医药, 2015, 10(5): 29-30. |
| [7] |
Ahmad M, Dar NJ, Bhat ZS, et al. Inflammation in ischemic stroke:mechanisms, consequences and possible drug targets[J]. CNS Neurol Disord Drug Targets, 2014, 13(8): 1378-1396. DOI:10.2174/1871527313666141023094720 |
| [8] |
崔鹤鹛.脑卒中后星形胶质细胞的神经保护及神经修复作用及分子机制[D].石家庄: 河北医科大学, 2017.
|
| [9] |
郭大志, 冯园, 胡慧军, 等. 高压氧对急性一氧化碳中毒大鼠少突胶质细胞前体细胞ADAM10 mRNA表达的影响[J]. 中国医药导报, 2018, 15(5): 9-12. |
| [10] |
Cortes D, Carballo-Molina OA, Castellanos-Montiel MJ, et al. The non-survival effects of glial cell line-derived neurotrophic factor on neural cells[J]. Front Mol Neurosci, 2017, 10: 258. DOI:10.3389/fnmol.2017.00258 |
| [11] |
Sun M, Liu H, Min S, et al. Ciliary neurotrophic factor-treated astrocyte-conditioned medium increases the intracellular free calcium concentration in rat cortical neurons[J]. Biomed Rep, 2016, 4(4): 417-420. DOI:10.3892/br.2016.602 |
2. Key Laboratory of Pharmacology of Traditional Chinese Medical Formulae Ministry of Education, Tianjin 300193, China;
3. Tianjin Key Laboratory of Chinese Medicine Pharmacology, Tianjin 300193, China
 2019, Vol. 36
2019, Vol. 36