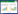文章信息
- 曹旭丹, 任春梅, 和田田, 李素华, 李莉
- CAO Xudan, REN Chunmei, HE Tiantian, LIi Suhua, LI Li
- 水飞蓟宾对离体心脏组织缺血再灌注损伤保护作用及机制研究
- Protective effect and mechanism of Silibinin on isolated heart tissue ischemia-reperfusion injury
- 天津中医药, 2019, 36(1): 67-70
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(1): 67-70
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.01.18
-
文章历史
- 收稿日期: 2018-09-30
2. 邯郸市传染病医院, 邯郸 056000
缺血再灌注损伤严重影响着心肌梗死的治疗效果,并且还是各种心脏手术术后常见并发症,是亟待解决的医学难题。水飞蓟宾(SIL)是一种具有抗氧化、促进细胞再生等多种生物活性的水飞蓟素[1-2],既往研究发现SIL能够通过抑制氧化应激等而对局灶性脑组织缺血再灌注损伤表现出一定的保护作用[3],本研究采用Langendorff灌流系统,建立大鼠离体心脏缺血再灌注损伤模型,研究SIL对离体心脏的保护作用并探索其机制。
1 实验材料与方法 1.1 实验动物实验用SD大鼠(雄性,SPF级,体质量250~300 g,鼠龄8周)购自河北省实验动物中心,许可证号:SCXK(冀)2013-1-003。饲养环境:室温23~25 ℃、相对湿度65%~70%,光照周期12 h:12 h,手术前24 h禁食、自由饮水。
1.2 药物与试剂水飞蓟宾胶囊(天津天士力制药股份有限公司,药品规格:35 mg/粒,批号为20171103),谷草转氨酶(AST)、乳酸脱氢酶(LDH)、肌酸激酶MB同工酶(CK-MB)试剂盒,苏木精-伊红(HE)染色试剂盒(北京博奥森生物技术有限公司,批号为:150518、150324、150602、141225),Na+-ATPase、Ca2+-ATPase,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)试剂盒(南京建成生物工程研究所,批号为20170316、20170611、20151613、20150109、20150526、20141218),红四氮唑(TTC,美国Sigma公司,批号:M2128),K-H液(自制)。
1.3 实验方法 1.3.1 动物分组、造模与给药100只SD大鼠按随机数字表法随机分为正常对照组、模型组和SIL低[100 mg/(kg·d)]、中[200 mg/(kg·d)]、高[400 mg/(kg·d)]剂量组,各20只;于手术前2 h灌胃给药,正常对照组和模型组同步灌胃给予生理盐水。参照李兵等[4]报道的实验方法制备Langendorff灌流离体心脏缺血再灌注模型:麻醉后,迅速开胸取心脏,置4 ℃的K-H液,通过主动脉由Langendorff系统逆灌注含氧K-H液,其中正常对照组持续以7 mL/min恒速平衡灌注K-H液110 min,模型组和SIL各剂量组依次行7 mL/min恒速平衡灌注K-H液20 min、停灌30 min后恢复灌注60 min。左心耳处置带测压导管的球囊并连接生物信号采集系统,监测实时数据。
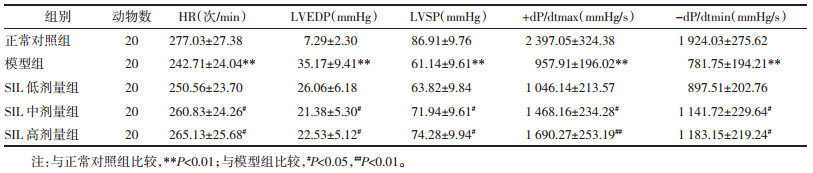
1.3.2 测定心肌酶活性取心脏冠脉流出液并通过生化分析法测定心肌酶AST、LDH、CK-MB活性。
1.3.3 测定心脏组织梗死面积各组取5只离体心脏,切片(厚度约2 mm),经-20 ℃冻存20 min后,置于1%TTC溶液中避光孵育20 min,最后通过图像分析系统测算梗死面积百分率。
1.3.4 组织病理学检查各组取5只离体心脏,多聚甲醛溶液(浓度4%)固定3 d、石蜡包埋、切片、脱蜡水化,然后行常规HE染色(依次进行乙醇梯度脱蜡、磷酸盐缓冲溶液(PBS)洗涤、苏木素染色5 min、0.5%乙醇盐酸分色、伊红染色20 s等步骤)后通过倒置光学显微镜观察心脏组织病变。
1.3.5 血流动力学指标监测通过生物信号采集系统监测并记录再灌注60 min后各离体心脏血流动力学指标,包括心率(HR)、左室舒张末压(LVEDP)、左室收缩压(LVSP)、左室收缩压最大上升速率(+dP/dtmax)、左室舒张压最大下降速率(-dP/dtmin)。
1.3.6 测定抗氧化酶活性,MDA含量及Na+-ATP、Ca2+-ATP活性取每组剩余的10只离体心脏,剪碎、研磨匀浆、经3 000 r/min低温(4 ℃)离心15 min后取上清液,按照试剂盒步骤处理后通过紫外-可见分光光度计测定抗氧化酶SOD、CAT活性,MDA含量并测定Na+-ATPase、Ca2+-ATPase活性。
1.3.7 统计学处理运用软件SPSS 19.0进行数据统计分析,数据以均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD法,P < 0.05为差异有统计学意义。
2 结果 2.1 各组离体心脏冠脉流出液AST、LDH、CK-MB活性模型组冠脉流出液AST、LDH、CK-MB活性较正常对照组显著升高(P < 0.01)。而较模型组,经SIL中、高剂量预处理能够显著降低离体心脏灌注模型冠脉流出液AST、LDH、CK-MB活性(P < 0.05或P < 0.01)。见表 1。
|
模型组离体心脏梗死面积较正常对照组显著升高[(42.09±4.97)%比0%,P < 0.01];SIL低、中、高剂量组心脏梗死面积百分率分别为(38.42±5.37)%、(31.83±5.40)%、(25.24±4.90)%,统计分析发现,SIL中、高剂量组心脏梗死面积较模型组显著降低(P < 0.05或P < 0.01)。
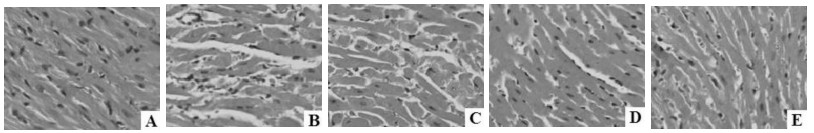
2.3 各组离体心脏组织病理学检查结果见图 1。正常对照组离体心脏组织形态和心肌细胞结构均未见异常;较正常对照组,模型组离体心脏组织呈现明显的病理学改变,主要表现为肌原纤维断裂、心肌细胞排列紊乱且出现空泡变性、胞质着色不均、胞核深染等;而较模型组,经SIL预处理能够明显改善离体心脏组织病变,以SIL高剂量组上述效果最为显著。
|
| A:正常对照组;B:模型组;C:SIL低剂量组;D:SIL中剂量组;E:SIL高剂量组。 图 1 各组离体心脏组织病理学检查结果(HE,×400) Fig. 1 Outer heart histopathological examination results in each group (HE, ×400) |
见表 2。模型组离体心脏血流动力学指标HR、LVSP、+dP/dtmax、-dP/dtmin较正常对照组显著下降且LVEDP显著升高(P < 0.01);而较模型组,经SIL中、高剂量预处理能够显著升高离体心脏组织HR、LVDP、+dP/dtmax、-dP/dtmin并显著降低LVEDP(P < 0.05或P < 0.01)。
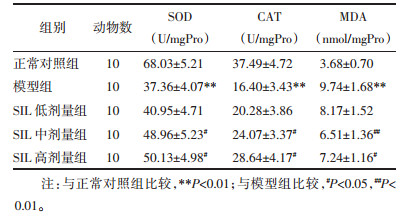
如表 3所示,模型组离体心脏组织抗氧化酶SOD、CAT活性较正常对照组显著降低且MDA含量显著升高(P < 0.01);而较模型组,经SIL中、高剂量预处理能够显著提高离体心脏组织SOD、CAT活性并降低MDA含量(P < 0.05或P < 0.01)。
|
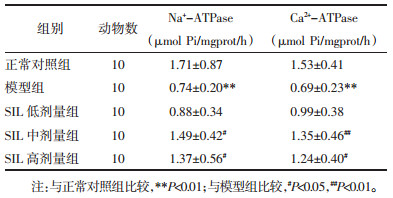
模型组离体心脏组织Na+-ATPase、Ca2+-ATPase活性较正常对照组显著降低(P < 0.01);而较模型组,经SIL中、高剂量预处理能够显著提高离体心脏组织Na+-ATPase、Ca2+-ATPase活性(P < 0.05或P < 0.01)。见表 4。
|
水飞蓟宾是一种具有多种生物学作用的水飞蓟素[1-2],本实验通过Langendorff灌流制备大鼠离体心脏缺血再灌注模型并提前给予SIL进行干预,发现经SIL预处理能够有效降低冠脉流出液心肌酶AST、LDH、CK-MB活性、减小心脏梗死面积、抑制心脏组织病变,提示SIL对离体心脏组织缺血再灌注损伤具有一定的保护作用。
体内氧自由基(ROS)过剩是导致机体氧化应激损伤的根本原因,生理状态下ROS能够在抗氧化酶SOD、CAT相继催化作用下最终被还原生成H2O和O2[5],但脑缺血再灌注后,将导致ROS过剩而攻击细胞膜,使细胞膜主要成分不饱和脂肪酸被氧化破坏,其中MDA为氧化应激损伤终产物之一,因此SOD、CAT活性和MDA含量水平分别能够直接和间接反应机体氧化应激损伤程度[6-7]。本研究发现,经SIL预处理能够提高离体心脏组织抗氧化酶SOD、CAT活性并降低MDA含量,提示SIL具有降低离体心脏缺血再灌注后氧化应激损伤的作用。
既往研究发现,细胞内Na+浓度升高而促进Na+-Ca2+交换,进而导致Ca2+内流而Ca2+超载是心肌缺血再灌注损伤的重要病理机制[8-10]。本研究发现,经SIL预处理能够有效提高离体心脏组织Na+-ATPase、Ca2+-ATPase活性,从而能够有效缓解心肌细胞内Ca2+超载,这可能是SIL抑制离体心脏缺血再灌注损伤的分子机制之一。
综上所述,SIL对离体心脏缺血再灌注损伤具有一定的抑制作用,其作用机制可能与SIL能够改善血液流变学指标、抑制氧化应激、提高Na+-ATPase、Ca2+-ATPase活力有关。
| [1] |
武艳强, 王慧娟, 冯社军, 等. 水飞蓟宾对H2O2诱导大鼠H9C2心肌细胞氧化应激损伤的保护作用[J]. 现代药物与临床, 2015, 30(5): 503-508. |
| [2] |
Wang YX, Cai H, Jiang G, et al. Silibinin Inhibits Proliferation, Induces Apoptosis and Causes Cell Cycle Arrest in Human Gastric Cancer MGC803 Cells Via STAT3 Pathway Inhibition[J]. Asian Pac J Cancer Prev, 2014, 15(16): 6791-6798. DOI:10.7314/APJCP.2014.15.16.6791 |
| [3] |
张秀侠. 水飞蓟宾对局灶性脑缺血再灌注损伤大鼠保护作用的研究[J]. 安徽医药, 2016, 20(3): 445-449. DOI:10.3969/j.issn.1009-6469.2016.03.010 |
| [4] |
李兵, 李宵, 马雪亮, 等. 丹参多酚酸盐对大鼠离体心脏缺血再灌注损伤的保护作用及机制研究[J]. 中国中医急症, 2018, 27(5): 854-857. DOI:10.3969/j.issn.1004-745X.2018.05.027 |
| [5] |
Lartigue A, Burlat B, Coutard B, et al. The Megavirus chilensis Cu, Zn-superoxide dismutase:the first viral structure of a typical cellular copper chaperone-independent hyperstable dimeric enzyme[J]. J Virol, 2015, 89(1): 824-832. DOI:10.1128/JVI.02588-14 |
| [6] |
Kwiecien S, Magierowska K, Magierowski M, et al. Role of sensory afferent nerves, lipid peroxidation and antioxidative enzymes in the carbon monoxide-induced gastroprotection against stress ulcerogenesis[J]. J Physiol Pharmacol, 2016, 67(5): 717-729. |
| [7] |
Kaminski K, Bonda T, Wojtkowska I, et al. Oxidative stress and antioxidative defense parameters early after reperfusion therapy for acute myocardial infarction[J]. Acute Card Care, 2008, 10(2): 121-126. DOI:10.1080/17482940701744334 |
| [8] |
Choi E, Cha MJ, Hwang KC. Roles of calcium regulating microRNAs in cardiac ischemia-reperfusion injury[J]. Cells, 2014, 3(3): 899-913. DOI:10.3390/cells3030899 |
| [9] |
李俊平, 郭丽丽, 陈中, 等. 钙超载与心肌缺血再灌注损伤及中药干预策略[J]. 中国中药杂志, 2016, 41(11): 2168-2173. |
| [10] |
程永生, 陈宇, 李冬. 钙超载及其在心肌缺血/再灌注损伤中的作用机制研究现状[J]. 中国医学创新, 2013, 10(3): 137-140. |
2. Handan City Infectious Disease Hospital, Handan 056001, China
 2019, Vol. 36
2019, Vol. 36