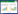文章信息
- 杨萍, 周玉平, 夏晴, 姚立鹏, 李高文, 常秀春, 王凤
- YANG Ping, ZHOU Yuping, XIA Qing, YAO Lipeng, LI Gaowen, CHANG Xiuchun, WANG Feng
- HO-1介导黄芪甲苷抗原代心肌细胞缺氧/复氧损伤作用研究
- Study of the protective effect of Astragaloside Ⅳ mediated by HO-1 against hypoxia/reoxygenation induced cell injury in primary cardiomyocytes
- 天津中医药, 2019, 36(1): 79-82
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(1): 79-82
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.01.21
-
文章历史
- 收稿日期: 2018-08-13
2. 宁波大学医学院附属医院, 宁波 315020
心肌缺氧/复氧(H/R)损伤是心肌缺血再灌注治疗后面临的治疗难题,炎症因子释放是H/R发生的重要因素[1]。血红素氧化酶-1(HO-1)是近年来发现的组织保护酶,已被证实具有抑制炎症等多种细胞保护功能[2]。黄芪广泛应用于心血管疾病的治疗,其主要药理活性成分黄芪甲苷(AS-Ⅳ),对多种心肌细胞损伤模型具有显著的保护作用,且作用机制主要与抗氧化、抗炎作用有关[3-5],但具体的靶向分子及信号通路尚不十分明确。由于HO-1是最近发现的内源性抗氧化酶,已有的研究表明其具有心肌细胞保护作用[6]。HO-1是否介导了AS-Ⅳ对H/R损伤心肌的保护作用值得研究。鉴于HO-1与AS-Ⅳ在细胞保护方面存在交集,HO-1可能介导了黄芪甲苷对H/R心肌损伤的保护作用。本研究分别以AS-Ⅳ、HO-1激动剂原卟啉氯化钴(CoPP)、HO-1拮抗剂原卟啉Ⅸ锌(Ⅱ)络合物(ZnPP)对H/R损伤的心肌细胞进行干预,解析AS-Ⅳ的心肌保护作用与HO-1之间的关系,为阐释AS-Ⅳ抗心肌缺血再灌注损伤提供理论依据。
1 材料 1.1 动物SD大鼠乳鼠,SPF级,出生1 ~ 3 d,由北京维通利华实验动物技术有限公司提供,合格证号SCXK(京)2016-0011。
1.2 药物与试剂AS-Ⅳ(成都瑞芬思生物科技有限公司,批号:170614,纯度≥99%);HO-1激动剂CoPP、HO-1拮抗剂ZnPP、四甲基噻唑蓝(MTT,美国Sigma公司);DMEM高糖培养基、胎牛血清、胰蛋白酶(美国GIBCO公司);兔抗小鼠GAPDH多克隆抗体、兔抗小鼠HO-1多克隆抗体(Santa Cruz公司);二喹啉甲酸(BCA)蛋白浓度测定试剂盒、超敏电致化学发光(ECL)试剂盒(上海碧云天生物工程有限公司);乳酸脱氢酶(LDH)、心肌肌钙蛋白(cTnT)、超敏C反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)测定试剂盒(南京建成生物工程研究所);PCR引物由上海生工生物工程有限公司合成。其他试剂均为国产分析纯。
1.3 仪器生物洁净工作台(苏州安泰空气有限公司)、恒温二氧化碳培养箱(美国Thermo公司)、倒置荧光显微镜(日本Olympus公司)、多功能酶标仪(美国Bio-Tek公司)、全自动生化分析仪(日本Hitachi公司)、逆转录反应Cycler PCR仪(美国Bio-Rad公司)、PCR扩增仪(美国Life technology公司)。
2 方法 2.1 心肌细胞原代培养参考文献[7]方法进行心肌细胞原代培养:取出生1~3 d SD大鼠乳鼠,胰酶消化法将心肌组织逐步分离成单个心肌细胞,接种至培养瓶,置于37 ℃,5% CO2饱和湿度的孵箱中培养,差速贴壁去除成纤维细胞。调整纯化后的心肌细胞浓度,接种至6孔板或96孔板中,每24 h更换1次培养液。72 h后细胞基本融合时用于实验。培养的心肌细胞经α-横纹肌肌动蛋白单克隆抗体的免疫细胞化学鉴定,原代培养乳鼠心肌细胞纯度达95%以上。
2.2 H/R损伤模型的复制参照文献[8]并加以改进建立心肌细胞H/R模型。心肌细胞置于缺氧装置中以模拟缺血溶液培养4 h后,再于常氧环境中换用模拟再灌注溶液培养4 h,即为H/R模型。
2.3 细胞分组心肌细胞悬液调整浓度后,随机分为以下5组:正常对照组、H/R组、AS-Ⅳ组(H/R造模后给予AS-Ⅳ 100 μmol/L干预24 h)、CoPP组(H/R造模后给予终浓度为20 μmol/L CoPP干预24 h)、ZnPP组(H/R造模后给予终浓度为20 μmol/L ZnPP干预24 h)。每个组设置6个复孔,实验重复2次。
2.4 MTT检测细胞活力按实验分组给予相应的处理因素后弃去上清液,每孔加入终浓度为0.5 mg/L MTT溶液100 μL,继续孵育4 h后,每孔加入150 μL二甲基亚砜(DMSO),震荡10 min,使用酶标仪在490 nm处检测其吸光度值。
2.5 LDH、cTnT含量的测定细胞分组处理后,取细胞培养液,按试剂盒操作说明检测LDH、cTnT含量。
2.6 hs-CRP、TNF-α含量的测定细胞分组处理后,取培养液,按试剂盒操作说明检测细胞上清液中hs-CRP、TNF-α含量。
2.7 蛋白免疫印迹(Western blot)法检测HO-1蛋白表达细胞分组处理后,收集细胞并提取总蛋白。取样品蛋白质50 μg,与SDS上样缓冲液混合,95 ℃~100 ℃变性5 min。制胶,上样,电泳,切胶,半干转膜器恒压12 V转PVDF膜60 min,磷酸盐吐温缓冲液(PBST)洗膜10 min×3次,以5%牛血清白蛋白(BSA)/磷酸缓冲盐溶液(PBS)封闭1 h,加入一抗中4 ℃轻摇孵育过夜,PBST洗膜10 min×3次,加入二抗室温轻摇孵育1 h,将膜置于Kodak Image Station 2000MM成像系统曝光,获取目的条带图像。Image J软件分析灰度值,以GAPDH为内参,计算HO-1蛋白相对表达量。
2.8 逆转录聚合酶链反应(RT-PCR)测定HO-1 mRNA表达按实验分组给予相应的处理后,提取心肌细胞总RNA,反转录合成cDNA。采用SYBR两步法进行PCR扩增。HO-1引物:上游5'-GCTCTATCGT-GCTCGCA TGA-3',下游5'-AATTCCCACTGCCA2C-GGTC-3'。GAPDH引物:上游5'-CCTCGTCTCAT-AGACAAGATGGT-3',下游5'-GGGTAGAGTCATA-CTGGAACATG-3'。PCR反应条件为:95 ℃ 2 min,95 ℃变性15 s,60 ℃延伸退火1 min,40个循环。
2.9 统计学方法数据采用SPSS 20.0统计软件进行分析。数据使用均数±标准差(x±s)表示。采用单因素方差one-way ANOVA进行方差分析,方差齐时采用LSD法进行组间多重比较,方差不齐时采用Dunnett's T3法进行组间多重比较。P<0.05为差异具有统计学意义。
3 结果 3.1 各组心肌细胞活力比较MTT结果显示,与正常对照组比较,H/R组心肌细胞活力显著下降(P<0.05);与H/R组比较,HO-1抑制剂ZnPP组细胞活力显著降低(P<0.05),HO-1激动剂CoPP组则显著升高(P<0.05),说明增加HO-1可减轻H/R诱导的细胞损伤。与H/R组比较,AS-Ⅳ组细胞活力显著增加(P<0.05),具有类似HO-1激动剂样作用。结果见图 1。
|
| 与正常对照组比较,#P<0.05;与H/R组比较,*P<0.05。1:正常对照组;2:H/R组;3:CoPP组;4:ZnPP组;5:AS-Ⅳ组。 图 1 各组的细胞活力 Fig. 1 Cardiomyocytes viability in each group |
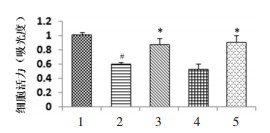
与正常对照组比较,H/R组细胞上清LDH、cTnT含量显著增加(P<0.01);ZnPP则显著加重H/R导致的上述指标变化;与H/R组比较,CoPP组心肌细胞LDH、cTnT含量显著降低(P<0.01),说明HO-1可减轻H/R导致的细胞损伤。与H/R组比较,AS-Ⅳ可显著降低H/R预处理后的LDH、cTnT含量,说明AS-Ⅳ具有类似HO-1激动剂样作用。结果见图 2。
|
| 与正常组比较,##P<0.01;与H/R组比较,**P<0.01。1:正常对照组;2:H/R组;3:CoPP组;4:ZnPP组;5:AS-Ⅳ组。 图 2 各组LDH和cTnT表达的水平 Fig. 2 Levels of LDH and cTnT in each group |
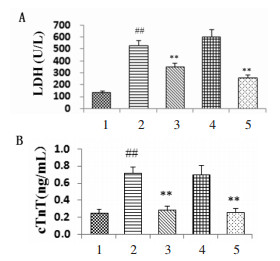
与正常对照组比较,H/R组细胞上清炎症因子hs-CRP、TNF-α表达显著升高(P<0.01);与H/R比较,CoPP组hs-CRP、TNF-α表达水平显著降低(P<0.01),说明HO-1激动剂可减轻H/R导致的炎症损伤。与H/R比较,AS-Ⅳ可显著降低hs-CRP、TNF-α表达水平,说明AS-Ⅳ具有类似HO-1激动剂样作用。结果见图 3。
|
| 与正常对照组比较,##P<0.01;与H/R组比较,**P<0.01。1:正常对照组;2:H/R组;3:CoPP组;4:ZnPP组;5:AS-Ⅳ组。 图 3 各组hs-CRP、TNF-α表达的水平 Fig. 3 Levels of hs-CRP and TNF-α in each group |
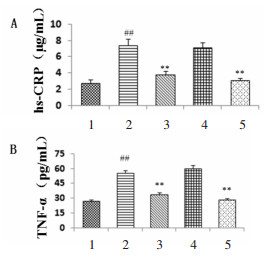
PCR及Western blot结果显示,与正常对照组比较,H/R组HO-1 mRNA及蛋白表达均显著升高(P<0.01);与H/R比较,CoPP组HO-1 mRNA及蛋白表达水平均进一步升高(P<0.01),ZnPP组则显著下降(P<0.01)。与H/R比较,AS-Ⅳ组HO-1 mRNA及蛋白表达水平均显著升高(P<0.01),具有HO-1激动剂CoPP样作用。结果见图 4。
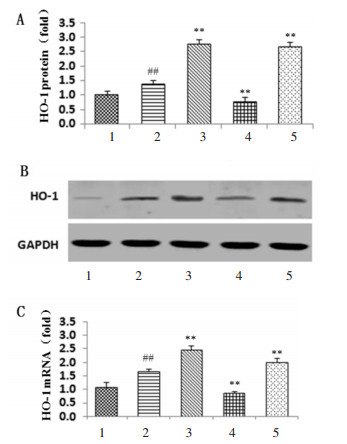
|
| 与正常对照组比较,##P<0.01;与H/R组比较,**P<0.01。1:正常对照组;2:H/R组;3:CoPP组;4:ZnPP组;5:AS-Ⅳ。 图 4 各组AS-Ⅳ、CoPP及ZnPP对缺氧/复氧预处理后HO-1 mRNA及蛋白表达水平的影响 Fig. 4 Effects of the mRNA and protein expression levels of HO-1 after H/R intervention by AS-Ⅳ, CoPP and ZnPP in each group |
HO-1是一种应激反应蛋白,近年来被公认为是一种重要组织保护酶[2],如药物诱导HO-1表达增加可减轻脂多糖(LPS)诱导的肺动脉平滑肌细胞损伤[7]。HO-1对多种心肌损伤模型具有保护作用,其机制包括增加一氧化碳(CO)水平,调节内皮型一氧化氮(eNOS)、核转录因子-κB(NF-κB)活性,TNF-α、白介素-1β(IL-1β)、白介素-6(IL-6)水平,减少斑块炎症反应和细胞凋亡[8-9]。研究结果表明HO-1对心肌细胞H/R损伤具有保护作用,其机制与抑制炎症因子表达有关。因此,HO-1是治疗心肌缺血再灌注损伤一个很好的干预靶点,通过各种方式诱导HO-1表达必然在细胞保护方面发挥重要作用。
根据患者的临床特征,中医学者认为心肌缺血再灌注损伤的病机以心气虚衰为本,故中医治则当益气扶正以固本[10]。黄芪有健脾补中、补气固表、升阳举陷等功效,成为中医临床最常用的补气扶正中药。AS-Ⅳ是黄芪药理活性的主要物质之一。实验研究证实AS-Ⅳ对多种心肌细胞损伤模型具有显著的保护作用,具有增强心肌收缩力、改善心肌能量代谢、抑制心肌纤维化和心肌细胞凋亡作用[3]。本研究通过HO-1激动剂CoPP、HO-1抑制剂ZnPP分别干预H/R损伤心肌细胞,验证了HO-1通过抑制炎症因子表达对心肌细胞损伤发挥保护作用,进一步证实了AS-Ⅳ对H/R损伤的心肌细胞具有保护作用,其机制与诱导具有保护作用的HO-1表达有关,为阐释AS-Ⅳ抗心肌缺血再灌注损伤提供了理论依据。
| [1] |
Hüttemann M, Helling S, Sanderson TH, et al. Regulation of mitochondrial respiration and apoptosis through cell signaling:cytochrome c oxidase and cytochrome c in ischemia/reperfusion injury and inflammation[J]. Biochim Biophys Acta, 2012, 1817(4): 598-609. DOI:10.1016/j.bbabio.2011.07.001 |
| [2] |
Ndisang JF. Synergistic interaction between heme oxygenase (HO) and nuclear-factor E2-related factor-2(Nrf2) against oxidative stress in cardiovascular related diseases[J]. Curr Pharm Des, 2017, 23(10): 1465-1470. DOI:10.2174/1381612823666170113153818 |
| [3] |
孙豪栋, 庞晓斌, 李继扬. 黄芪甲苷生物活性研究进展[J]. 中国药房, 2011, 22(7): 657-661. |
| [4] |
Xu C, Tang F, Lu M, et al. Astragaloside Ⅳ improves the isoproterenol -induced vascular dysfunction via attenuating eNOS uncoupling-mediated oxidative stress and inhibiting ROS-NF-κB pathways[J]. Int Immunopharmacol, 2016(33): 119-127. |
| [5] |
Mei M, Tang F, Lu M, et al. Astragaloside Ⅳ attenuates apoptosis of hypertrophic cardiomyocyte through inhibiting oxidative stress and calpain-1 activation[J]. Environ Toxicol Pharmacol, 2015, 40(3): 764-773. DOI:10.1016/j.etap.2015.09.007 |
| [6] |
Liu D, He Z, Wu L, et al. Effects of induction/inhibition of endogenous heme oxygenase-1 on lipid metabolism, endothelial function, and atherosclerosis in rabbits on a high fat diet[J]. J Pharmacol Sci, 2012, 118(1): 14-24. DOI:10.1254/jphs.11071FP |
| [7] |
Huang XL, Ling YL, Ling YQ, et al. Heme oxygenase-1 in cholecyst Huang okinin-octapeptipe attenuated injury of pulmonary artery smooth muscle cells induced by lipopolysaccharide and its signal transduction mechanism[J]. World J Gastroenterol, 2004(10): 1789-1794. |
| [8] |
Ndisang JF, Chibbar R, Lane N. Heme oxygenase suppresses markers of heart failure and ameliorates cardiomyopathy in L-NAME-induced hypertension[J]. Eur J Pharmacol, 2014(734): 23-34. |
| [9] |
Cheng Y, Rong J. Therapeutic potential of heme oxygenase-1/carbon monoxide system against ischemia-reperfusion injury[J]. Curr Pharm Des, 2017, 23(26): 3884-3898. |
| [10] |
谢连娣, 刘洋, 周琨, 等. 心肌缺血再灌注损伤的中医病机浅识[J]. 中华中医药杂志, 2015, 30(9): 3139-3141. |
2. Affiliated Hospital of Medical College of Ningbo University, Ningbo 315020, China
 2019, Vol. 36
2019, Vol. 36