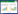文章信息
- 薛南南, 房康, 张玥辉, 陈萌, 王辉, 张欣钰, 吴高荣, 郭文博, 贾晓慧, 王鹏龙, 雷海民
- XUE Nannan, FANG Kang, ZHANG Yuehui, CHEN Meng, WANG Hui, ZHANG Xinyu, WU Gaorong, Guo Wenbo, JIA Xiaohui, WANG Penglong, LEI Haimin
- 核桃粕蛋白提取工艺优化及其酶解产物活性研究
- Optimization of extraction process of walnut meal protein and activity of enzymatic hydrolysate
- 天津中医药, 2019, 36(1): 87-92
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(1): 87-92
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.01.23
-
文章历史
- 收稿日期: 2018-10-18
核桃(Juglans L.),又名羌果[1]、胡桃[2],为胡桃科植物胡桃Juglans regia L.的干燥成熟果实,可供药食两用,《本草纲目》记载,核桃善补气养血、润燥痰、益命门[3],且为中国第二大油料作物[4]。核桃仁中富含油脂及优质蛋白,此外,还含有糖类、维生素、钙、钾、锰、卵磷脂、褪黑素、氨基酸及不饱和脂肪酸等[5]。核桃蛋白主要由谷蛋白、球蛋白、清蛋白和醇溶蛋白组成,含有18种氨基酸,其中8种人体必需氨基酸,其中,谷氨酸、天门冬氨酸和精氨酸含量较高[6-7],是优质的植物蛋白来源。
由于核桃中富含的不饱和脂肪酸具有防治心脑血管疾病、降血脂、神经保护、抗氧化等作用[8],使得市场上对核桃油的需求越来越大,而核桃榨油的副产物——核桃粕的产品附加值低,造成了极大的资源浪费,且核桃粕中蛋白含量达30%以上[9]。文献报道称核桃蛋白及其水解物具有抗癌(乳腺癌、结肠癌)[10-12]、抗氧化[13]、神经保护[14]、抑制血管紧张素转化酶[15]等作用,因此,对核桃粕进行深入的开发利用具有十分重要的意义。
近年来,已有文献报道核桃粕蛋白的提取工艺[16-17],采取的方法主要有超声波辅助法[18]、膜分离法、离子交换法及反胶束法[19]等,其方法各异、操作步骤简繁不一及产品性状差异,且多需借助专属性较强的分离材料等,使得核桃粕蛋白的工业化提取很难实现,仍停留在实验室阶段,造成了无法对核桃粕进行更进一步的精深加工及资源的持续浪费。如何更加简单、高效、低能耗的综合利用核桃粕蛋白,是核桃行业面临的主要现实难题。故本研究旨在探索在简单机械搅拌条件下,结合单因素及响应面实验优化碱溶酸沉法制备核桃粕蛋白过程中NaOH浓度、液料比、提取时间及温度等参数,优化出核桃粕蛋白提取的最佳工艺,并初步探讨了木瓜蛋白酶解核桃蛋白产物的体外抗氧化能力,为核桃粕的开发利用及后续研究提供参考价值,使核桃粕“变废为宝”提高其经济价值。
1 实验仪器与试剂 1.1 仪器离心机(上海垒固仪器有限公司飞鸽牌TDL-5-A);冻干机(德国Christ Beta 2-8 LDplus);紫外分光光度仪(Hitachi UH5300 Spectrophotometer)、电热恒温水浴箱(上海精宏实验设备有限公司DK-600)、电子分析天平(德国赛多利斯公司)、恒温鼓风干燥箱(DHG-9075A型)、高速冷冻离心机(Thermo Scientific Lengend MICRO 21R)。
1.2 试剂氢氧化钠(NaOH)、浓盐酸(HCl)、五水硫酸铜、酒石酸钠钾(分析纯,北京化工厂),牛血清白蛋白(阿拉丁公司),500 000 U/g木瓜蛋白酶(南宁庞博生物工程有限公司),其余试剂均为分析纯。
2 实验方法 2.1 单因素实验分别考察NaOH浓度、液料比、提取时间及温度对核桃蛋白提取率的影响,实验方法:核桃粕粉末加入NaOH溶液,静置浸泡,加热搅拌提取,室温冷却3 000 r/min离心20 min,上清液用1.0 mol/L HCl调至pH 4.5,3 000 r/min离心20 min,沉淀用去离子水反复洗涤3次(至中性),冷冻干燥,即得核桃蛋白粉末(实验设计及方案,见表 1)。
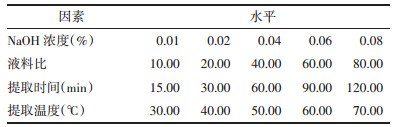
结合单因素实验结果,选取NaOH浓度、液料比及提取温度,运用Design Expert 8.0.5软件,设计3因素3水平的响应面实验(见表 2),以核桃蛋白提取率为响应值,优化核桃粕蛋白提取工艺。
将制得的核桃蛋白配制成4.0%的蛋白溶液,0.5 mol/L NaOH溶液调节pH至8.0,保持55 ℃恒温,加入2.0% 500 000 U/g木瓜蛋白酶,水解6 h后100 ℃加热15 min使酶灭活,1.0 mol/L HCl调pH至4.5,4 ℃下5 000 r/min离心10 min,上清液冷冻干燥即得木瓜蛋白酶核桃蛋白产物。
2.4 活性评价参考文献[20]方法,分别评价木瓜蛋白酶解物的清除DPPH、OH自由基及还原能力(谷胱甘肽为阳性对照)。
2.5 蛋白含量测定采用双缩脲法测定蛋白的含量[21],核桃蛋白提取率(%)=核桃蛋白粉末中蛋白含量/核桃粕质量×100%。
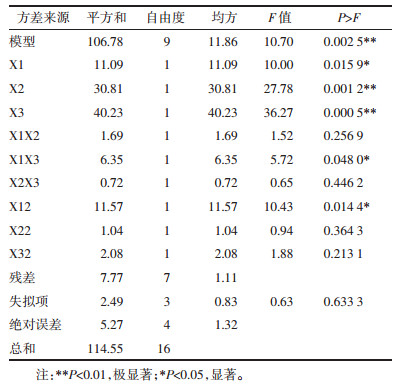
3 结果 3.1 单因素对核桃蛋白提取率的影响 3.1.1 NaOH浓度对蛋白提取率的影响由图 1可知,NaOH浓度为0.04%时蛋白提取率最高,达到24.94%,浓度为0.06%和0.08%时次之,0.01%最低。但提取时NaOH浓度越高,蛋白提取液颜色加深影响产品性状,故选取0.02%、0.04%、0.06%作为响应面实验中NaOH浓度的3个水平。
|
| 图 1 NaOH浓度对蛋白提取率的影响 Fig. 1 Effects of NaOH concentration on protein extraction rates |
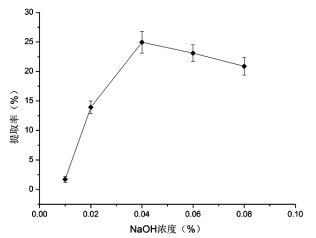
由图 2可知,液料比在80:1时,蛋白提取率最高为30.24%,与60:1时几乎相等,而40:1、20:1次之,10:1最低。故选取40:1、60:1、80:1作为响应面实验中液料比的3个水平。
|
| 图 2 液料比对蛋白提取率的影响 Fig. 2 Effects of liquid-to-material ratio on protein extraction rates |
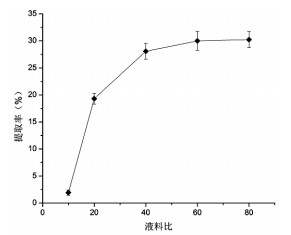
由图 3可知,提取时间对蛋白提取率的影响随时间的升高而增大,60 min时,蛋白提取率较高,但是在80 min和120 min时,并无较大提升,曲线较坡。所以从节省时间及缩短提取提取周期的角度上,选择60 min作为响应面实验中核桃蛋白的提取时间。
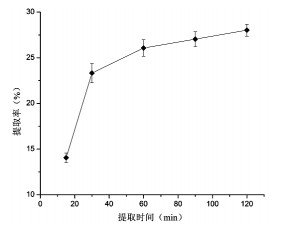
|
| 图 3 提取时间对蛋白提取率的影响 Fig. 3 Effects of extraction time on protein extraction rates |
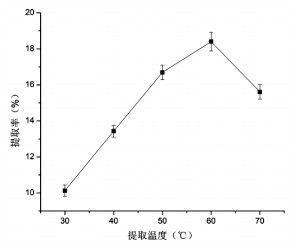
由图 4可知,温度为60 ℃时蛋白提取率最高为18.40%,50 ℃、70 ℃次之,因为核桃蛋白的变性温度为67.01 ℃[9],故选取45 ℃、55 ℃、65 ℃作为响应面实验中温度的3个水平。
|
| 图 4 提取温度对蛋白提取率的影响 Fig. 4 Effects of extraction temperature on protein extraction rates |
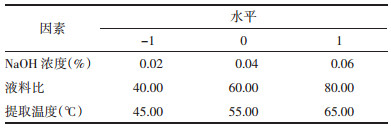
根据Box-Behnken中心组合实验设计原理,在单因素结果的基础上,选取NaOH浓度(X1)、液料比(X2)及提取温度(X3)3因素,以核桃蛋白提取率(Y)为响应值,进行3因素3水平的响应面实验。设计及结果见表 3。
采用Design Expert 8.0.5软件对响应值与各因素进行回归拟合,得二次多项式回归方程:Y=32.61+1.18X1+1.96X2+2.24X3-0.65X1X2-1.26X1X3-0.42X2X3-1.66X12-0.50X22-0.70X32(R2=0.932 2 Adj R2=0.845 1)。回归分析结果见表 4。
由表 3可知,该模型的P<0.01,表明回归模型极显著,并且失拟项P=0.633 3>0.05,表明该响应面实验的结果和数学模型拟合良好,实验的误差小。因此,可以使用该数学模型对响应面法提取核桃蛋白的实验结果进行分析。F检验发现,X1、X2、X3、X1X3、X12与响应值(Y)显著相关。各因素对蛋白提取率的影响由大到小依次是X3>X2>X1,其中X3和X2的影响极显著(P<0.01),X1显著(P<0.05);二次项中X1对核桃蛋白提取率的影响显著(P<0.05);交互项中,只有X1X3对蛋白提取率的影响有显著作用(P<0.05),而X1X2、X2X3之间的交互作用不显著。
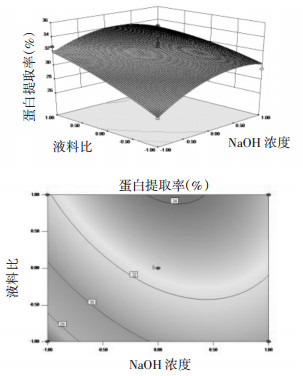
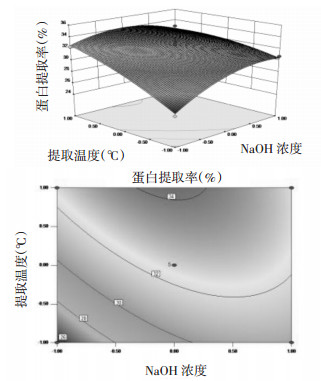
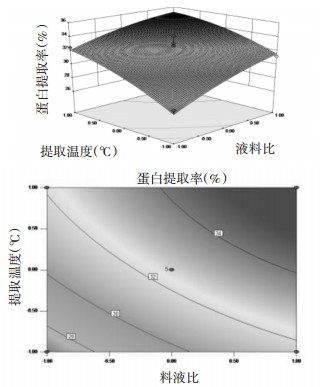
3.2.3 响应面交互作用分析为了更加直观地反映三因素间的相互作用,采用Design-Expert 8.0.5软件绘制响应面及等高线图,并进行分析(分别见图 5、6和7)。由图 5可见,响应面较坡,说明NaOH浓度和液料比之间的交互作用不明显,NaOH浓度一定时,随着料液比的增大,蛋白提取率基本呈升高趋势;当液料比一定时,随着NaOH浓度的增大,蛋白提取率也呈现相同的趋势。由图 6可见,响应面坡度较陡,等高线成椭圆形,说明NaOH浓度和提取温度之间的交互作用显著,NaOH浓度一定时,随着提取温度的升高,蛋白提取率呈升高趋势,可能是在不超过核桃蛋白的变性温度下,蛋白提取率随着温度的升高,蛋白溶解的越多,而NaOH浓度一定时,随着液料比的增大,蛋白提取率先增加后降低。由图 7可知,响应面较坡,说明提取温度和液料比之间交互作用不明显,提取温度一定时,随着液料比的增大,蛋白提取率呈升高趋势,而当液料比一定时,随着提取温度的升高,蛋白提取率也呈相同趋势。
|
| 图 5 NaOH浓度和液料比对蛋白提取率影响的响应面及等高线图 Fig. 5 Three-dimensional response and contour plots showing the interactive effects of NaOH concentration and liquid-to-material ratio on protein extraction rates |
|
| 图 6 NaOH浓度和提取温度对蛋白提取率影响的响应面及等高线图 Fig. 6 Three-dimensional response and contour plots showing the interactive effects of NaOH concentration and extraction temperature on protein extraction rates |
|
| 图 7 提取温度和液料比对蛋白提取率影响的响应面及等高线图 Fig. 7 Three-dimensional response and contour plots showing the interactive effects of extraction temperature and liquid-to-material ratio on protein extraction rates |
综上所述,NaOH浓度与提取温度之间的交互作用对蛋白提取率影响显著,运用Design-Expert 8.0.5软件对响应面结果进行优化,优化的最佳提取工艺条件为:0.04%NaOH溶液、80:1液料比、温度为65 ℃、提取1 h,预测蛋白提取率为35.27%。
3.2.4 响应面结果的验证为验证模型预测结果的准确性,采用响应面优化的最佳工艺条件进行核桃粕蛋白提取,3次平行实验,所得蛋白提取率的平均值为36.01%,与预测值35.27%较为接近。
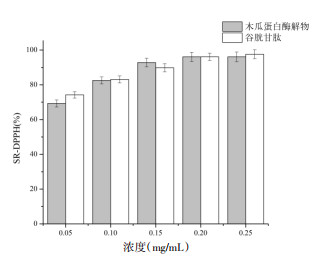
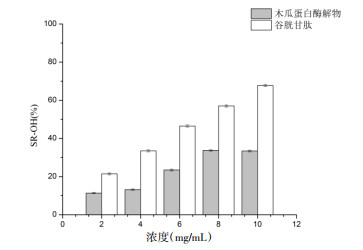
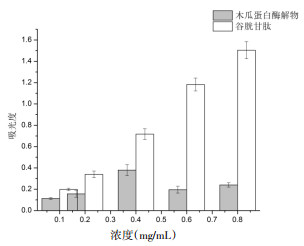
3.3 抗氧化活性结果由图 8可知,在浓度分别为0.05、0.10、0.15、0.20及0.25 mg/mL下,木瓜蛋白酶解物对DPPH自由基的清除率几乎与谷胱甘肽相等,且清除能力随着浓度的升高而增强,在0.25 mg/mL浓度下清除率达为96.09%,而谷胱甘肽为97.60%,说明木瓜蛋白酶核桃蛋白酶解物具有较好的清除DPPH自由基的能力。由图 9可知,核桃蛋白酶解物对OH自由基的清除作用弱于谷胱甘肽,且基本为谷胱甘肽的50%,最大浓度10.0 mg/mL时,木瓜蛋白酶的OH自由基清除率为33.39%,为谷胱甘肽(67.71%)的50%。说明核桃蛋白酶解物的OH自由基清除能力较弱。由图 10可知,阳性对照谷胱甘肽具有较强的还原力,且呈剂量依赖性关系,而核桃蛋白酶解物的还原能力远不及谷胱甘肽,且无明显的量效关系。
|
| 图 8 核桃蛋白酶解物DPPH自由基清除率 Fig. 8 DPPH free radical scavenging rate of walnut protein hydrolysate |
|
| 图 9 核桃蛋白酶解物OH自由基清除率 Fig. 9 OH free radical scavenging rate of walnut protein hydrolysate |
|
| 图 10 核桃蛋白酶解物还原能力 Fig. 10 Reducing ability of walnut protein hydrolysate |
综上所述,核桃蛋白酶解物具有体外抗氧化活性,具备较强的开发利用价值,可为后续核桃粕的产品研发及研究等提供参考意义。
4 讨论目前,对核桃粕的开发及利用研究还不够深入,大部分核桃粕仍被丢弃,附加值较低,如何利用废弃的、资源利用度低的核桃粕开发出具有保健作用的食品及保健品等成为一项很重要的课题。本实验通过单因素及响应面实验设计优化得到的核桃粕蛋白提取工艺,具有快速、成本低、操作简便及产品纯度高等优点,且通过绿色、无污染的酶解法制备的核桃蛋白酶解物具有较强的抗氧化活性,这些可为实现工业化生产、为后续的核桃粕保健食品、药品研发及提高核桃资源的利用度等提供重要的参考依据,进而实现对核桃粕的精深加工及产品开发,打破中国核桃蛋白行业一直以来的瓶颈状态。
| [1] |
吴夏花.营养型核桃多肽粉的研制[D].太原: 山西大学, 2012.
|
| [2] |
王端.葛根核桃肽复合饮料的研制[D].贵阳: 贵州大学, 2016.
|
| [3] |
李时珍著, 王育杰. 本草纲目[M]. 中册. 北京人民卫生出版社, 1999.
|
| [4] |
金青哲, 王丽蓉, 王兴国, 等. 木本油料油脂和饼粕产品开发[J]. 中国油脂, 2015, 40(2): 1-7. |
| [5] |
王利华. 核桃的营养保健功能及加工利用[J]. 中国食物与营养, 2007, 13(8): 28-30. DOI:10.3969/j.issn.1006-9577.2007.08.009 |
| [6] |
侯雅坤.核桃活性肽体外抗氧化活性及ACE抑制活性的研究[D].北京: 北京林业大学, 2012.
|
| [7] |
崔莉, 葛文光. 核桃蛋白质功能性质的研究[J]. 食品科学, 2000, 21(1): 13-16. DOI:10.3321/j.issn:1002-6630.2000.01.004 |
| [8] |
姜荣庆.复合酶提取山核桃油及副产物综合利用的研究[D].长春: 吉林农业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10193-1011150411.htm
|
| [9] |
陈卉平.核桃粕蛋白抗氧化肽的分离纯化、结构鉴定及其改善记忆的研究[D].广州: 华南理工大学, 2015.
|
| [10] |
Ma S, Huang D, Zhai M, et al. Isolation of a novel bio-peptide from walnut residual protein inducing apoptosis and autophagy on cancer cells[J]. BMC Complementary & Alternative Medicine, 2015, 15(1): 413. |
| [11] |
Gu M, Chen HP, Zhao MM, et al. Identification of antioxidant peptides released from defatted walnut (Juglans Sigillata Dode) meal proteins with pancreatin[J]. LWT-Food Science and Technology, 2015(1): 213-220. |
| [12] |
Jahanbani R, Ghaffari SM, Salami M, et al. Antioxidant and Anticancer Activities of Walnut (Juglans regia, L.) Protein Hydrolysates Using Different Protease[J]. Plant Foods for Human Nutrition, 2016, 71(4): 1-8. |
| [13] |
Vinson JA, Cai Y. Nuts, especially walnuts, have both antioxidant quantity and efficacy and exhibit significant potential health benefits[J]. Food & Function, 2012, 3(2): 134. |
| [14] |
Zou J, Cai PS, Xiong CM, et al. Neuroprotective effect of peptides extracted from walnut(Juglans Sigilata Dode) proteins on Aβ25-35-induced memory impairment in mice[J]. Journal of Huazhong University of Science and Technology[Medical Sciences], 2016, 36(1): 21-30. DOI:10.1007/s11596-016-1536-4 |
| [15] |
Jahanbani R, Ghaffari M, Vahdati K, et al. Kinetics Study of Protein Hydrolysis and Inhibition of Angiotensin Converting Enzyme by Peptides Hydrolysate Extracted from Walnut[J]. International Journal of Peptide Research & Therapeutics, 2018, 24(1): 77-85. |
| [16] |
赵见军, 马玉娟. 响应面法优化核桃粕油脂提取工艺[J]. 江苏农业科学, 2014, 42(7): 274-276. DOI:10.3969/j.issn.1002-1302.2014.07.095 |
| [17] |
安传相, 毕远林, 裴璞花, 等. 响应面法对核桃粕中蛋白质提取工艺的优化[J]. 食品研究与开发, 2017, 38(22): 38-43. DOI:10.3969/j.issn.1005-6521.2017.22.008 |
| [18] |
李婷, 严娅, 姜雪, 等. 超声波辅助提取核桃粕蛋白工艺研究[J]. 食品工业, 2015, 36(10): 155-159. |
| [19] |
陈玉婷.反胶束制备核桃蛋白的工艺及结构与功能性研究[D].济南: 济南大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10389-1012425505.htm
|
| [20] |
康玮丽.核桃抗氧化肽的制备及应用研究[D].乌鲁木齐: 新疆大学, 2011.
|
| [21] |
俞建瑛, 蒋宇, 王善利. 生物化学实验技术[M]. 北京: 化学工业出版社, 2005: 162-178.
|
 2019, Vol. 36
2019, Vol. 36