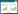文章信息
- 路岩莉, 房艳艳, 李新民, 孙丹, 马莉婷, 韩耀巍
- LU Yanli, FANG Yanyan, LI Xinmin, SUN Dan, MA Liting, HAN Yaowei
- 熄风胶囊对匹罗卡品致痫大鼠电压门控性钠通道功能的影响
- Research of the effect of Xifeng Capsule on the function of voltage-gated sodium channel in epileptic rats induced by pilocarpine
- 天津中医药, 2019, 36(10): 1001-1005
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(10): 1001-1005
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.10.17
-
文章历史
- 收稿日期: 2019-02-23
2. 山东省临沂市中医医院, 临沂 276002
电压门控性钠通道(VGSC)是细胞动作电位产生的结构基础,其结构和功能异常参与癫痫的发病机制,因此调节VGSC功能成为许多抗癫痫药物的作用机制,如卡马西平(CBZ)、奥卡西平(OXC)等[1]。本实验将从氯化锂—匹罗卡品致痫大鼠海马VGSC的功能入手,通过全细胞膜片钳观察中药复方制剂熄风胶囊对其影响。
1 材料 1.1 动物13日龄无特定病原体级健康雄性Sprague Dawley(SD)大鼠60只,体质量(45±10)g,由中国人民解放军军事医学科学院实验动物中心提供[许可证号SCXK-(军)2013-004],适应性喂养3 d后开始实验。
1.2 主要药品及仪器氯化锂(批号115K1308,100 g/瓶,美国Sigma公司)、盐酸匹罗卡品(批号066k1730,5g/瓶,美国Sigma公司)、熄风胶囊(批号为津Z0252号,0.33g/粒,天津中医药大学第一附属医院杏林药厂。药物组成:紫河车、石菖蒲、天麻、川芎、全蝎、白僵蚕、蜈蚣、白矾、郁金等)、EPC-10型膜片钳放大器(德国HEKA公司)、MP285R型微电极推进器(美国Sutter公司)、P-97型微电极拉制仪(美国Sutter公司)等。
2 实验动物的分组及处理 2.1 造模将60只大鼠随机分成两大组,空白组10只,其余50只用于建模。腹腔注射127 mg/kg氯化锂,18 h后腹腔注射1 mg/kg硫酸阿托品,30 min后分两次腹腔注射30 mg/kg匹罗卡品,大鼠出现癫痫持续状态1 h后,再给予腹腔注射10 mg/kg地西泮以止抽,必要时可重复注射1~2次,直到痫性发作被完全控制[2]。
2.2 分组47只造模成功大鼠随机选出40只分为4组,每组10只,分别为模型组、熄风胶囊高剂量治疗组(熄高组)、熄风胶囊中剂量治疗组(熄中组)和熄风胶囊低剂量治疗组(熄低组)。
2.3 处理熄高组、熄中组和熄低组大鼠,分别每天上午灌胃熄风胶囊0.33、0.66和0.99 g浓缩剂2 mL 1次;模型组和空白组大鼠,分别每天上午灌胃生理盐水2 mL 1次。共持续60 d。
3 实验方法大鼠断头取脑,在孵育液中分离出海马并切成400 μm厚的脑片,加入蛋白酶在30 ℃下消化30 min后用孵育液洗脑片3次,放入盛有氧饱和标准细胞外液的离心管内,用Pasteur吸管轻轻吹打,静止约2 min,取上部的细胞悬液加入含标准细胞外液的灌注槽内,约15 min后细胞贴壁于涂布多赖氨酸的圆形盖玻片上,即进行全细胞膜片钳记录。
本实验记录电极选用软质玻璃毛坯,经P-97拉制仪拉制后抛光,尖端直径为1~2 μm,充灌电极内液后电极阻抗约为2~8 MΩ。记录在室温(2~24 ℃)下进行,采用EPC-10膜片钳放大器记录膜电流,通过Pulse软件进行实验参数的设置、数据的采集和刺激的施加,采样频率为10 kHz,滤波频率为2.9 kHz。采样后将数据存贮在硬盘,以供测量和分析。
4 统计分析使用Graphpad Prism 6.0软件包进行统计分析和作图。计量资料均值采用均数±标准差(x±s)进行描述,多组比较采用单因素方差分析,组间两两比较用SNK检验;P < 0.05为差异有统计学意义。
5 实验结果 5.1 熄风胶囊对IE大鼠SRS的影响本实验采用氯化锂-匹罗卡品癫痫动物模型,造模成功率为94%。在造模及随后60 d灌胃过程中,致痫大鼠均出现了癫痫慢性期的行为学改变,即癫痫持续状态后15 d到60 d内出现反复自发性发作(SRS)。如表 1所示,空白组未见SRS发作,其余各实验组均有SRS发作。与模型组比较,熄高组、熄中组和熄低组SRS发作次数均低于模型组,差异有显著性(F=19.538 1,P=0.00)。在熄风胶囊治疗组中,随剂量增加SRS发作次数逐渐减少,其中熄高组和熄低组相比有统计学差异(P < 0.05),而熄高组和熄中组、熄中组和熄低组之间均无统计学意义(P>0.05)。
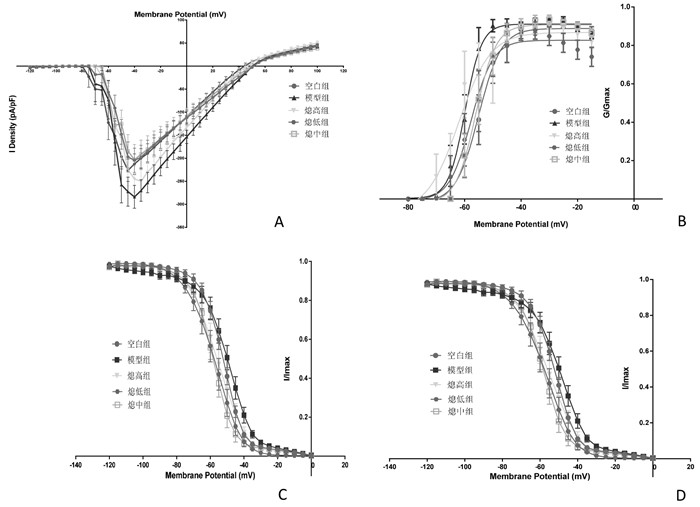
细胞膜电位钳制在-90 mV,从-80 mV到+100 mV,以5 mV的幅度递增给予细胞去极化刺激,可激发一系列钠电流。经细胞膜电容标化后,两组均约-60 mV时出现内向电流,即钠通道开始激活。内向电流达到峰值时提示钠通道开放到最大程度,流入细胞内的钠离子浓度最高。以不同膜电位为横轴,该膜电位下的钠电流峰值为纵轴,绘制钠通道的电流-电压曲线(见图 1A)。纵坐标钠电流的波幅峰值均经过标化,分别与相应的测试脉冲电压对应,对所得数据进行统计分析(见表 2)。
|
| A为电流-电压曲线;B为激活曲线;C为失活曲线;D为失活后恢复曲线 图 1 钠通道功能的电生理学检测 Fig. 1 Electrophysiological examination of sodium channel function |
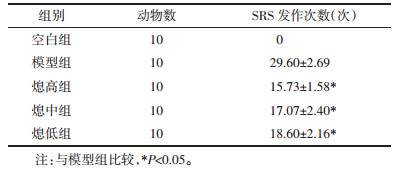
从电流-电压曲线可见,各治疗组的曲线较模型组显著上移,但钠电流的激活阈电位没有明显变化(均在约-60 mV);从钠电流平均峰值图可以直观的看出,各治疗组均有减小钠电流的作用。从表 2中可以看出各组钠通道电流-电压曲线峰值电流相比较有统计学差异(F=23.89,P=0.00),其中与空白组相比较,模型组和熄低组差异有显著性(P < 0.01),而与熄高组和熄中组比较无统计学差异(P>0.05);与模型组相比,治疗组电流均下降,其中熄高组和熄中组差异有显著性(P < 0.01),熄低组有统计学差异(P < 0.05);各中药治疗组之间,熄高组和熄中组相比有随剂量增加而电流下降趋势,但无统计学意义(P>0.05),而熄高组、熄中组分别与熄低组相比差异有显著性(P < 0.01)。
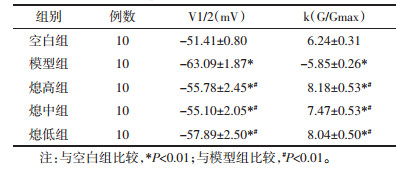
5.2.2 激活曲线在电压钳制模式下,把初始电压钳制在-90 mV,预置-120 mV超极化电压200 ms,随后给予-80 mV至+100 mV的跃阶指令电压刺激,步幅为5 mV,每个电压指令的作用时程为50 ms。记录到的这一系列指令电压激活的内向电流,以电导值与最大电导值的比值(G/Gmax)及对应膜电位绘制出两组钠通道的激活曲线(见图 1B)。纵坐标钠电流的波幅峰值均经过标化,分别与相应的测试脉冲电压对应,对所得数据进行统计分析(见表 3)。
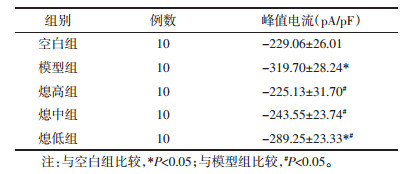
对表 3所得数据进行分析示各组V1/2值(F=5.04,P=0.001 9)和K值(F=4.27,P=0.0052)比较差异有显著性。其中与空白组相比较,模型组差异有显著性(P < 0.01),而与熄高组、熄中组和熄低组比较无统计学差异(P < 0.05);与模型组相比,治疗后激活阈值上升,熄高组和低中组有显著性差异(P < 0.01),熄中组差异有统计学(P < 0.05);各中药治疗组之间,随剂量升高电流有下降趋势,提示治疗后激活阈值有上升趋势,但各治疗组间无统计学意义(P>0.05)。
5.2.3 失活曲线在电压钳制的模式下,把初始电压钳制在-90 mV,先给予从-120到40 mV跃阶指令电压刺激,步幅为5 mV,刺激波宽1 000 ms;随后再施以-90到0 mV,步幅为5 mV,时程为50 ms的测试脉冲刺激。记录两组测试脉冲下钠通道电流,以电流峰值与最大电流峰值的比值(I/Imax),与所对应的条件刺激脉冲电压绘制出钠通道的稳态失活曲线(见图 1C)。纵坐标钠电流的波幅峰值均经过标化,分别与相应的测试脉冲电压对应,对所得数据进行统计分析(见表 4)。
对表 4所得数据进行分析示各组V1/2值(F=17.28,P=0.00)和K值(F=57.32,P=0.00)相比较有统计学差异。其中与空白组相比较,各组均有统计学差异(P < 0.01);与模型组相比,治疗后失活阈值下降,各中药治疗组有统计学差异(P < 0.01);各中药治疗组之间,总体上随剂量升高失活阈值有下降趋势,提示治疗有效,但各治疗组间无统计学意义(P>0.05)。
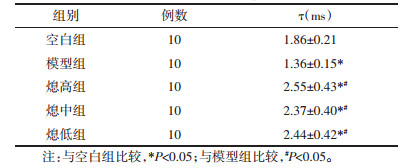
5.2.4 失活后恢复曲线细胞静息状态下膜电位钳制于-90 mV,运用双脉冲刺激方法记录这一系列失活后再次激活的内向电流,即电压依赖性钠通道的失活后恢复电流,以钠电流条件刺激电压和测试电压均间间隔t作图绘制失活后的恢复曲线(见图 1D),并用指数方程I/Imax=1-exp(-t/τ)拟合曲线,得出的大鼠锥体神经元钠通道电流失活后恢复的时间常数(τ)(见表 5)。
|
对表 5所得数据进行分析示各组钠通道恢复时间常数相比较有统计学差异(F=19.67,P=0.00)。其中与空白组相比较,各组均有统计学差异(P<0.01);与模型组相比,治疗后恢复时间明显延长,各中药治疗组有统计学差异(P < 0.01);各中药治疗组之间,总体上随剂量升高恢复时间有延长趋势,提示治疗有效,但各治疗组间无统计学意义(P>0.05)。
6 讨论电压门控性钠通道(VGSC)存在三种功能状态:开放/被激活,静息/关闭和失活/被灭活。VGSC开放引起去极化内向电流是动作电位产生和传递的基础[3-4],是苯妥英钠、CBZ、OXC、拉莫三嗪等多种抗癫痫药物(AEDs)在海马神经元的作用靶点。VGSC的密度、分布、分子结构和功能的改变,导致AEDs敏感性下降,影响了钠通道的激活、失活、失活后恢复或电流的幅度,最终引起了神经元的兴奋性改变,从而造成了多种AEDs的对癫痫发作不敏感[5]。
本院马融教授根据“久病必虚”“久病入肾”理论,指出肾精亏虚为致痫之本,治宜“益肾填精、豁痰熄风”,基于此而研制了熄风胶囊,方中紫河车益肾填精,补脑益智;天麻平肝潜阳、熄风止痉,辛润不燥,配以石菖蒲辛香避秽、豁痰开窍;全蝎、僵蚕以搜风剔痰逐瘀;川芎行气活血;白金丸行气除痰。诸药合用,标本兼顾,扶正祛邪以治痫病顽疾,且前期临床研究证实熄风胶囊是一种治疗小儿癫痫有效的中药复方制剂[6-7]。基础研究方面,通过对氯化锂-匹罗卡品动物模型的研究,发现熄风胶囊能够减轻海马损伤[8]。本实验进一步证实采用熄风胶囊干预治疗氯化锂-匹罗卡品癫痫动物模型可以减少SRS发作,且随剂量增加SRS发作次数逐渐减少,其中熄风胶囊高剂量和低剂量治疗相比有统计学意义。
本实验通过全细胞膜片钳技术检测大鼠海马神经元细胞VGSC功能变化,从电流-电压曲线可见,各治疗组的曲线较模型组显著上移,但钠电流的激活阈电位没有明显变化,各治疗组均有减小钠电流的作用。与空白组相比较,模型组和熄低组有显著性差异,而与熄高组和熄中组比较无统计学差异;与模型组相比,治疗组电流均下降,其中熄高组和熄中组有显著性差异,熄低组有统计学差异,均提示熄风胶囊治疗有效,能降低异常增高的钠电流,尤其是熄高组和熄中组钠电流与空白组相近,即接近于正常;各中药治疗组之间,有随剂量增加而电流下降趋势,熄高组和熄中组相比无统计学意义,而两者分别与熄低组相比有显著性差异,提示在对钠电流影响方面,熄高组和熄中组疗效相似,提示在临床治疗上其疗效与剂量呈非线性关系。
从激活曲线和失活曲线可以看出与模型组相比,各中药治疗组激活阈值上升、失活阈值下降,因此整个锥体细胞不易启动动作电位,导致其海马神经元的兴奋性下降,进而达到控制反复癫痫发作的目的,这与CBZ和拉莫三嗪[9]等可通过快速失活和慢速失活以终止动作电位达到控制癫痫发作相一致。各中药治疗组总体上随剂量升高激活阈值有下降趋势、失活阈值有上升趋势,但无统计学意义。
从失活后恢复曲线可以看出与模型组相比,熄风胶囊治疗后恢复时间明显延长,即延长不应期,使其不易再次被激活,从而抑制放电扩散和促使发作放电终止[10]。各熄风胶囊治疗组之间,总体上随剂量升高恢复时间有延长趋势,但组间无统计学意义。
本实验进一步证实熄风胶囊通过减少VGSC电流,增强VGSC失活,抑制失活后的恢复,延长恢复时间来达到降低VGSC异常活化的作用,从而降低癫痫反复自发性发作,这可能是其作用机制之一。但是从激活曲线、失活曲线和失活后恢复曲线来看,熄风胶囊各治疗组间治疗差异无统计学差异,从另一方面证实了中药多途径、多靶点的特点,其他作用机制有待进一步研究。
| [1] |
Bouza AA, Isom LL. Voltage-gated sodium channel β subunits and their related diseases[J]. Handb Exp Pharmacol, 2018, 246: 423-450. |
| [2] |
宋延民, 杨国帅, 龙莉莉, 等. 不同首剂匹罗卡品制作颞叶癫痫大鼠模型的研究[J]. 现代生物医学进展, 2012, 12(17): 3217-3220. |
| [3] |
Catterall WA. Structure and function of voltage-gated sodium channels at atomic resolution[J]. Exp Physiol, 2014(99): 35-51. |
| [4] |
Catterall WA. Sodium channels, inherited epilepsy, and antiepileptic drugs[J]. Annu Rev Pharmacol Toxicol, 2014(54): 317-338. |
| [5] |
K?hling R. Voltage-gated sodium channels in epilepsy[J]. Epilepsia, 2002, 43(11): 1278-95. DOI:10.1046/j.1528-1157.2002.40501.x |
| [6] |
马融, 张喜莲. 熄风胶囊治疗小儿癫痫强直-阵挛性发作200例临床观察[J]. 中医杂志, 2004, 45(5): 363-364. DOI:10.3321/j.issn:1001-1668.2004.05.027 |
| [7] |
路岩莉, 晋黎, 孙丹. 熄风胶囊治疗小儿良性癫痫19例观察[J]. 中医杂志, 2013, 54(2): 363-364. |
| [8] |
路岩莉, 李珍, 马莉婷. 熄风胶囊干预治疗对氯化锂-匹罗卡品癫痫大鼠海马突触损伤的影响[J]. 天津中医药, 2014, 31(7): 430-435. |
| [9] |
Smith NJ, Solovay CF. Epithelial Na+ channel inhibitors for the treatment of cystic fibrosis[J]. Pharm Pat Anal, 2017, 6(4): 179-188. |
| [10] |
Richards KL, Milligan CJ, Richardson RJ, et al. Selective NaV1.1 activation rescues Dravet syndrome mice from seizures and premature death[J]. Proc Natl Acad Sci, 2018, 115(34): 8077-8085. DOI:10.1073/pnas.1804764115 |
2. Chinese Medicine Hospital of Linyi Shandong Province, Linyi 276002, China
 2019, Vol. 36
2019, Vol. 36