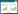文章信息
- 张恺, 李娜娜, 李嵩, 孟庆芬, 关建丽, 邓昊, 樊官伟
- ZHANG Kai, LI Nana, LI Song, MENG Qingfen, GUAN Jianli, DENG Hao, FAN Guanwei
- 元胡止痛口服液对原发性痛经的镇痛作用及机制研究
- Analgesic effect and pharmacological mechanisms of Yuanhu Zhitong Oral Liquid on primary dysmenorrhea
- 天津中医药, 2019, 36(10): 1006-1011
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(10): 1006-1011
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.10.18
-
文章历史
- 收稿日期: 2019-06-26
2. 天津市中医方证转化研究重点实验室, 天津 301617;
3. 天津市中医药研究院附属医院, 天津 300120;
4. 天津中医药大学研究生院, 天津 301617;
5. 河南福森药业有限公司, 淅川 474450;
6. 天津中医药大学中医药研究院, 天津 301617
原发性痛经系指非盆腔器质性病变引起的痛经,以患者下腹部痉挛性疼痛为主要临床表现。本病多发于青年女性,国内报道其发病率约为43% ~ 69%[1]。国外流行病学调查显示,原发性痛经的发病率由34%(埃及)至94%(阿曼)不等,其中重度痛经的患病率约为0.9%~59.8%[2]。随着生活压力增加、饮食结构改变等因素的影响,原发性痛经的发病率呈逐年上升趋势,对女性的生活与工作造成了严重影响。
中医认为原发性痛经属“经行腹痛”范畴,元胡止痛方是中医临床治疗由气滞血瘀引起的痛经的常用经方,其由延胡索和白芷两味中药组成,具有理气、活血、止痛之功效[3]。目前,元胡止痛方有口服液、片剂、软胶囊剂、胶囊剂、颗粒剂与滴丸共6种剂型收录于2015年版《中华人民共和国药典》中。关于元胡止痛片剂、胶囊剂、滴丸对于原发性痛经的治疗作用已有一些研究报道,如张秀书[4]采用元胡止痛片治疗原发性痛经,可使患者痛经症状积分显著降低;方远书等[5]报道元胡止痛胶囊的含药血清能显著减少痛经动物模型的扭体次数;韩彦琪等[6]基于网络药理学研究发现元胡止痛滴丸可能通过作用于激素调节、中枢镇痛、解痉、炎症及免疫相关的蛋白靶点与通路,从而发挥治疗原发性痛经的作用。但目前尚缺乏元胡止痛口服液治疗原发性痛经的相关实验研究。课题组前期研究发现元胡止痛口服液可显著抑制缩宫素诱导的小鼠离体子宫痉挛性收缩,本研究进一步采用缩宫素诱导原发性痛经大鼠模型,以大鼠扭体反应次数与发生率为指标,考察元胡止痛口服液对痛经大鼠模型的影响。并测定给药后大鼠血浆雌二醇(E2)、孕酮(Prog)、丙二醛(MDA)、超氧化物歧化酶(SOD)与谷胱甘肽过氧化物酶(GSH-Px)水平,以及大鼠子宫组织前列腺素F2α(PGE2α)、前列腺素E2(PGE2)、血栓素B2(TXB2)、6-酮-前列腺素F1α(6-keto-PGF1α)、钙离子(Ca2+)与一氧化氮(NO)含量,探讨元胡止痛口服液的作用机制,为其临床合理应用提供科学依据。
1 材料与方法 1.1 实验仪器NewClassic MF电子分析天平(瑞士Mettler Toledo公司);Xianou-24高通量多样品组织研磨机(南京先欧仪器制造有限公司);Varioskan Lux多功能微孔板读数仪(美国Thermo Fisher Scientific公司);Wellwash全自动洗板机(美国Thermo Fisher Scientific公司);BGZ-240电热鼓风干燥箱(上海博迅实业有限公司医疗设备厂);ProFlex Base PCR系统(美国Applied Biosystems公司);Milli-Q Integral 5超纯水系统(美国Merck Millipore公司);Legend Micro 21R冷冻高速离心机(美国Thermo Fisher Scientific公司)。
1.2 实验药品与试剂元胡止痛口服液的处方由醋延胡索、白芷两味中药组成,辅料为蔗糖、β环糊精、甜菊素、纯化水,由河南福森药业有限公司提供,批号:18090121,实验时用蒸馏水稀释成所需浓度的溶液。罗通定片的有效成分为延胡索乙素(每片30 mg),购自山西云鹏制药有限公司,批号:G180302,实验时取出片剂研磨成细粉,加入蒸馏水与0.5%(W/V)羧甲基纤维素钠,配制成所需浓度的混悬液。己烯雌酚(上海源叶生物科技有限公司,批号:X13M6Y1);缩宫素(大连美仑生物技术有限公司,批号:N1108A);羧甲基纤维素钠(上海申光食用化学品有限公司,批号:20180816);肝素钠(北京索莱宝科技有限公司,批号:409G024);水合氯醛(上海源叶生物科技有限公司,批号:Z23A9Y68668)。E2酶联反应吸附实验(ELISA)检测试剂盒(批号:L181010239)与PGF2a ELISA检测试剂盒(批号:L181023119)购自武汉云克隆科技股份有限公司。大鼠Prog ELISA检测试剂盒(批号:20181112005)购自武汉六合生物技术有限公司。大鼠PGE2 ELISA检测试剂盒(批号:C0174080121)、大鼠TXB2 ELISA检测试剂盒(批号:A27017483)与大鼠6-keto-PGF1α ELISA检测试剂盒(批号:D10017485)购自武汉华美生物工程有限公司。MDA检测试剂盒(批号:082418181030)、总SOD活性检测试剂盒(批号:092618181030)、GSH-Px检测试剂盒(批号:060518181114)、NO检测试剂盒(批号:052218181029)与BCA蛋白浓度测定试剂盒(批号:070618181017)购自上海碧云天生物技术研究所。Ca2+试剂盒(批号:20181123)购自南京建成生物工程研究所。
1.3 实验动物SD大鼠,雌性,体质量180~200 g,SPF级,购自北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2017-0001。饲养于中国医学科学院放射医学研究所实验动物中心,饲养设施合格证号:SVXK津2009-0002。实验动物操作均遵从中国医学科学院放射医学研究所实验动物伦理委员会审定的规范要求。
1.4 分组与造模方法将60只健康雌性SD大鼠按体质量随机分为6组,分别为空白组、模型组、元胡止痛口服液高剂量组(高剂量组)、元胡止痛口服液中剂量组(中剂量组)、元胡止痛口服液低剂量组(低剂量组)以及罗通定片阳性药组(阳性药组),每组10只。参考文献方法[7]复制痛经大鼠模型。除空白组外,其余各组大鼠灌胃给予己烯雌酚2.00 mg/kg,每日1次,连续12 d。
1.5 给药方法于造模第6天开始给药,根据预实验结果,高剂量组、中剂量组、低剂量组大鼠分别以3.20、1.07、0.36 g/kg剂量灌胃给予元胡止痛口服液。根据实验动物与人之间药物剂量等效换算方法,阳性药组大鼠灌胃给予罗通定混悬液0.03 g/kg。空白对照组与模型组灌胃等体积蒸馏水,各组大鼠每日给药1次,连续给药7 d。
1.6 扭体反应观察于造模第12天,末次给药1 h后,模型组、高剂量组、中剂量组、低剂量组与阳性药组大鼠腹腔注射缩宫素40 U/kg,空白组注射等体积生理盐水。记录注射缩宫素后30 min内各组大鼠发生扭体反应(腹部收缩内凹,躯干与后肢伸展,臀部与一侧肢体内旋)的数量以及扭体次数,并按公式1计算大鼠的扭体发生率。
扭体发生率(%)=发生扭体反应动物数量/实验动物数量×100%(公式1)
1.7 检测指标注射缩宫素1 h后,各组大鼠腹腔注射3.50%(V/V)水合氯醛溶液(0.10 mL/kg)麻醉,腹主动脉采血,加入肝素抗凝管,于1 500 g,4 ℃条件下离心5 min,取上清液,采用ELISA法测定大鼠血浆E2与Prog水平,采用TBA法检测大鼠血浆MDA含量,运用WST-8法测定血浆SOD活性,并采用紫外比色检测GSH-Px活性。
另于采血后取大鼠子宫组织,精密称质量,加入生理盐水,在冰浴下制成10%(W/V)的组织匀浆,于1 500 g、4 ℃条件下离心10 min,分离上清液,采用ELISA法测定大鼠子宫组织匀浆中PGF2α、PGE2、TXB2、6-keto-PGF1α水平。采用甲基百里香酚蓝比色法测定组织匀浆中Ca2+含量,运用Griess试剂法测定NO含量,并采用BCA法测定大鼠组织匀浆总蛋白含量。上述测定方法均按各试剂盒说明进行,实验数据采用ELISACalc软件进行分析,以四参数Logistic曲线模型拟合标准曲线,并通过标准曲线计算各样本浓度。
1.8 统计学方法采用SPSS 19.0软件进行统计分析,实验结果以均数±标准差(x±s)表示,正态分布资料采用单因素方差分析比较多组间差异,偏态分布资料采用Wilcoxon秩和检验分析,P < 0.05表示差异有统计学意义。
2 结果 2.1 扭体反应观察空白组大鼠未出现扭体反应,模型组大鼠在注射缩宫素后30 min内的扭体发生率为90%,提示动物模型成功建立。与模型组相比,阳性药组、高剂量组、中剂量组、低剂量组大鼠扭体发生率均有不同程度的降低,其中高剂量组与阳性药组大鼠扭体反应次数显著减少,差异具有统计学意义(P < 0.05),详见表 1。
|
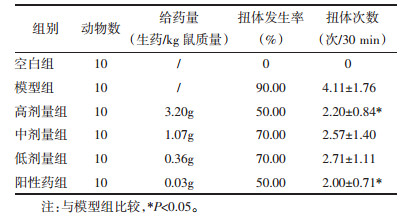
与正常大鼠相比,原发性痛经模型大鼠血浆E2水平显著升高(P < 0.01),血浆Prog水平显著降低(P < 0.05)。但阳性药与元胡止痛口服液给药后,模型大鼠血浆E2与Prog水平均未见显著回调。见图 1。
|
| 与模型组比较,*P<0.05,**P<0.01 图 1 元胡止痛口服液对大鼠血浆E2(A)、Prog(B)水平的影响(n=10) Fig. 1 Effects of Yuanhu Zhitong Oral Liquid on the levels of E2(A) and Prog(B) in the plasma of rats(n=10) |
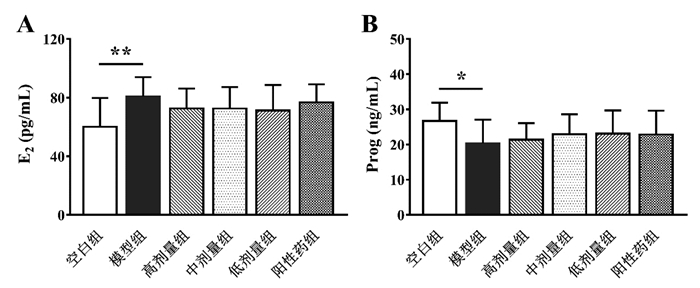
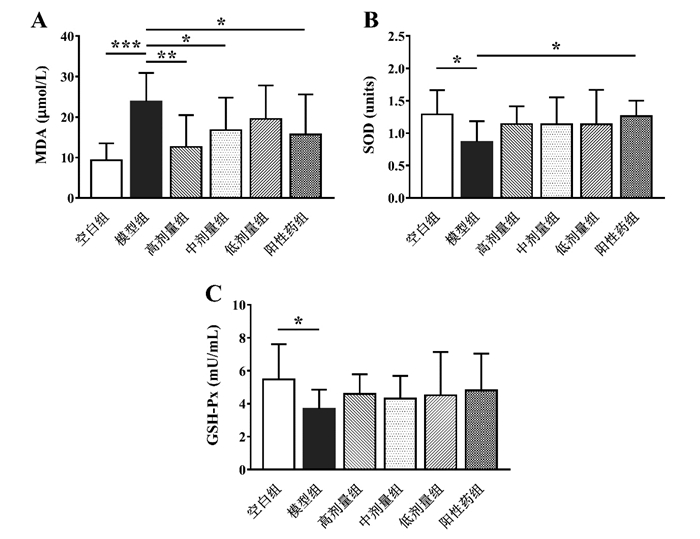
与空白组相比,模型组大鼠血浆MDA水平显著升高(P < 0.001),血浆SOD与GSH-Px水平显著降低(P < 0.05)。与模型组相比,阳性药组、高剂量组、中剂量组大鼠血浆MDA水平均显著下调(P < 0.05)。但与模型组相比,元胡止痛口服液各剂量组大鼠血浆SOD与GSH-Px水平均无显著变化,结果见图 2。
|
| 与模型组比较,*P<0.05,**P<0.01,***P<0.001 图 2 元胡止痛口服液对大鼠血浆MDA(A)、SOD(B)与GSH-Px(C)水平的影响(n=10) Fig. 2 Effects of Yuanhu Zhitong Oral Liquid on the levels of MDA(A)、SOD(B) and GSH-Px(C) in the plasma of rats(n=10) |
与正常大鼠相比较,原发性痛经模型大鼠子宫组织PGF2α水平显著升高(P < 0.001),PGE2水平显著降低(P < 0.05),且PGE2α/PGE2比值显著增高(P < 0.001)。元胡止痛口服液给药后,各剂量组大鼠子宫PGE2α水平均显著下调(P < 0.01),且各组PGE2α/PGE2比值与模型组相比均显著降低(P < 0.01)。但元胡止痛口服液与阳性药对大鼠子宫PGE2水平无显著影响。见图 3。
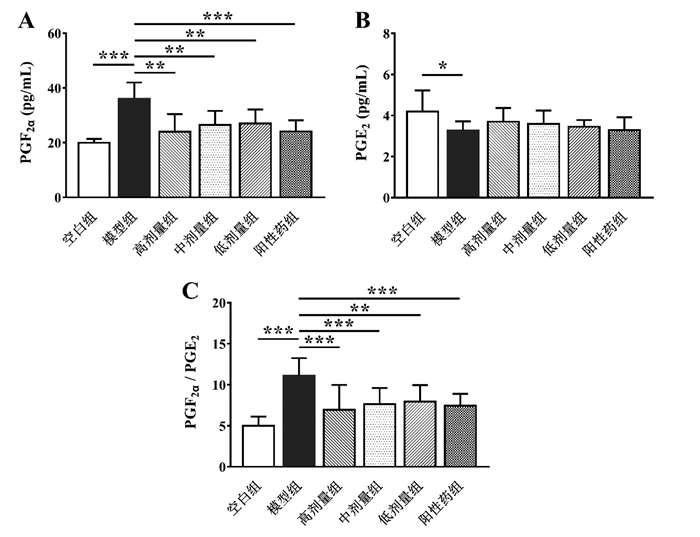
|
| 与模型组比较,*P<0.05,**P<0.01,***P<0.001 图 3 元胡止痛口服液对大鼠子宫PGF2α(A)、PGE2(B)与PGF2α/PGE2(C)水平的影响(n=10) Fig. 3 Effects of Yuanhu Zhitong Oral Liquid on the levels of PGF2α(A), PGE2(B) and PGF2α/PGE2(C) in the uterus of rats(n=10) |
与正常大鼠相比,模型大鼠子宫组织TXB2水平显著升高(P < 0.01),6-keto-PGF1α水平显著降低(P < 0.001),TXB2/6-keto-PGF1α比值显著增高(P < 0.001)。元胡止痛口服液对模型大鼠子宫TXB2水平无显著影响,但对6-keto-PGF1α有一定的调节作用,高剂量组与中剂量组大鼠子宫6-keto-PGF1α水平与模型组相比均显著升高(P < 0.05),且各剂量组大鼠子宫TXB2/6-keto-PGF1α比值均显著下调(P < 0.05)。见图 4。
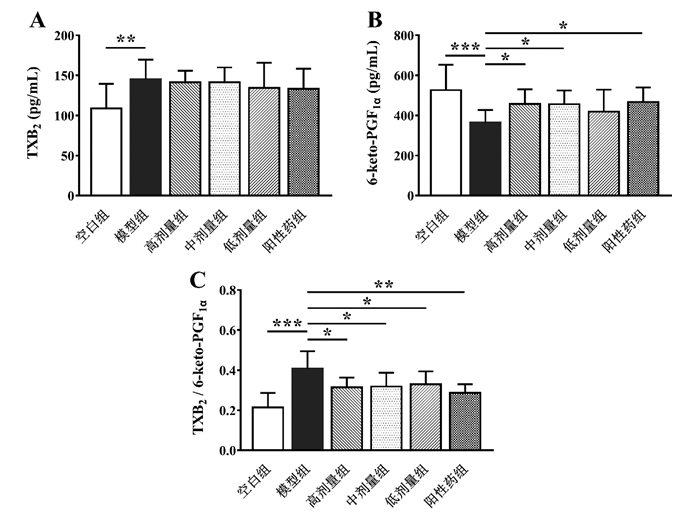
|
| 与模型组比较,*P<0.05,**P<0.01,***P<0.001 图 4 元胡止痛口服液对大鼠子宫TXB2(A)、6-keto-PGF1α(B)与TXB2/6-keto-PGF1α(C)水平的影响(n=10) Fig. 4 Effects of Yuanhu Zhitong Oral Liquid on the levels of TXB2(A), 6-keto-PGF1α(B) and TXB2/6-keto-PGF1α (C) in the uterus of rats(n=10) |
与空白组相比,模型组大鼠子宫组织Ca2+含量显著升高(P < 0.01),NO水平显著下降(P < 0.05)。与模型组相比,阳性药组、高剂量组、中剂量组大鼠子宫Ca2+含量均显著下调(P < 0.05),同时大鼠子宫NO水平有上调趋势,但无统计学意义,结果见图 5。

|
| 与模型组比较,*P<0.05,**P<0.01 图 5 元胡止痛口服液对大鼠子宫Ca2+(A)、NO(B)水平的影响(n=10) Fig. 5 Effects of Yuanhu Zhitong Oral Liquid on the levels of Ca2+(A) and NO(B) in the uterus of rats(n=10) |
原发性痛经的主要症状表现为周期发作的下腹部痉挛性疼痛,缩宫素诱导的痛经动物模型是观察原发性痛经疼痛程度的首选模型,而扭体反应则是评价动物疼痛程度的经典行为学指标,目前在原发性痛经的机制与防治研究中有广泛应用[8-9]。本研究首先灌胃给予大鼠己烯雌酚以提高子宫敏感性,之后注射缩宫素诱发子宫痉挛性收缩,观察到模型大鼠出现典型的扭体反应,与文献报道一致[10],提示痛经大鼠模型的成功建立。进一步研究发现,元胡止痛口服液可显著减少痛经大鼠扭体反应发生次数,降低大鼠扭体反应发生率,提示元胡止痛口服液对缩宫素诱导的痛经大鼠模型具有显著的镇痛作用。
原发性痛经的发病机制较为复杂,目前认为是由多项因素综合作用的结果[11]。较多研究表明,氧化应激与脂质过氧化参与了原发性痛经的发生发展过程[12-13]。正常状态下,机体产生的氧自由基可被SOD、GSH-Px等抗氧化酶迅速清除。痛经时,子宫平滑肌痉挛性收缩导致子宫肌层与内膜的暂时性缺血,子宫组织细胞由于缺血-再灌注而产生较多的氧自由基,同时抗氧化酶活性降低,脂质过氧化反应增强,产生了较多的脂质自由基及降解产物MDA,进而破坏细胞膜结构,加重子宫内膜的损伤,进一步加剧了痛经症状[14]。MDA是脂质过氧化反应的最终产物,其水平反应了脂质过氧化的程度,本研究观察到缩宫素诱导的痛经模型大鼠血浆MDA水平显著升高,同时SOD与GSH-Px活性显著降低,与文献报道一致[15],提示模型大鼠处于氧化应激与脂质过氧化状态。元胡止痛口服液给药后,虽然模型大鼠血浆SOD与GSH-Px无显著回调,但观察到血浆MDA水平显著降低,这提示元胡止痛口服液对痛经子宫内膜缺血-再灌注损伤时的脂质过氧化状态有一定的调节作用。
另一方面,原发性痛经与子宫内膜前列腺素的合成与分泌异常密切相关[16]。较多文献报道[17-18]原发性痛经患者子宫内膜与外周血中PGE2α含量显著增高,且PGE2α/PGE2比例失衡。高浓度的PGE2α作用于螺旋小动脉壁上的PGE2α受体,可引起子宫平滑肌痉挛性收缩,致使子宫缺血缺氧,酸性代谢产物堆积于子宫肌层进而诱发痛经。相反,PGE2具有松弛子宫平滑肌,抑制子宫收缩的功能,二者比值(PGE2α/PGE2)的升高提示痛经程度的加重[19]。本研究观察到原发性痛经模型大鼠子宫组织PGE2α水平与PGE2α/PGE2比值均显著升高,与Lu等[20]研究结果一致。元胡止痛口服液可使模型大鼠子宫PGE2α水平显著下调,并使PGE2α/PGE2比值显著降低,提示元胡止痛口服液可通过调节子宫PGE2α含量缓解平滑肌痉挛以发挥镇痛作用。
其次,子宫平滑肌的痉挛性收缩与血栓素A2(TXA2)和前列环素(PGI2)的比例失调有密切关联[21]。TXA2由血小板释放,具有收缩血管和促进血小板聚集的功能;PGI2则由血管内皮细胞释放,具有扩张血管、抗血小板聚集的作用;TXA2/PGI2代谢失衡致使子宫局部微循环障碍,导致子宫缺血缺氧,进而引起子宫平滑肌痉挛性收缩,加重痛经症状[22]。但是TXA2与PGI2在体内均不稳定,半衰期较短,因此常检测二者各自的代谢产物TXB2与6-keto-PGF1α来间接反映TXA2与PGI2的水平[23]。在本研究中,原发性痛经模型大鼠子宫组织TXB2与6-keto-PGF1α的比值显著增高,元胡止痛口服液能显著改善模型大鼠子宫6-keto-PGF1α水平,对TXB2/6-keto-PGF1α比例的失衡具有一定的调节作用,提示元胡止痛口服液可通过改善痛经大鼠子宫微循环障碍而缓解痛经症状。
此外,本研究还观察到元胡止痛口服液可使原发性痛经大鼠子宫Ca2+水平显著降低。现代医学研究表明,痛经时子宫组织细胞由于缺血-再灌注会造成细胞内Ca2+超载,一方面导致细胞能量耗竭,细胞膜受损;另一方面加剧了血管收缩,使子宫内膜供血不足,加剧子宫平滑肌痉挛性收缩,引发痛经[24]。元胡止痛口服液对模型大鼠子宫Ca2+稳态失衡的调节作用,可能与抑制缩宫素诱导的细胞内质网Ca2+释放,以及影响子宫平滑肌细胞膜上的电压依赖性Ca2+通道密切相关[25]。本研究还发现原发性痛经大鼠血浆E2含量显著升高,血浆Prog与子宫NO水平显著降低,提示模型大鼠生殖激素与内源性NO的合成与释放出现异常,与文献报道一致[26-27]。但在给药后未观察到模型大鼠血浆E2与Prog水平有显著的回调,提示元胡止痛口服液对痛经大鼠生殖激素的代谢失衡没有显著的影响。同时,元胡止痛口服液对大鼠子宫NO的调节作用也较为有限,具体还有待进一步的实验验证。
综上所述,元胡止痛口服液可显著减少缩宫素所致痛经大鼠模型的扭体次数,其主要通过降低大鼠血浆MDA水平,下调子宫组织PGE2α与Ca2+含量,以及上调子宫6-keto-PGF1α水平而发挥解痉镇痛作用。该研究为元胡止痛口服液临床用于治疗原发性痛经提供了一定的药效学依据,其作用机制和靶点还有待进一步的验证与研究。
| [1] |
孙晓理, 杜彩素. 原发性痛经的影响因素及干预研究进展[J]. 中国社会医学杂志, 2017, 34(3): 262-264. DOI:10.3969/j.issn.1673-5625.2017.03.016 |
| [2] |
De Sanctis V, Soliman AT, Elsedfy H, et al. Dysmenorrhea in adolescents and young adults:a review in different country[J]. Acta Biomed, 2017, 87(3): 233-246. |
| [3] |
马艳, 张迎春, 陶野, 等. 基于整合药理学策略的元胡止痛方研究进展[J]. 中国中药杂志, 2015, 40(6): 1048-1054. |
| [4] |
张秀书. 元胡止痛片结合运动治疗女大学生原发性痛经疗效观察[J]. 河北中医, 2015, 37(6): 904-905. DOI:10.3969/j.issn.1002-2619.2015.06.038 |
| [5] |
方远书, 何忠平, 张辉, 等. 元胡止痛胶囊的含药血清对痛经模型动物的影响[J]. 中国比较医学杂志, 2010, 20(8): 35-37. DOI:10.3969/j.issn.1671-7856.2010.08.009 |
| [6] |
韩彦琪, 许浚, 张喜民, 等. 基于网络药理学的元胡止痛滴丸治疗原发性痛经的作用机制研究[J]. 药学学报, 2016, 51(3): 380-387. |
| [7] |
陈奇, 张伯礼. 中药药效研究方法学[M]. 北京: 人民卫生出版社, 2016: 651-652.
|
| [8] |
Pu BC, Fang L, Gao LN, et al. Animal study on primary dsmenorrhoea treatment at different administration times[J]. Evid Based Complement Alternat Med, 2015, 2015: 367379. |
| [9] |
中华中医药学会, 中药实验药理专业委员会. 痛经动物模型制备规范(草案)[J]. 中国实验方剂学杂志, 2018, 24(19): 20-24. |
| [10] |
嵇波, 张露芬, 朱江, 等. 痛经模型建立和评价方法的思考[J]. 中国药理学通报, 2008, 24(6): 711-714. DOI:10.3321/j.issn:1001-1978.2008.06.004 |
| [11] |
Iacovides S, Avidon I, Baker FC. What we know about primary dysmenorrhea today:a critical review[J]. Hum Reprod Update, 2015, 21(6): 762-778. DOI:10.1093/humupd/dmv039 |
| [12] |
Orimadegun BE, Awolude OA, Agbedana EO. Markers of lipid and protein peroxidation among Nigerian university students with dysmenorrhea[J]. Niger J Clin Pract, 2019, 22(2): 174-180. |
| [13] |
Turhan N, Celik H, Duvan CI, et al. Investigation of oxidative balance in patients with dysmenorrhea by multiple serum markers[J]. J Turk Ger Gynecol Assoc, 2012, 13(4): 233-236. DOI:10.5152/jtgga.2012.36 |
| [14] |
Dikensoy E, Balat O, Pence S, et al. Malondialdehyde, nitric oxide and adrenomedullin levels in patients with primary dysmenorrhea[J]. J Obstet Gynaecol Res, 2008, 34(6): 1049-1053. |
| [15] |
马跃, 杨燕云, 张振秋, 等. 芍药甘草汤不同极性部位对痛经模型大鼠MDA、SOD、GSH-PX、ROS、NO、PGE2、PGF2α影响[J]. 辽宁中医药大学学报, 2017, 19(3): 32-34. |
| [16] |
Bernardi M, Lazzeri L, Perelli F, et al. Dysmenorrhea and related disorders[J]. F1000Res, 2017, 6: 1645. DOI:10.12688/f1000research.11682.1 |
| [17] |
Haidari F, Homayouni F, Helli B, et al. Effect of chlorella supplementation on systematic symptoms and serum levels of prostaglandins, inflammatory and oxidative markers in women with primary dysmenorrhea[J]. Eur J Obstet Gynecol Reprod Biol, 2018, 229: 185-189. DOI:10.1016/j.ejogrb.2018.08.578 |
| [18] |
Dawood MY. Primary dysmenorrhea:advances in pathogenesis and management[J]. Obstet Gynecol, 2006, 108(2): 428-441. DOI:10.1097/01.AOG.0000230214.26638.0c |
| [19] |
蒲宝婵, 姜国云, 方玲. 原发性痛经疼痛因子及其关联性研究[J]. 中华中医药学刊, 2014, 32(6): 1368-1370. |
| [20] |
Lu Y, Cao ZY, Yu BY, et al. An in vivo mouse model of primary dysmenorrhea[J]. Exp Anim, 2015, 64(3): 295-303. DOI:10.1538/expanim.14-0111 |
| [21] |
Dawood MY, Khan-Dawood FS. Differential suppression of menstrual fluid prostaglandin F2α, prostaglandin E2, 6-keto prostaglandin F2α and thromboxane B2 by suprofen in women with primary dysmenorrhea[J]. Prostaglandins Other Lipid Mediat, 2007, 83(1-2): 146-153. |
| [22] |
Sales KJ, Jabbour HN. Cyclooxygenase enzymes and prostaglandins in pathology of the endometrium[J]. Reproduction, 2003, 126(5): 559-567. DOI:10.1530/rep.0.1260559 |
| [23] |
Kij A, Mateuszuk L, Sitek B, et al. Simultaneous quantification of PGI2 and TXA2 metabolites in plasma and urine in NO-deficient mice by a novel UHPLC/MS/MS method[J]. J Pharm Biomed Anal, 2016, 129: 148-154. DOI:10.1016/j.jpba.2016.06.050 |
| [24] |
Chen W, Khalil RA. Differential[J]. Am J Physiol Regul Integr Comp Physiol, 2008, 295(6): 1962-1972. DOI:10.1152/ajpregu.90523.2008 |
| [25] |
徐敬东, 王文, 杨惠霞, 等. 延胡索对未孕大鼠离体子宫平滑肌运动的抑制作用[J]. 中国组织工程研究与临床康复, 2007, 11(21): 4178-4181. DOI:10.3321/j.issn:1673-8225.2007.21.050 |
| [26] |
Liu P, Duan JA, Guo JM, et al. Plasma metabolic profiling of normal and dysmenorrhea syndrome rats and the effects of Xiang-Fu-Si-Wu Decoction intervention[J]. Pharm Biol, 2013, 52(5): 603-613. |
| [27] |
Huang XC, Su SL, Duan JA, et al. Effects and mechanisms of Shaofu-Zhuyu decoction and its major bioactive component for Cold-Stagnation and Blood-Stasis primary dysmenorrhea rats[J]. J Ethno-pharmacol, 2016, 186: 234-243. DOI:10.1016/j.jep.2016.03.067 |
2. Tianjin Key Laboratory of Translational Research of TCM Prescription and Syndrome, Tianjin 301617, China;
3. Tianjin Academy of Traditional Chinese Medicine Affiliated Hospital, Tianjin 300120, China;
4. Graduate School, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
5. Henan Fusen Pharmaceutical Co., Ltd., Henan 474450, China;
6. Institute of Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2019, Vol. 36
2019, Vol. 36