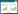文章信息
- 刘鑫, 赵颖, 王永洁, 刘欣妍, 刘葭, 吴清
- LIU Xin, ZHAO Ying, WANG Yongjie, LIU Xinyan, LIU Jia, WU Qing
- 基于网络药理学的当归补血汤辅助治疗肺癌的作用机制研究
- Action mechanism of Danggui Buxue Decoction in adjuvant treatment of lung cancer based on network pharmacology
- 天津中医药, 2019, 36(10): 1012-1020
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(10): 1012-1020
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.10.19
-
文章历史
- 收稿日期: 2019-03-21
肺癌在所有肿瘤中是最主要的致死因素,已成为全球共同面对和急需解决的公共卫生问题之一[1]。肺癌病死率逐年增加,严重威胁人类健康并加重社会负担[2]。目前,西医临床上多采用化疗的方法进行治疗[3],但化疗的同时,患者的正常细胞也会受到损伤,不良反应较大,因此肺癌患者进行化疗时,临床上多采用中药复方进行辅助治疗[4]。
当归补血汤由黄芪和当归两味中药组成,出自李东垣的《内外伤辨惑论》,是补气生血的经典名方[5-6]。方中黄芪补脾肺之气,固护肌表,为君药;当归养血和营,为臣药,两药配伍,共奏补气生血之功效[7]。当归补血汤化学成分复杂,主要含有黄酮类、多糖类及挥发油类成分。现代药理学研究表明,当归补血汤具有改善血液系统疾病、调节免疫系统、促进血管生成、抗肿瘤等药理作用[8-9]。亦有临床报道用当归补血汤及其加减方作为肺癌化疗时的辅助用药[10-11],但当归补血汤辅助治疗肺癌的具体机制仍然不清晰。
由于中药具有多成分、多靶点的特点,为研究中药治疗某种疾病的作用机制增添了难度,网络药理学的出现促进了中药作用机制的研究。网络药理学融合了系统生物学、多向药理学、网络分析学及计算生物学等多学科的技术和内容,通过构建“疾病-表型-基因-药物”的多层次结构网络,从系统水平上揭示药物与疾病之间的关系,其系统性、整体性的思想与中医中药辨证论治、协同作用理念不谋而合[12-14]。因此,本研究采用网络药理学方法,对当归补血汤多成分、多靶点与肺癌的复杂网络关系进行分析,旨在揭示当归补血汤辅助治疗肺癌的作用机制,为其应用提供一定的理论依据。
1 方法 1.1 研究思路利用网络药理学的方法研究当归补血汤辅助治疗肺癌的实验思路见图 1。

|
| 图 1 当归补血汤辅助治疗肺癌的网络药理学研究方法示意图 Fig. 1 Work scheme of network pharmacology approach of Danggui Buxue Decoction in adjuvant treatment of lung cancer |
本实验利用中药系统药理学分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)[15],分别以“黄芪”“当归”为关键词进行搜索,检索当归补血汤中的所有化学成分。将筛选条件设置为OB≥30%,DL≥0.18[16],筛选出当归补血汤中的活性成分。
1.3 当归补血汤成分靶点的垂钓利用中药成分靶点数据库(HIT,http://lifecenter.sgst.cn/hit/)查询成分已验证的靶点[17],通过PubChem(https://pubchem.ncbi.nlm.nih.gov/)查询化合物的SMILES[18]号,然后将SMILES号导入Swiss Target Prediction Database(http://www.swisstargetprediction.ch/)预测成分的靶点[19]。通过Uniprot数据库(https://www.uniprot.org/)[20]将所有成分的靶点校准为官方基因名称。
1.4 疾病靶点的查找通过Therapeutic Targets Database(TTD,http://bidd.nus.edu.sg/group/cjttd/)[21],Drugbank database(https://www.drugbank.ca/)[22],及DisGeNET database(http://www.disgenet.org/web/ DisGeNET/menu/home)[23]查找肺癌相关靶点,并通过Uniprot数据库统一基因名称。
1.5 成分靶点与疾病靶点共同靶点的获取通过Venny 2.1.0(http://bioinfogp.cnb.csic.es/tools/ venny/)[24]将成分靶点与疾病靶点取交集得到共同靶点,这些共同靶点认为是当归补血汤辅助治疗肺癌可能的关键靶点。
1.6 网络的构建和分析通过Cytoscape 3.2.1构建成分-靶点等多层次网络图。网络中节点的拓扑学特征可以通过Cytoscape中的NetworkAnalyzer进行计算,包括自由度、介数中心性及平均最短路径长度等,其中度值是较为重要的评价指标[25]。
1.7 基因富集分析通过DAVID数据库(https://david.ncifcrf.gov/)进行通路富集分析,并通过Omicshare平台(http://www.omicshare.com/tools/index.php/)对通路富集分析的结果进行可视化处理[26]。
2 结果 2.1 当归补血汤中活性成分的收集通过TCMSP数据库查找到当归补血汤212个成分,其中黄芪87个,当归125个,经过OB值和DL值筛选后,黄芪剩余19个成分,当归剩余2个成分。中药中某些成分本身具有良好的生物活性,但因其口服生物利用度较低或不具有良好的类药性等,在筛选时易被过滤掉,因此,本实验在查阅文献的基础上[27-29],黄芪中加入活性成分黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ及黄芪甲苷,共有23个成分纳入后续研究,当归中加入活性成分阿魏酸及藁本内酯,一共4个成分纳入研究,见表 1。
通过HIT数据库查找成分已通过实验验证的靶点,利用基于结构相似性原理的Swiss Target Prediction Database来预测成分的靶点,黄芪中共得到398个靶点,当归中得到60个靶点,删除重复项后,剩余194个靶点,其中有26个靶点为黄芪和当归所共有。通过TTD、Drugbank及DisGeNET数据库查找肺癌相关靶点,其中TTD数据库中查找到88个疾病靶点,Drugbank数据库查找到135个,DisGeNET数据库查找到70个靶点,删除重复后剩余263个疾病相关靶点。通过Venny 2.1.0将成分靶点与疾病靶点取交集,得到45个共同靶点,这45个共同靶点视为当归补血汤辅助治疗肺癌可能的潜在靶点,见图 2及表 2。
|
| 图 2 成分靶点与疾病靶点取交集后的韦恩图 Fig. 2 Venn diagram after intersection of component targets and disease targets |

|
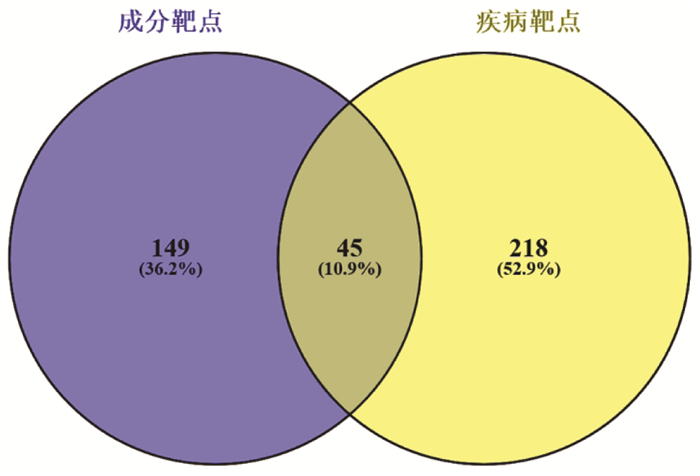
通过Cytoscape构建当归补血汤中成分-对应靶点的网络图,如图 3所示,该网络中包含了221个节点,458条边,其中节点代表当归补血汤中成分或者成分对应的靶点,边表示成分和靶点之间具有相互作用,通过网络图可以看出,存在多个成分对应一个靶点或者一个成分对应多个靶点的现象,表明当归补血汤是通过多成分、多靶点协同起效的方式辅助治疗肺癌的。通过Cytoscape构建当归补血汤中活性成分对应45个共同靶点的网络图,见图 4,网络具有68个节点(45个为靶点节点,23个为成分节点),103条边,利用Cytoscape中的NetworkAnalyzer分析节点的度值及相关参数,节点颜色由粉色变红色表明度值逐渐增大,根据度值判断靶点的重要性,由图 4可以看出,成分度值排名前3的为山奈酚(AR-15,度值20)、槲皮素(AR-19,度值8)、芒柄花素(AR-12,度值7),这些成分可能是当归补血汤辅助治疗肺癌比较重要的成分,靶点度值排名前3的为微管相关蛋白Tau(MAPT,度值12)、细胞色素P450 19A1(CYP19A1,度值10)、雌激素受体α(ESR1,度值8),当归补血汤可能通过作用于这些靶点发挥辅助治疗肺癌的作用。

|
| 图 3 当归补血汤中成分-靶点相互作用网络(紫色-黄芪成分,蓝色-黄芪靶点,黄色-当归成分,绿色-当归靶点,红色-黄芪当归共同靶点) Fig. 3 Compounds-targets interaction network of Danggui Buxue Decoction(Purple-Compounds of Astragali Radix, BlueTargets of Astragali Radix, Yellow-Compounds of Angelicae Sinensis Radix, Green-Targets of Angelicae Sinensis Radix, Red-Common targets of Astragali Radix and Angelicae Sinensis Radix) |
|
| 图 4 当归补血汤辅助治疗肺癌活性成分-45个潜在作用靶点网络图(节点颜色由粉色变红色表明自由度逐渐增大,菱形-活性成分,圆形-靶点) Fig. 4 Network of active ingredients for adjuvant treatment of lung cancer in Danggui Buxue Decoction - 45 potential targets(The change of nodes color from pink to red indicates that the degree of freedom increases gradually, Diamond-Active component, Circular-Target) |
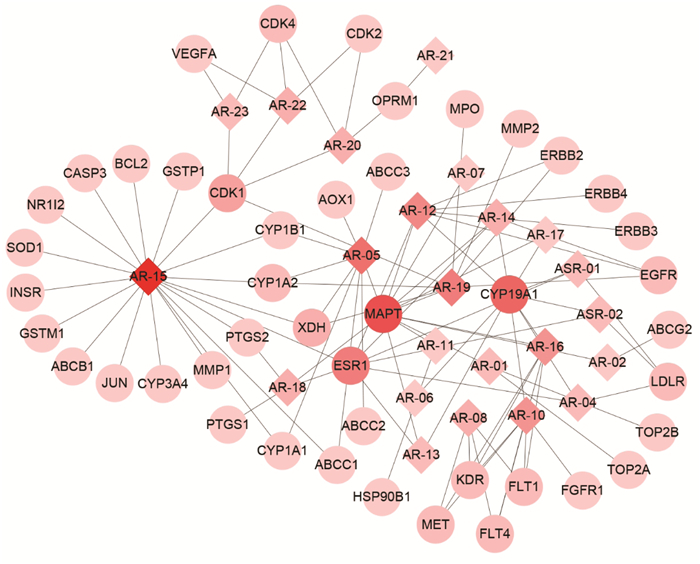
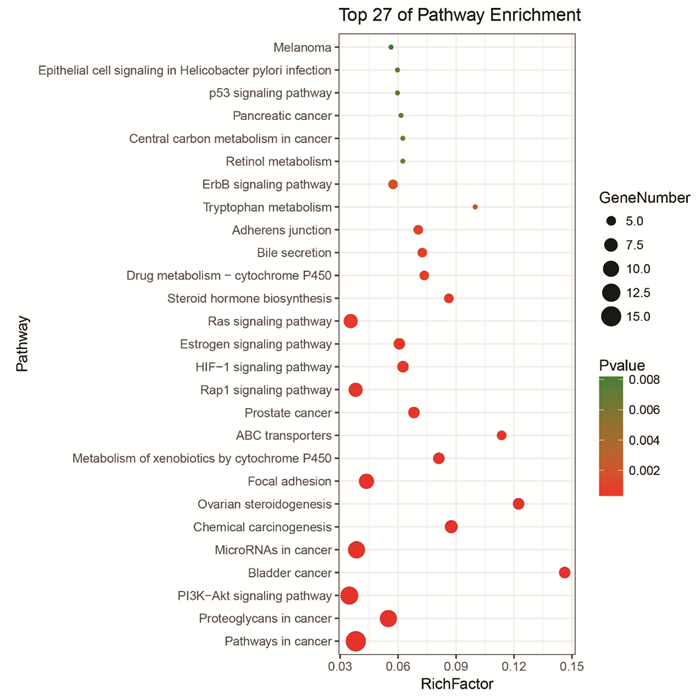
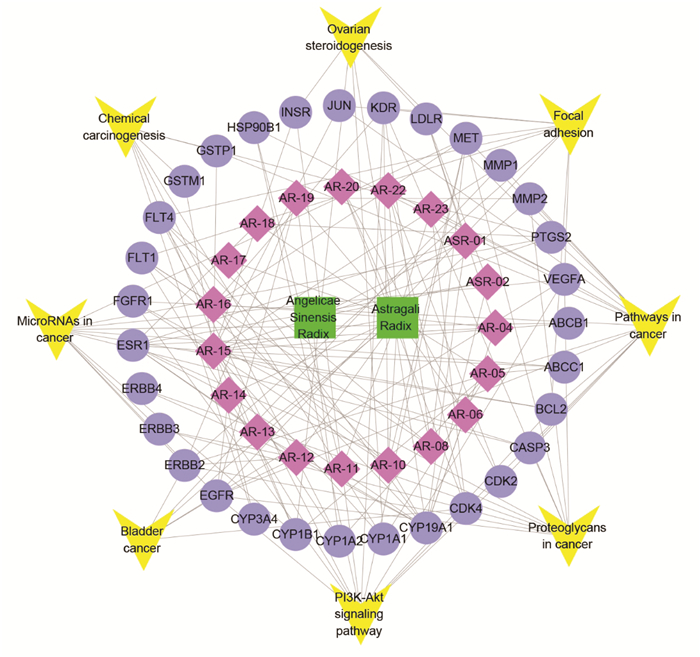
通过DAVID平台对45个靶点进行基因的功能注释及通路富集分析,结果表明45个靶点参与了170个生物过程相关的条目、30个细胞组成相关条目、54个分子功能相关条目,根据FDR < 0.05进行筛选,生物过程筛选出16个条目,主要涉及跨膜受体蛋白酪氨酸激酶信号通路、细胞增殖的正向调控等方面;细胞组成筛选出3个条目,涉及受体复合物、细胞器膜等方面;分子功能筛选出12个条目,主要涉及受体信号蛋白酪氨酸激酶活性、ATP结合等方面,见图 5。将DAVID通路富集分析结果P值< 0.01的前27条通路通过Omicshare平台进行可视化,结果见图 6,图中圆点越大,表明通路富集到的基因数目越多,圆点的颜色越红,表明P值越小。对FDR < 0.05的8条通路通过Cytoscape构建当归补血汤中中药-活性成分-靶点-关键通路网络,结果如图 7所示,其中度值较高的通路为癌症通路(pathwanys in cancer,度值15)、癌症蛋白聚糖(Proteoglycans in cancer,度值11)、磷脂酰肌醇3激酶-蛋白激酶B信号通路(PI3K-Akt signaling pathway,度值12)等,表明当归补血汤可能通过作用于这些通路来达到辅助治疗肺癌的目的。
|
| 图 5 GO功能富集分析 Fig. 5 GO function enrichment analysis |
|
| 图 6 KEGG富集分析 Fig. 6 Enrichment analysis of KEGG |
|
| 图 7 中药-成分-靶点-通路网络(绿色-中药,紫色-活性成分,蓝色-靶点,黄色-通路) Fig. 7 Network of Traditional Chinese medicine-Components-Targets-Pathways(Green-Traditional Chinese medicine, Purple-Active component, Blue-Target, Yellow-Pathway) |
当归补血汤由黄芪和当归两味药组成,是“补气生血”的经典方,可用于治疗多种疾病,临床上也用于肺癌化疗时的辅助用药[10]。由于中药复方由多味中药组成,每味中药组成成分复杂,每个成分对应靶点较多,靶点之间可能存在协同或拮抗等作用,因此难以阐明中药复方治疗某种疾病的作用机制。网络药理学是在研究者所建立的数据库中进行中药成分、成分靶点、疾病靶点的查找,可以系统性、整体性的揭示靶点与疾病之间的相互关系,阐明中药复方治疗疾病的作用机制,这与中医整体观、辨证论治的思想不谋而合[12]。因此,本研究采用网络药理学的方法,探究当归补血汤辅助治疗肺癌的作用机制,为临床上当归补血汤的使用提供一定的理论指导。
本研究分析了当归补血汤中黄芪和当归两味中药的活性成分,通过数据库的查找、筛选及文献的查阅,最终得到27个活性成分,其中23个属于君药黄芪,4个属于臣药当归。通过数据库的查询,黄芪中得到398个靶点,当归中得到60个靶点,删除重复靶点后,剩余194个成分靶点,有26个靶点为黄芪和当归所共有。通过公共数据库的查找,共查找到疾病相关靶点263个,将成分靶点与疾病靶点取交集后,得到45个共同靶点,这45个靶点视为当归补血汤辅助治疗肺癌可能的关键靶点。通过构建当归补血汤中活性成分-45个潜在作用靶点网络,预测出槲皮素、山奈酚、芒柄花素可能是当归补血汤辅助治疗肺癌的关键成分,已有研究表明槲皮素可以诱发BCL2/BAX介导的A549细胞凋亡坏死,并且通过扰动微管的有丝分裂,导致单极纺锤体的形成,造成细胞分裂的失败,槲皮素还可以通过抑制波形蛋白和n-钙黏蛋白的表达抑制A549细胞的迁移[30];山奈酚可以抑制人非小细胞肺癌A549细胞的活力,降低cyclinD1的表达水平,用山奈酚处理A549细胞后,p-PI3K和p-Akt水平降低,表明山奈酚可以通过抑制PI3K-Akt信号通路的激活发挥抗肿瘤的作用[31];芒柄花素可以改变细胞周期相关蛋白p21、细胞周期蛋白A及细胞周期蛋白D1的表达水平,诱导A549及NCI-H23两种非小细胞肺癌细胞株细胞周期阻滞于G1期,从而促进细胞凋亡[32]。槲皮素、山奈酚、芒柄花素均可在一定程度上抑制肺癌的发展,表明网络药理学的结果具有一定的可靠性。黄芪多糖是黄芪的有效部位,现代大量研究表明黄芪多糖具有良好的调节免疫、抗肿瘤的作用,因此可以用作治疗肺癌时的辅助用药[33],如王永清[34]等发现黄芪多糖联合顺铂对Lewis肺癌荷瘤小鼠的肿瘤生长具有抑制作用,增强机体的免疫功能、抑制血管内皮生长因子(VEGF)的表达及增加内皮抑素(Endostatin)的表达是其可能的作用机制,但黄芪多糖本身是一种混合物,结构较为复杂,而网络药理学主要关注小分子化合物,因此在本研究中未涉及黄芪多糖。MAPT、CYP19A1、ESR1等是当归补血汤辅助治疗肺癌的主要靶点。MAPT与微管的聚合及解聚密切相关,并可以维持微管动力学的平衡[35]。MAPT与紫杉类药物具有相同的结构域,因此,当MAPT高表达时,可以竞争性的与微管结合,这可能是采用紫杉类药物对肺癌患者进行化疗时机体产生耐药性的原因[36],亦有研究通过miR-186靶向MAPT调节非小细胞肺癌对紫杉醇的化疗敏感性[37]。CYP19A1又称为芳香化酶或雌激素合成酶,可以将人体内雄激素转化为雌激素,是该过程的关键限速酶[38],雌激素可以促进肺癌细胞的增殖,肺癌患者中雌激素水平往往高于正常人体,抗雌激素药物对肺癌的发展具有抑制作用[39],有研究表明,非小细胞肺癌患者标本中的CYP19A1蛋白含量明显高于正常标本[40],亦有研究发现,CYP19A1基因的一个单核苷酸多态性基因分型rs3764221通过引起更高水平CYP19A1的表达而促进肺腺癌的发展[41]。因此推测当归补血汤可以作用于CYP19A1,从而减少雌激素的合成,抑制肺癌细胞增殖,达到辅助治疗肺癌的作用。雌激素是类固醇激素,通过与靶器官上的雌激素受体结合而在体内发挥作用。雌激素受体主要有两个亚型,雌激素受体α(ESR-α,ESR1)和雌激素受体β(ESR-β,ESR2)[42]。Unai等[40]发现ESR1在正常肺组织样本中的表达要明显高于非小细胞肺癌样本,并且高表达ESR1的非小细胞肺癌患者生存率有所升高。现代研究表明,ESR1可以通过上调细胞周期蛋白D1的水平促进细胞异常增殖,并且抑制细胞凋亡从而促进肿瘤的生长,ESR1也可以与EGFR相互作用激活PI3K-Akt信号通路促进细胞的增殖,该信号通路可以调节ESR1的活性,同样ESR1对PI3K-Akt信号通路也具有调节作用[43]。有研究表明,PI3K-Akt通路可以参与免疫抑制微环境的形成,影响肿瘤微环境内免疫细胞的活性,而阻断该通路可以恢复机体被破坏的免疫应答,增强自身免疫,从而增强抗肿瘤固有的免疫效应[44]。肺癌患者在化疗的同时,不仅杀死了癌细胞,人体的正常细胞也会受到损伤,使人体的免疫功能下降,中医学中的“气血阴阳亏虚”与现代医学中人体免疫功能低下关系密切,而当归补血汤可以补气生血[45],因此推测当归补血汤可能作用于ESR1,从而抑制PI3K-Akt信号通路的激活,通过增强自身的免疫能力达到辅助治疗肺癌的目的,但该推测仍需要通过进一步的实验进行验证。细胞周期蛋白依赖性激酶4(CDK4)及细胞周期蛋白依赖性激酶2(CDK2)与肺癌的发展关系密切[46],当归补血汤可能通过作用于CDK4及CDK2抑制细胞周期进程,从而起到辅助治疗肺癌的作用。肺癌的侵袭和转移依赖于丰富的血液供应,血管内皮生长因子(VEGF)在肺癌患者中高表达,基质金属蛋白酶(MMP)水平在肺癌患者中亦有所升高,从而促进肿瘤转移[47],因此推测当归补血汤可能作用于VEGF及MMP抑制肺癌的侵袭和转移,达到辅助治疗肺癌的目的。以上研究均表明MAPT、CYP19A1、ESR1、CDK4、CDK2、VEGF、MMP等基因与肺癌的发生发展密切相关,表明网络药理学预测的结果具有一定的可靠性。
综上所述,本研究采用网络药理学的方法,初步研究了当归补血汤中活性成分辅助治疗肺癌的作用机制,表明当归补血汤通过多成分、多靶点、多通路的方式达到协同起效的目的,为后续进一步研究当归补血汤辅助治疗肺癌的作用机制奠定了基础,为临床上当归补血汤的合理应用提供了理论依据。
| [1] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. Ca-Cancer J Clin, 2015, 65(2): 87-108. |
| [2] |
王蔚, 郭雅玲. 茶功能性成分对肺癌作用机制的研究进展[J]. 中草药, 2017, 48(17): 3654-3661. |
| [3] |
何伟, 程淼. 中药联合第一代EGFR-TKI治疗中晚期非小细胞肺癌有效性及安全性的Meta分析[J]. 中国中药杂志, 2017, 42(13): 2591-2598. |
| [4] |
刘玉才, 张焕珍, 于凤玲, 等. 加味当归补血汤对肺癌患者放疗后T淋巴细胞亚群及NK细胞的影响[J]. 药学研究, 2016, 35(4): 243-245. |
| [5] |
张孟之, 管连城, 陈雨佳, 等. 当归补血汤的研究进展[J]. 湖南中医杂志, 2018, 34(8): 241-243. |
| [6] |
谢东杰, 王爱迪, 刘宝山. 当归补血汤在血液疾病中作用机制的研究进展[J]. 中华中医药杂志, 2018, 33(6): 2488-2490. |
| [7] |
李冀. 方剂学[M]. 北京: 中国中医药出版社, 2015.
|
| [8] |
曾宇, 张三印, 胡冠英. 当归补血汤的研究进展[J]. 时珍国医国药, 2016, 27(2): 422-424. |
| [9] |
王艳杰, 康芯荣, 张雨薇, 等. 当归补血汤抗肿瘤作用研究进展[J]. 中国医学装备, 2017, 14(8): 165-169. |
| [10] |
王海波, 陈鹊汀, 赵丽, 等. 加味当归补血汤对非小细胞肺癌的辅助治疗疗效分析[J]. 中国中医基础医学杂志, 2014, 20(10): 1428-1430. |
| [11] |
申宇玲, 张三印. 当归补血汤抑制Lewis肺癌生长的前期研究[J]. 时珍国医国药, 2015, 26(8): 1840-1842. |
| [12] |
唐标, 邓常清. 基于网络药理学的降脂理肝汤治疗非酒精性脂肪肝病作用机制研究[J]. 中草药, 2018, 49(15): 3493-3500. |
| [13] |
单进军, 杨瑞, 张新庄, 等. 桔梗汤止咳祛痰的网络药理学研究[J]. 中草药, 2018, 49(15): 3501-3508. |
| [14] |
雷奇林, 黄雅兰, 钟茜, 等. 基于网络药理学的黄芩抗炎作用机制研究[J]. 中草药, 2018, 49(15): 3523-3530. |
| [15] |
Zeng LT, Yang KL. Exploring the pharmacological mechanism of yanghe decoction on her2-positive breast cancer by a network pharmacology approach[J]. J Ethnopharmacol, 2017, 199(5): 68-85. |
| [16] |
Tao WY, Xu X, Wang X, et al. Network pharmacology-based prediction of the active ingredients and potential targets of Chinese herbal Radix Curcumae formula for application to cardiovascular disease[J]. J Ethnopharmacol, 2013, 145(1): 1-10. |
| [17] |
Gao L, Wang XD, Niu YY, et al. Molecular targets of chinese herbs:a clinical study of hepatoma based on network pharmacology[J]. Sci Rep-UK, 2016, 6(1): 1-11. |
| [18] |
Zhao RL, He YM. Network pharmacology analysis of the anti-cancer pharmacological mechanisms of ganoderma lucidum extract with experimental support using hepa1-6-bearing c57 bl/6 mice[J]. J Ethnopharmacol, 2018, 210: 287-295. |
| [19] |
Gfeller D, Grosdidier A, Wirth M, et al. SwissTargetPrediction:a web server for target prediction of bioactive small molecules[J]. Nucleic Acids Res, 2014, 42(W1): W32-W38. |
| [20] |
Lee AY, Park W, Kang TW, et al. Network pharmacology-based prediction of active compounds and molecular targets in Yijin-tang acting on hyperlipidaemia and atherosclerosis[J]. J Ethnopharmacol, 2018, 221: 151-159. |
| [21] |
Liu F, Du X, Liu PR, et al. Screening and analysis of key active constituents in guanxinshutong capsule using mass spectrum and integrative network pharmacology[J]. Chin J Nat Medicines, 2018, 16(4): 302-312. |
| [22] |
Zhao SY, Liu ZL, Wang ML, et al. Anti-inflammatory effects of Zhishi and Zhiqiao revealed by network pharmacology integrated with molecular mechanism and metabolomics studies[J]. Phytomed-icine, 2018, 50: 61-72. |
| [23] |
Sundarrajan S, Arumugam M. A systems pharmacology perspective to decipher the mechanism of action of parangichakkai chooranam, a siddha formulation for the treatment of psoriasis[J]. Biomed Pharmacother, 2017, 88: 74-86. |
| [24] |
Saafan H, Foerster S, Parraguillen ZP, et al. Utilising the egfr interactome to identify mechanisms of drug resistance in non-small cell lung cancer-proof of concept towards a systems pharmacology approach[J]. Eur J Pharm Sci, 2016, 94: 20-32. |
| [25] |
Ge Q, Chen L, Tang M, et al. Analysis of mulberry leaf components in the treatment of diabetes using network pharmacology[J]. Eur J Pharmacol, 2018, 833: 50-62. |
| [26] |
谢盈彧, 刘璐, 李渊芳, 等. 基于网络药理学的四妙勇安汤在血管新生中的作用机制研究[J]. 中草药, 2018, 49(18): 4319-4330. |
| [27] |
靳如娜, 齐晓甜, 孙蓉, 等. 经典名方当归补血汤的药效物质基础和质量控制研究进展[J]. 中国实验方剂学杂志, 2019(16): 220-228. |
| [28] |
李延勋, 栗章彭, 颜世利, 等. 膜荚黄芪化学成分研究[J]. 中草药, 2017, 48(13): 2601-2607. |
| [29] |
宋秋月, 付迎波, 刘江, 等. 当归的化学成分研究[J]. 中草药, 2011, 42(10): 1900-1904. |
| [30] |
Klimaszewska-Wiśniewska A, Hałas-Wiśniewska M, Izdebska M, et al. Antiproliferative and antimetastatic action of quercetin on A549 non-small cell lung cancer cells through its effect on the cytoskeleton[J]. Acta Histochem, 2017, 119(2): 99-112. |
| [31] |
Han X, Liu CF, Gao N, et al. Kaempferol suppresses proliferation but increases apoptosis and autophagy by up-regulating microRNA-340 in human lung cancer cells[J]. Biomed Pharmacother, 2018, 108: 809-816. |
| [32] |
Yang Y, Zhao Y, Ai X, et al. Formononetin suppresses the proliferation of human non-small cell lung cancer through induction of cell cycle arrest and apoptosis[J]. Int J Clin Exp Patho, 2014, 7(12): 8453-8461. |
| [33] |
张莹, 贾英杰, 李小江, 等. 注射用黄芪多糖联合CIK细胞治疗中晚期气虚型非小细胞肺癌的临床观察[J]. 中草药, 2018, 49(7): 1647-1651. |
| [34] |
王永清, 韩媛媛, 韩德兰, 等. 黄芪多糖联合顺铂对Lewis肺癌小鼠的抑瘤作用及其机制[J]. 山东医药, 2017, 57(44): 39-41. |
| [35] |
胡雅彬. N-乙酰半胱氨酸萝卜硫素通过微管断裂抑制自噬导致非小细胞肺癌细胞凋亡[D].北京: 首都医科大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10025-1018857183.htm
|
| [36] |
戴宏宇, 李苏宜, 马国栋, 等. TUBB3和MAPT预测非小细胞肺癌对紫杉类药物敏感性的研究[J]. 临床肿瘤学杂志, 2015, 20(4): 322-326. |
| [37] |
Ye J, Zhang Z, Sun L, et al. miR-186 regulates chemo-sensitivity to paclitaxel via targeting MAPT in non-small cell lung cancer (NSCLC)[J]. Molecular Biosystems, 2016, 12(11): 3417-3424. |
| [38] |
Kaewlert W, Sakonsinsiri C, Namwat N, et al. The importance of CYP19A1 in estrogen receptor-positive cholangiocarcinoma[J]. Horm Cancer-US, 2018, 9(6): 408-419. |
| [39] |
丁小胜, 汤传昊, 王志杰, 等. 雌激素在非小细胞肺癌中的研究进展[J]. 中国肺癌杂志, 2017, 20(7): 499-504. |
| [40] |
Unai A, Sergio C, Eluska I, et al. Estrogen receptor 1 gene expression and its combination with estrogen receptor 2 or aromatase expression predicts survival in non-small cell Lung cancer[J]. PLOS ONE, 2014, 9(10): e109659.. |
| [41] |
Ikeda K, Shiraishi K, Eguchi A, et al. Association of a genetic variant of CYP19A1 with multicentric development of lung adenocarcinomas[J]. Annals of Surgical Oncology, 2014, 21(3): 939-945. |
| [42] |
赵谊宁, 陶陶, 张力杰, 等. 雌激素受体ERα及ERβ与肿瘤关系的研究进展[J]. 东南大学学报(医学版), 2016, 35(3): 418-422. |
| [43] |
姜雨飞, 王世鄂. 雌激素受体ERα与PI3K/Akt细胞信号通路[J]. 解剖学研究, 2012, 34(2): 142-145. |
| [44] |
胡志英, 朱新江, 陈舒晨, 等. 非小细胞肺癌PI3K/AKT/MTOR信号通路的研究现状与进展[J]. 癌症进展, 2018, 16(6): 671-674. |
| [45] |
王海波, 陈鹊汀, 李鹤飞, 等. 当归补血汤对中晚期肺癌化疗后免疫功能的影响[J]. 中医学报, 2014, 29(11): 1553-1554. |
| [46] |
Leem D, Shin J, Kim K, et al. Dammarane-type triterpene ginsenoside-Rg18 inhibits human non-small cell lung cancer A549 cell proliferation via G1 phase arrest[J]. Oncology Letters, 2018, 15(4): 6043-6049. |
| [47] |
周婷婷, 茆俊卿, 张传名, 等. 扶正抗癌方对Lewis肺癌荷瘤小鼠肺癌基因Bcl-2、抑癌基因Bax及血管内皮生长因子、表皮生长因子受体、金属蛋白酶表达的影响[J]. 世界中医药, 2019, 14(1): 77-80. |
 2019, Vol. 36
2019, Vol. 36