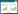文章信息
- 汪作元, 李敏, 杨静, 柴欣, 王跃飞
- WANG Zuoyuan, LI Min, YANG Jing, CHAI Xin, WANG Yuefei
- 小茴香中反式茴香脑的含量测定及其变化规律研究
- Determination of the trans-anethole content in fructus foeniculi and its variation rule
- 天津中医药, 2019, 36(10): 1021-1024
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(10): 1021-1024
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.10.20
-
文章历史
- 收稿日期: 2019-05-29
小茴香为伞形科植物茴香(Foeniculum vulgare Mill.)的干燥成熟果实,又名怀香、怀香子、茴香子,具有温肾暖肝、散寒止痛、理气和胃之功效[1]。小茴香常被用作调味品和香料,小茴香主要含有挥发油、脂肪油、甾醇、糖苷、氨基酸等多种成分[2],挥发油是小茴香的主要药效成分[3],现已从小茴香挥发油中分离出40种化合物,具有抗炎镇痛、抑菌、抗氧化等作用[4-5]。研究表明挥发油中主要成分为反式茴香脑,占挥发油含量的80%左右[6],分布在叶、花、果实中,以果实中挥发油及反式茴香脑含量最高。反式茴香脑作为升白宁注射液的主要成分,对预防和治疗白细胞减少症具有良好的效果[7]。
小茴香中反式茴香脑易挥发,文献报道多采用GC[8-10]、GC-MS联用仪[11]等方法进行测定。反式茴香脑具有共轭结构,紫外吸收较好;液相色谱仪普及性高且操作便利性好。本研究建立了超高效液相色谱法(UPLC)测定小茴香中反式茴香脑含量的方法,并分析了小茴香及其盐制品中反式茴香脑的含量差异;研究了室温条件下小茴香药材(生品)及其粉末中反式茴香脑随放置不同时间的含量变化规律。
1 仪器与材料 1.1 仪器Waters ACQUITYTM UPLC超高效液相色谱仪(美国Waters公司);DL-180E超声仪(50 kHz,180 W);XS 205十万分之一电子分析天平(瑞士Mettler-Toledo公司);AL 204型电子天平(瑞士Mettler-Toledo公司);Milli-Q超纯水仪(美国Millipore公司);TGL-16C台式离心机(上海安亭科学仪器厂)。
1.2 材料小茴香药材(生品)(S1~S7),产地为内蒙古;其中药材S1~S4购自河北春开制药股份有限公司;药材S5~S7购自天津中药饮片有限公司。盐小茴香饮片(Y1~Y4)是作者参照盐制法炮制工艺炮制;盐小茴香饮片(Y5~Y7),产地为内蒙古,购自天津中药饮片有限公司;反式茴香脑(批号:18041304)购自成都普菲德生物技术有限公司;甲醇(色谱纯,赛默飞世尔科技有限公司);甲酸(色谱纯,阿拉丁);屈臣氏蒸馏水(广州屈臣氏食品饮料有限公司);无水乙醇(分析纯,天津市康科德科技有限公司)。
2 方法与结果 2.1 小茴香药材(生品)及粉末稳定性研究取小茴香药材(生品)(S1)适量,等量分装于9个密封袋中,分别于1、2、3、4、5、10、20、31、44 d取样。
取小茴香药材(生品)(S1)适量,粉碎,粉末(过三号筛)等量分装于9个密封袋中,分别于1、2、3、4、5、10、20、31、44 d取样。
取小茴香药材(生品)(S1)适量,粉碎,粉末(过三号筛)置于同一密封袋中,分别于0、1、2、3、4、6、8、10、12 h取样。
2.2 盐小茴香饮片的炮制小茴香药材(生品)200 g,精密称定,置于炒药锅内,将小茴香翻炒均匀,炒至微显火色,喷淋25%盐水溶液(每100 kg小茴香用食盐2 kg),继续炒至微干,炒制15 min(功率1 300 W),取出,放凉。
2.3 对照品溶液的配制取反式茴香脑对照品适量,精密称定,置10 mL容量瓶中,加甲醇配制成0.94 mg/mL的储备液,取适量储备液配制成18.8 μg/mL的对照品溶液。
2.4 供试品溶液的制备取小茴香,粉碎,取粉末(过三号筛)0.5 g,精密称定,置25 mL量瓶中,加入适量无水乙醇,密塞,室温下超声处理(功率144 W,频率40 kHz)10 min,放冷至室温,定容至刻度,摇匀,4 ℃下14 000 r/min离心10 min,取上清液1 mL,置10 mL量瓶中,用无水乙醇定容至刻度,即得。
2.5 色谱条件色谱柱:Acquity UPLC®誖BEH C18(2.1 mm×50 mm,1.7 μm);流动相:甲醇-0.1%甲酸水(55:45),流速0.3 mL/min;检测波长254 nm;进样量2 μL;柱温40 ℃;样品箱温度5 ℃。
2.6 方法学考察 2.6.1 线性关系考察取适量反式茴香脑储备液配制成浓度为2.35 ~ 150.40 μg/mL的系列对照品溶液,按“2.5”项下色谱条件测定,平行进样2次,以对照品浓度X(μg/mL)为横坐标,峰面积Y为纵坐标,绘制标准曲线,计算线性回归方程,反式茴香脑线性回归方程为Ŷ=61 069X-12 840,相关系数r=0.999 9,表明反式茴香脑在2.35 ~ 150.40 μg/mL范围内线性关系良好。
2.6.2 精密度实验精密称取小茴香药材(生品)粉末(现粉),按“2.4”项下方法每天制备1份小茴香供试品溶液,按“2.5”项下色谱条件重复进样6次,连续测定3 d,记录峰面积,计算其RSD值,日内精密度RSD值为0.40%,日间精密度RSD值为1.11%,结果表明仪器精密度良好。
2.6.3 重复性实验精密称取小茴香药材(生品)粉末(现粉)6份,按“2.4”项下方法制备小茴香供试品溶液6份,按“2.5”项下色谱条件进样测定,记录峰面积,计算反式茴香脑平均含量为10.17 mg/g;RSD值为0.50%,表明该方法重现性良好。
2.6.4 稳定性实验精密称取小茴香药材(生品)粉末(现粉),按“2.4”项下方法制备小茴香供试品溶液,按“2.5”项下色谱条件分别于0.5、1、1.5、2、2.5、3、3.5、4、4.5、5 h进样测定,记录峰面积,计算反式茴香脑的稳定性RSD值为0.33%,表明供试品溶液室温放置5 h稳定性良好。
2.6.5 加样回收率实验精密称取已知含量的小茴香药材(生品)粉末(现粉)0.25 g,准确加入与样品中反式茴香脑质量相当的对照品溶液,按“2.4”项下方法制备小茴香供试品溶液,平行6份,按“2.5”项下色谱条件进样测定2次,反式茴香脑的平均加样回收率为102%,RSD=2.23%(n=6)。结果见表 1,表明反式茴香脑加样回收率良好,方法准确可行。
|
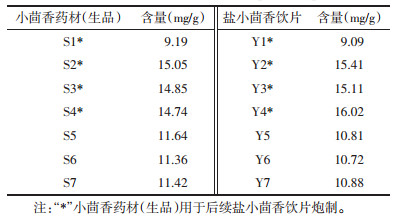
采用已建立的UPLC分析方法测定不同批次小茴香药材(生品)、盐小茴香饮片。精密称取不同批次的小茴香粉末(现粉),按“2.4”项下方法制备小茴香供试品溶液2份,按“2.5”项下色谱条件每份供试品溶液进样测定2次,计算不同批次小茴香粉末中反式茴香脑的含量,小茴香中反式茴香脑UPLC色谱图见图 1,结果见表 2。7批小茴香药材(生品)中反式茴香脑的含量为9.19~15.05 mg/g,2015年版《中华人民共和国药典》规定小茴香药材含反式茴香脑不得少于1.4%,小茴香药材(生品)(S1、S5~S7)不符合中国药典的规定,合格率低于50%;7批盐小茴香饮片中反式茴香脑的含量为9.09~16.02 mg/g,2015年版《中华人民共和国药典》规定盐小茴香饮片含反式茴香脑不得少于1.3%,盐小茴香饮片(Y1、Y5~Y7)不符合中国药典的规定,合格率低于50%。通过分析4批样品炮制前后反式茴香脑的含量变化,盐制后小茴香中反式茴香脑略有变化。
|
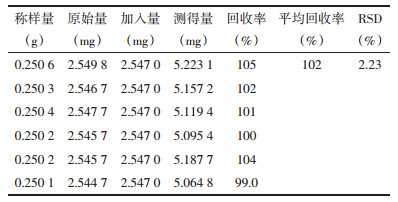
| 图 1 小茴香中反式茴香脑的UPLC色谱图(A、对照品溶液B、供试品溶液) Fig. 1 UPLC chromatogram of trans-anethole in Fructus Foeniculi (A. standard solution B. sample solution) |
|
反式茴香脑具有较强挥发性,其含量随小茴香放置时间延长不断下降[12-13],本研究系统考察了小茴香药材(生品)及其粉末在室温下放置不同时间反式茴香脑的含量变化规律。
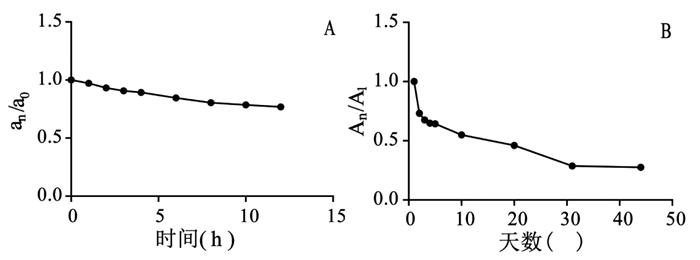
分别于0、1、2、3、4、6、8、10、12 h取小茴香药材(生品)粉末适量,采用UPLC分别测定0 h样品中反式茴香脑含量a0,n小时(n=1、2、3、4、6、8、10、12)样品中反式茴香脑含量an。通过含量测定结果分析表明:小茴香药材(生品)粉碎后12 h内反式茴香脑随放置时间延长含量不断下降,在12 h时,其含量下降了23.23%,实验结果见图 2-A。分别于第1、2、3、4、5、10、20、31、44天从不同密封袋取小茴香药材(生品)粉末适量,现取现测,采用UPLC分别测定了1 d样品中反式茴香脑含量A1,n天(n=2、3、4、5、10、20、31、44)样品中反式茴香脑含量An。通过含量测定结果分析表明:小茴香药材(生品)粉碎后在室温条件下放置44 d内反式茴香脑随放置时间延长含量不断下降,在44 d时,其含量下降了72.48%,实验结果见图 2-B。
|
| 图 2 小茴香药材(生品)粉碎后在室温条件下放置12 h反式茴香脑的含量变化情况(A)、放置44 d反式茴香脑的含量变化情况(B) Fig. 2 The variation of trans-anethole content in Fructus Foeniculi(raw)storaged at room temperature for 12 h(A) and for 44 d(B) after pulverization |
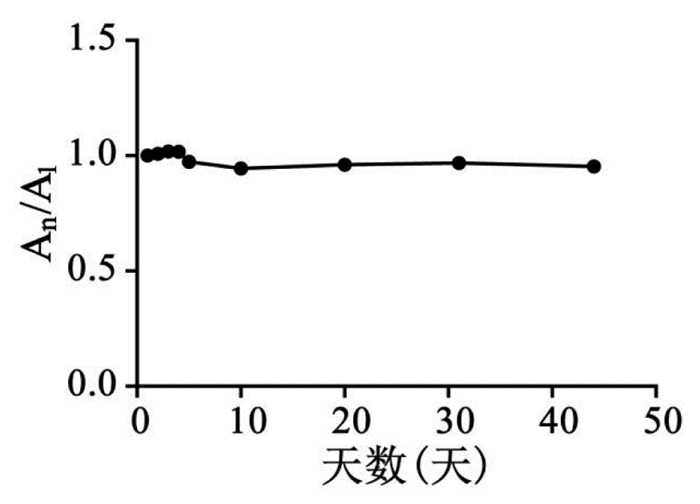
分别于第1、2、3、4、5、10、20、31、44天取小茴香药材(生品)适量,粉碎,现粉现用,采用UPLC分别测定1 d样品中反式茴香脑含量A1,n天(n=2、3、4、5、10、20、31、44)样品中反式茴香脑含量An。通过含量测定结果分析表明:小茴香药材(生品)在室温条件下放置44 d内反式茴香脑的含量基本稳定,其含量无明显变化,RSD值为2.90%,实验结果见图 3。
|
| 图 3 小茴香药材(生品)室温下放置44 d现粉现测反式茴香脑的含量变化情况 Fig. 3 The variation of trans-anethole content in raw Fructus Foeniculi storaged at room temperature for 44 days(immediate detection after pulverization) |
通过系统研究小茴香药材(生品)及其粉末在室温下放置不同时间反式茴香脑的含量变化规律,揭示了小茴香药材(生品)粉末中反式茴香脑含量随放置时间延长不断下降,而小茴香药材(生品)中反式茴香脑含量基本稳定。因此,开展小茴香中反式茴香脑的含量测定时,小茴香必须现粉现测。
3 讨论本实验利用UPLC建立了小茴香中反式茴香脑的含量测定方法,本方法样品前处理简便,分析速度快,紫外吸收好,无其他成分干扰。
本实验从提取溶剂(甲醇、乙醇)、溶剂比例(25%乙醇、50%乙醇、75%乙醇、无水乙醇)、提取温度[(0±5)、(20±5)、(40±5)、(60±5)℃]、提取时间(5、10、15、20 min)、料液比(1:25、1:50、1:100)系统考察影响小茴香中反式茴香脑提取效率的因素,发现提取溶剂为无水乙醇、料液比为1:50、(20±5)℃超声10 min提取效率最高。
通过本实验研究,发现小茴香药材(生品)粉碎后反式茴香脑含量随放置时间延长不断下降,小茴香药材(生品)中反式茴香脑含量在规定放置时间内基本稳定。反式茴香脑为小茴香的指标成分,建议在进行小茴香中反式茴香脑含量测定时,小茴香必须现粉现测,即小茴香粉碎后,其粉末需在半小时内进行处理,保证测定结果的准确可靠。
| [1] |
国家药典委员会.中华人民共和国药典[S].一部.北京: 中国医药科技出版社, 2015: 47-48.
|
| [2] |
董思敏, 张晶. 小茴香化学成分及药理活性研究进展[J]. 中国调味品, 2015, 40(4): 121-124. DOI:10.3969/j.issn.1000-9973.2015.04.029 |
| [3] |
郑甜田, 陶永生, 张敏, 等. 10种产地小茴香果实挥发油成分分析[J]. 昆明医科大学学报, 2017, 38(11): 19-24. DOI:10.3969/j.issn.1003-4706.2017.11.006 |
| [4] |
高莉, 斯拉甫·艾白, 韩阳花. 小茴香挥发油化学成分及抑菌作用的研究[J]. 中国民族医药杂志, 2007, 13(12): 67-68. DOI:10.3969/j.issn.1006-6810.2007.12.041 |
| [5] |
Senatore F, Oliviero F, Scandolera E, et al. Chemical composition, antimicrobial and antioxidant activities of anethole-rich oil from leaves of selected varieties of fennel[J]. Fitoterapia, 2013, 90: 214-219. DOI:10.1016/j.fitote.2013.07.021 |
| [6] |
赵淑平, 丛蒲珠, 权丽辉, 等. 小茴香挥发油的质量研究[J]. 中药材, 1989, 12(9): 31. DOI:10.3321/j.issn:1001-4454.1989.09.002 |
| [7] |
肖春莹, 由东, 王志刚. 用升白宁注射液预防白细胞减少症的效果研究[J]. 当代医药论丛, 2015, 13(12): 147-149. |
| [8] |
郭婷婷, 从仁怀, 寇秀颖, 等. 不同产地小茴香挥发油成分分析及反式茴香脑含量的测定[J]. 中国调味品, 2018, 43(8): 127-130. DOI:10.3969/j.issn.1000-9973.2018.08.030 |
| [9] |
聂凌云, 吴玫涵, 刘云, 等. 毛细管气相色谱法测定小茴香中反式茴香脑的含量[J]. 解放军药学学报, 2002, 18(3): 152-154. DOI:10.3969/j.issn.1008-9926.2002.03.008 |
| [10] |
杨丽萍, 云琦, 高晓黎. 小茴香挥发性成分GC指纹图谱研究[J]. 新疆医科大学学报, 2015, 38(5): 578-580. |
| [11] |
郑甜田, 陶永生, 张敏, 等. 10种产地小茴香果实挥发油成分分析[J]. 昆明医科大学学报, 2017, 38(11): 19-24. DOI:10.3969/j.issn.1003-4706.2017.11.006 |
| [12] |
帕提古丽·马合木提, 高莉, 王强, 等. 时间对小茴香挥发油成分的影响[J]. 食品科学, 2005, 26(11): 190-191. DOI:10.3321/j.issn:1002-6630.2005.11.042 |
| [13] |
Zhang Y, Ji HY, Yu J. Aromatic constituents and their changes of Illicium verum processed by different heating methods[J]. Industrial Crops & Products, 2018, 118: 362-366. |
 2019, Vol. 36
2019, Vol. 36