文章信息
- 秦袖平, 安雅婷
- QIN Xiuping, AN Yating
- 色氨酸-犬尿氨酸代谢通路与神经退行性疾病及中医药干预作用的研究进展
- Research progress of tryptophan-kynurenine metabolic pathways and neurodegenerative diseases with intervention of traditional Chinese medicine
- 天津中医药, 2019, 36(10): 1031-1036
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(10): 1031-1036
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.10.22
-
文章历史
- 收稿日期: 2019-05-12
色氨酸是人体只能通过食物摄取的8种必须氨基酸之一,通过参与蛋白质合成对机体的生长发育和新陈代谢起着重要作用[1]。色氨酸代谢生成了多种生物活性物质,这些物质能发挥不同的生物学效应。如犬尿氨酸、犬尿酸、喹啉酸和吲哚胺-2,3-双加氧酶等[2]。大量的研究[3-4]表明,色氨酸-犬尿氨酸代谢过程中的多种酶或产物与多种中枢神经系统疾病特别是神经退行性疾病有着极其密切的关系。笔者针对这一代谢通路及其重要的生物活性物质与中枢神经系统疾病的关联及近年以此为靶点的中医药干预做一综述。
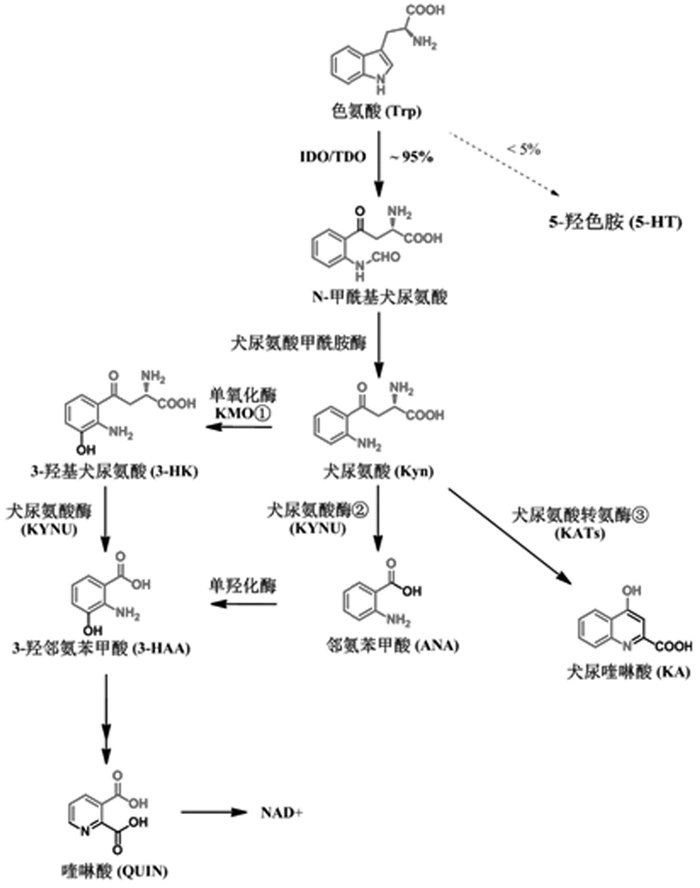
1 色氨酸-犬尿氨酸代谢通路(Tryptophan-kynurenine pathway)色氨酸在机体代谢的部位主要是肝脏,其次是脑、肾、脾、骨骼肌等组织器官,生成了多种生物活性物质。色氨酸在体内有两条分解代谢途径(见图 1),其中只有少部分沿5-羟色胺(5-HT)代谢,而犬尿氨酸通路(KP)是色氨酸代谢的主要途径(大于95%)。犬尿氨酸及其代谢中间体的堆积表现出不同的生物学作用,包括神经活性和神经毒性。早于1981年研究者便注意到这一通路的代谢产物喹啉酸对中枢神经系统N-甲基-D-天冬氨酸(NMDA)的激动作用,随后发现犬尿酸可对抗性作用于谷氨酰胺受体[2-3]。犬尿氨酸通路最终生成烟碱胺和重要的烟酰胺腺嘌呤二核苷酸酶辅助因子(NAD+),NAD+在很多基础生物学过程中起到重要作用。不过也有研究认为犬尿氨酸通路是神经退行性疾病和严重大脑损伤中神经元受损的重要途径[5]。
|
| 图 1 色氨酸-犬尿氨酸代谢通路 Fig. 1 Tryptophan-kynurenine metabolic pathways |
犬尿氨酸通路的起始步骤是由两种酶将色氨酸转化为N-甲酰基-犬尿氨酸,这两种酶分别是吲哚胺-2,3-双加氧酶(IDO-1,IDO-2)和色氨酸-2,3-双加氧酶(TDO)[6];N-甲酰基-犬尿氨酸不稳定,随即由犬尿氨酸甲酰胺酶转化为犬尿氨酸。犬尿氨酸是这一通路的中心。首先,犬尿氨酸在犬尿氨酸-3-单氧化酶(KMO)作用下完成羟基化生成3-羟基-犬尿氨酸(3-HK)[7];在犬尿氨酸酶的催化下生成邻氨苯甲酸(ANA);在犬尿氨酸转氨酶家族的催化下生成终产物犬尿喹啉酸,也称犬尿酸[8]。随后,无论是3-HK还是ANA都转化生成3-羟邻氨苯甲酸(3-HAA),继而转化为2-氨基-3-羰基粘康酸半醛(ACMS),进一步代谢成喹啉酸(QUIN),而由喹啉酸生成的烟碱胺经了转氨基作用最终生成NAD+/NADP+。在这里,所有的代谢产物又被统称为犬尿氨酸能物质。
2 KP代谢产物及相关酶在中枢神经系统中的生物学作用 2.1 犬尿氨酸(KYN)犬尿氨酸通路是色氨酸代谢的主要途径,由这一通路生成的一系列生物活性物质在中枢神经系统发挥重要功能。犬尿氨酸因它在KP的核心地位而受到研究者越来越多的关注。事实上,犬尿氨酸水平以及犬尿氨酸与色氨酸的比值通常作为神经中枢疾病病理改变的一个重要指标[9]。正常生理状态下,肝内TDO作为KYN代谢的首个限速酶,决定着机体色氨酸和KYN的水平,但是在炎症或应激状态下(如IFN-γ或其他免疫刺激),IDO则成为KYN代谢的限速酶[10]。哺乳动物脑内KYN来源由两部分构成,其中约40% KYN通过脑内KP代谢途径自行合成,另外约60%的KYN则来自外周,借助神经氨基酸转运体携入脑内[10]。有研究表明犬尿氨酸可以作为潜在的内源性抗氧化剂,保护大分子物质避免氧化修饰。不过也有报道称犬尿氨酸可表现出诱导氧化的作用。
2.2 犬尿酸(KA)犬尿酸(KA)在哺乳动物中以纳摩浓度级别存在,是3种内源性谷氨酸盐受体的拮抗剂,即AMDA、NMDA和红藻氨酸受体,而犬尿酸最强的抑制效应源于它对NMDA受体上甘氨酸结合位点的作用[11]。有研究认为犬尿酸具有神经保护作用,可对抗喹啉酸过度兴奋NMDA受体引发的神经毒性[12]。除了对NMDA受体有拮抗作用外,犬尿酸还能够非竞争性拮抗α7-烟碱乙酰胆碱受体(α7-nAChR),降低神经细胞外谷氨酸(Glu)和多巴胺(DA)的水平[13]。
2.3 喹啉酸(QUIN)喹啉酸(QUIN)是NMDA受体的竞争性激动剂,特别是对包含NR2A和NR2B的NMDA受体亚型,因此喹啉酸对于有这些亚型的受体表现出较强的损伤。一方面,QUIN促进神经元对谷氨酸的释放;另一方面抑制胶质细胞对谷氨酸的摄取,增强突触的利用,从而过度激活NMDA受体,进一步导致细胞钙离子内流增加过氧硝酸盐水平损伤神经细胞[14]。另外,喹啉酸或喹啉酸激活的NMDA受体可产生活性氧或代谢损伤而影响神经元功能。QUIN/KA值常作为谷氨酸受体激活程度和神经毒性的指标[15]。此外,喹啉酸也可以作为神经系统局部炎症的促发者,增加例如单核细胞趋化蛋白-1(MCP-1)和RANTES类的化学趋化因子的表达和释放,促使神经元和星形胶质细胞凋亡,破坏血脑屏障(BBB)[16]。
2.4 3-羟基犬尿氨酸(3-HK)3-HK是具有神经毒性的犬尿氨酸通路代谢产物之一,较强的亲脂性使其很容易透过血脑屏障,最终在大脑中枢积聚。大量的研究表明3-HK和3-羟邻氨苯甲酸(3-HAA)会产生大量自由基引起氧化应激和脂质过氧化,这可能与抑制电子传递链复合物损伤线粒体功能有关。而氧化应激和线粒体损伤参与一系列中枢神经系统疾病的病理过程[17]。另外,在组织损伤或炎症环境下,犬尿氨酸单氧化酶(KMO)和3-HK的水平急剧升高,由KYN-KMO代谢分支生成的喹啉酸也将增多,从而进一步加重了神经毒性反应。
2.5 吲哚胺-2,3-双加氧酶(IDO)犬尿氨酸代谢的主要限速酶是IDO和TDO,其中IDO有两种亚型,分别是IDO-1和IDO-2。TDO主要是在肝脏中表达,底物水平和皮质醇含量会使TDO的表达升高,而炎症因子的刺激则会增加IDO表达[18]。IDO在其他器官如肝、肾、脑等均有一定分布,另外IDO主要在单核细胞和树枝状细胞等免疫细胞中表达[19]。事实上,IDO被认为是炎症或应激状态下犬尿氨酸类物质生成的主要催化酶,IDO的表达最先由干扰素(IFNs)介导,特别是IFN-γ[20]。此外,IDO表达也可以被其他几种促炎因子激活。总之,炎症介质或应激过程能够极大地促进IDO的表达,加速犬尿氨酸通路的代谢。
2.6 犬尿氨酸-3-单氧化酶(KMO)KMO是犬尿氨酸通路中的另一个关键代谢酶,作用于犬尿氨酸通路下游分支。KMO位于线粒体外膜且在多种外周组织中表达,包括肝脏、肾脏以及吞噬细胞如巨噬细胞和单核细胞等。在神经系统中,KMO主要分布在小神经胶质细胞[21]。与IDO类似的是,KMO也可由炎症介质诱导表达。LPS、IL-1β可上调KMO表达,而KMO抑制剂Ro 61-8048共处理可以使IL-1β的不利作用反转[22]。在炎症介质刺激下,KMO可能会通过升高神经系统3-HK和QUIN浓度产生神经毒性。Zwilling等[23]给予小鼠KMO抑制剂后,KA水平明显升高,相应地,QUIN和3-HK的含量降低,同时很大程度地改善了阿尔茨海默症(AD)和亨廷顿病(HD)引起的认知损伤,而Campesan等[24]在果蝇HD模型上也证实了这一点,甚至认为可以通过给药一定剂量的KA实现神经保护作用。
3 犬尿氨酸能物质在中枢神经系统疾病中的意义KP与神经、免疫及内分泌系统关系密切,该途径中的代谢产物(或酶系)在中枢神经系统疾病的发生、发展过程中发挥不同的生物学作用。
3.1 帕金森氏病帕金森氏病(PD)是继AD之后全球第二大神经退行性疾病,其主要病理学改变是中脑黑质致密部DA能神经元变性死亡以及残存神经元胞质中出现路易小体。内源性兴奋毒性介质与帕金森氏病黑质多巴胺能神经元的退化密切相关。帕金森氏症患者的额叶皮质、壳核和黑质致密部位3-羟基犬尿氨酸明显增多,而KA浓度是降低的[25]。有研究发现,给于帕金森病动物模型MPTP后,KATⅠ的表达水平下降[26]。类似的,在用MPP+(MPTP的有毒代谢物)处理的皮质切片中也出现了KATⅡ活性降低的现象[27]。因此,有学者认为调节KP通路转向生成KA是一个潜在治疗帕金森病的有效方案[28]。同时多项研究表明NMDA受体拮抗剂在帕金森病动物及体外模型中表现出神经保护功能。
研发透过血脑屏障的KMO抑制剂是一种新的策略用来减轻犬尿氨酸通路激活引发的神经毒性。此外,侧脑室注射烟碱丙氨酸伴随全身给药犬尿氨酸和丙磺舒提高了脑内KYNA水平,同时降低由喹啉酸导致的小鼠黑质体毒性[29]。联合给药犬尿氨酸和丙磺舒可以阻止纹状体内多巴胺水平下降和神经性退行性变[30]。
3.2 阿尔茨海默症阿尔茨海默病(AD)也称老年性痴呆,是一种起病隐匿、呈渐进发展的神经系统退行性疾病,脑实质中老年斑及小动脉血管内β淀粉样蛋白(Aβ)大量沉积是AD致病的关键因素[31]。近年来越来越多的研究显示,阿尔茨海默症动物模型血清KYN、3-HK浓度明显上升,同时Trp、KA浓度呈现下降趋势,而这种变化与认知功能的损伤密切相关[32]。在人的巨噬细胞和小胶质细胞,Aβ和KA共同促进喹啉酸的生成,这可能是导致阿尔茨海默症氧化过程的原因。相似地,Aβ1-42可诱导IDO mRNA的表达增加,进而通过3-HK和3-HAA引发的氧化应激参与神经退行性疾病过程。最近的研究表明TDO介导的犬尿氨酸通路激活导致神经元纤维缠结,与老年斑的形成有关。另外,尸检发现TDO、喹啉酸与神经元纤维缠结以及淀粉样蛋白在阿尔茨海默病患者的海马区同时出现。作为潜在的治疗靶点,实验大鼠长期给予一种KMO小分子抑制剂JM6会降低细胞外谷氨酸浓度,升高大脑和血清中KA的水平,在阿尔茨海默症模型中可以改善小鼠空间学习记忆能力、焦虑样表现和突触缺失,不过对于β淀粉样蛋白的蓄积并没有影响[33]。
3.3 亨廷顿病KP代谢产物被认为与亨廷顿病的病理进程有关。研究发现[34],不论亨廷顿患者还是转基因鼠新纹状体和皮质均出现QUIN、3-HK浓度升高的趋势。在果蝇模型中,抑制TDO或KMO基因会导致3-HK水平降低以及使KP向合成KA方向进行,这表现出一定的神经保护作用。有文献报道[35]多种KMO抑制剂包括JM6和Ro61-8048可以延缓神经元退化,JM6可减少亨廷顿病鼠模型突触的缺失,维持突触活性和降低神经炎症反应。
4 以色氨酸-犬尿氨酸代谢通路为靶点的中医药干预传统中药在中国预防和治疗疾病已经有几千年历史,而今越来越多的研究报道表明,以色氨酸-犬尿氨酸代谢通路为靶点的中医药干预疗效显著。
人参药材作为一种有效的中枢神经系统疾病传统治疗药物已经被越来越多的研究所证实,人参皂苷是其主要有效成分。Kang[36]以200 mg/kg剂量的人参总皂苷干预LPS诱导的抑郁症动物模型,结果发现人参总皂苷可以明显减轻抑郁行为,使其在蔗糖水偏好实验、悬尾实验和强迫游泳实验中的表现更好。进一步研究显示,人参总皂苷能显著降低LPS介导的神经炎症因子IL-1β、IL-6水平和IDO酶的表达,从而使犬尿氨酸/色氨酸(KYN/Trp)转化率下降,减少毒代谢产物喹啉酸的含量[37]。红花是常用的活血化瘀中药,具有活血通经,散瘀止痛的功效。有研究显示[38]其在抑郁症的治疗中疗效突出。Kuehnl[39]利用体外细胞实验考察了红花中木质素类成分对色氨酸转化程度的影响。结果表明木质素能够显著抑制IDO酶活性,并且在一定范围内呈剂量依赖性。这大大减少了Trp沿着KP方向的转化。
由黄连、黄芩、黄柏和栀子组成的黄连解毒汤能够改善阿尔茨海默症模型动物的学习记忆能力[40],体外实验证明,黄连解毒汤的君药黄连有很强的IDO-1酶抑制活性,是IDO的非竞争性抑制剂。这种酶抑制作用在很大程度上能够减少淀粉样斑块形成和神经元缺失,最终可缓解由阿尔茨海默病引起的认知功能损伤,并将很可能成为良好的退行性疾病候选药物[41]。逍遥散由柴胡、当归、白芍、茯苓、白术、甘草组成,是临床常用经典方剂,具有疏肝解郁、健脾和营、养血调经的功效。彭希、徐志伟[42-43]等观察到逍遥散水煎液对抑郁模型动物有较好的缓解作用,认为是通过增加脑内5-HT含量达到抗抑郁疗效的。这与Jiao等[44]的研究结果相一致。Jiao等认为慢性束缚应激抑郁症与大脑海马区色氨酸的代谢紊乱密切相关,其中色氨酸羟化酶(TPH2)和IDO1活性强弱是色氨酸代谢平衡的关键。持续慢性束缚应激不仅通过抑制TPH2酶活性减少5-HT的合成,还可以增加KP中IDO1的表达使神经毒性物质犬尿氨酸和喹啉酸的含量增加,二者共同作用下出现了精神抑郁的病症。而逍遥散则能够通过调节色氨酸代谢的关键酶和活性物质含量使抑郁状态得到很好的缓解,认为经典方剂逍遥散在治疗神经精神疾患方面有着广阔的临床应用前景。
此外,文献报道经典方药四逆散[45]和天丝饮[46]也可以阻断炎症因子诱导的IDO活化,抑制IDO的活性和表达,进而通过调节色氨酸-犬尿氨酸代谢环节发挥抗抑郁的作用。
5 结语综上,犬尿氨酸代谢产物和酶参与多种中枢神经系统疾病的生理病理过程,与其发生、发展密切相关。由于各自生理特点不同,如QUIN具有兴奋性毒性,KA具有神经保护作用等,单独或共同参与诸如兴奋性毒性、神经炎症、氧化应激、线粒体损伤等病理过程,尽管其具体作用机制目前尚未完全清楚。不过调控KP代谢平衡的关键酶如IDO,KMO应该引起相应的重视,选用这些酶的激动剂或拮抗剂改变酶活性以干预其酶促反应过程,这或许有可能为相应的神经疾病提供有效的治疗策略,也为中医药新药研发提供理论指导和实验依据。
| [1] |
李小兰, 江敏, 阮征, 等. 色氨酸及其代谢产物5-HT对肠道功能的作用综述[J]. 食品安全质量检测学报, 2014, 5(4): 1997-2002. |
| [2] |
李宁宁, 高平进. 犬尿氨酸代谢通路与中枢神经系统[J]. 国际脑血管病杂志, 2008, 16(5): 388-392. DOI:10.3760/cma.j.issn.1673-4165.2008.05.015 |
| [3] |
Aeinehband S, Brenner P, Stahl S, et al. Cerebrospinal fluid kynurenines in multiple sclerosis; relation to disease course and neurocognitive symptoms[J]. Brain Behav. Immun, 2015, 51(1): 31-35. |
| [4] |
Ribeiro-Santos A, Lucio Teixeira A, Salgado J V. Evidence for an immune role on cognition in schizophrenia:a systematic review[J]. Curr. Neuropharmacol, 2014, 12(3): 273-280. DOI:10.2174/1570159X1203140511160832 |
| [5] |
Schwarcz R, Bruno JP, Muchowski PJ, et al. Kynurenines in the mammalian brain:when physiology meets pathology[J]. Nat. Rev. Neurosci, 2012, 13: 465-477. DOI:10.1038/nrn3257 |
| [6] |
Shimizu T, Nomiyama S, Hirata F, et al. Indoleamine 2, 3-dioxygenase. Purification and some properties[J]. J. Biol. Chem, 1978, 253: 4700-4706. |
| [7] |
Guillemin GJ, Smith DG, Smythe GA, et al. Expression of the kynurenine pathway enzymes in human microglia and macrophages[J]. Adv. Exp. Med. Biol, 2003, 527: 105-112. |
| [8] |
Guillemin GJ, Smith DG, Kerr SJ, et al. Characterisation of kynurenine pathway metabolism in human astrocytes and implications in neuropathogenesis[J]. Redox Rep, 2000, 5: 108-111. DOI:10.1179/135100000101535375 |
| [9] |
Fujigaki H, Yamamoto Y, Saito K. L-Tryptophan-kynurenine pathway enzymes are therapeutic target for neuropsychiatric diseases:Focus on cell type differences[J]. Neuropharmacology, 2017, 112: 264-274. DOI:10.1016/j.neuropharm.2016.01.011 |
| [10] |
王道涵, 王素梅, 卫利, 等. 犬尿酸代谢途径异常与中枢神经系统疾病[J]. 生理科学进展, 2016, 47(1): 43-46. |
| [11] |
Kessler M, Terramani T, Lynch G, et al. A glycine site associated with N-methyl-D-aspartic acid receptors:Characterization and identification of a new class of antagonists[J]. J. Neurochem, 1989, 52: 1319-1328. DOI:10.1111/j.1471-4159.1989.tb01881.x |
| [12] |
Stone, T W. Neuropharmacology of quinolinic and kynurenic acids[J]. Pharmacol. Rev, 1993, 45: 309-379. |
| [13] |
Hilmas C, Pereira EF, Alkondon M, et al. The brain metabolite kynurenic acid inhibits alpha7 nicotinic receptor activity and increases non-alpha7 nicotinic receptor expression:physiopathological implications[J]. J. Neurosci, 2001, 21: 7463-7473. DOI:10.1523/JNEUROSCI.21-19-07463.2001 |
| [14] |
Santiago-López D, Vázquez-Román B, Pérez-de La Cruz V, et al. Peroxynitrite decomposition catalyst, iron metalloporphyrin, reduces quinolinate-induced neurotoxicity in rats[J]. Synapse, 2004, 54: 233-238. DOI:10.1002/syn.20084 |
| [15] |
Saito K, Crowley JS, Markey SP, et al. A mechanism for increased quinolinic acid formation following acute systemic immune stimulation[J]. J. Biol. Chem, 1993, 268: 15496-15503. |
| [16] |
Braidy N, Grant R, Brew BJ, et al. Effects of kynurenine pathway metabolites on intracellular NAD synthesis and cell death in human primary astrocytes and neurons[J]. Int. J. Tryptophan Res, 2009, 2: 61-66. |
| [17] |
Federico A, Cardaioli E, Da Pozzo P, et al. Mitochondria, oxidative stress and neurodegeneration[J]. J. Neurol. Sci, 2012, 322: 254-262. DOI:10.1016/j.jns.2012.05.030 |
| [18] |
Salter M, Pogson CI. The role of tryptophan 2, 3-dioxygenase in the hormonal control of tryptophan metabolism in isolated rat liver cells. Effects of glucocorticoids and experimental diabetes[J]. Biochem. J., 1985, 229: 499-504. DOI:10.1042/bj2290499 |
| [19] |
Murakami Y, Saito K. Species and cell types difference in tryptophan metabolism[J]. Int. J. Tryptophan Res., 2013, 6: 47-54. |
| [20] |
Connor TJ, Starr N, O'Sullivan JB, et al. Induction of indolamine 2, 3-dioxygenase and kynurenine 3-monooxygenase in rat brain following a systemic inflammatory challenge:A role for IFN-gamma[J]. Neurosci., Lett, 20008, 441: 29-34. |
| [21] |
Heyes MP, Saito K, Crowley JS, et al. Quinolinic acid and kynurenine pathway metabolism in inflammatory and non-inflammatory neurological disease[J]. Brain, 1992, 115(Pt 5): 1249-1273. |
| [22] |
Zunszain PA, Anacker C, Cattaneo A, et al. Interleukin-1beta:A new regulator of the kynurenine pathway affecting human hippocampal neurogenesis[J]. Neuropsychopharmacology, 2012, 37: 939-949. DOI:10.1038/npp.2011.277 |
| [23] |
Zwilling D, Huang SY, Sathyasaikumar KV, et al. Kynurenine 3-monooxygenase inhibition in blood ameliorates neurodegeneration[J]. Cell, 2011, 145: 863-874. DOI:10.1016/j.cell.2011.05.020 |
| [24] |
Campesan S, Green EW, Breda C, et al. The kynurenine pathway modulates neurodegeneration in a Drosophila model of Huntington's disease[J]. Curr. Biol, 2011, 21(11): 961-966. DOI:10.1016/j.cub.2011.04.028 |
| [25] |
Ogawa T, Matson WR, Beal MF, et al. Kynurenine pathway abnormalities in Parkinson's disease[J]. Neurology, 1992, 42: 1702-1706. DOI:10.1212/WNL.42.9.1702 |
| [26] |
Knyihar-Csillik E, Csillik B, Pakaski M, et al. Decreased expression of kynurenine aminotransferase-I (KAT-I) in the substantia nigra of mice after 1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine (MPTP) treatment[J]. Neuroscience, 2004, 126: 899-914. DOI:10.1016/j.neuroscience.2004.04.043 |
| [27] |
Luchowski P, Luchowska E, Turski WA, et al. 1-Methyl-4-phenylpyridinium and 3-nitropropionic acid diminish cortical synthesis of kynurenic acid via interference with kynurenine aminotransferases in rats[J]. Neurosci. Lett., 2002, 330: 49-52. DOI:10.1016/S0304-3940(02)00735-8 |
| [28] |
Zadori D, Klivenyi P, Plangar I, et al. Endogenous neuroprotection in chronic neurodegenerative disorders:with particular regard to the kynurenines[J]. J. Cell. Mol. Med., 2011, 15: 701-717. DOI:10.1111/j.1582-4934.2010.01237.x |
| [29] |
Miranda AF, Boegman RJ, Beninger RJ, et al. Protection against quinolinic acid-mediated excitotoxicity in nigrostriatal dopaminergic neurons by endogenous kynurenic acid[J]. Neuroscience, 1997, 78: 967-975. DOI:10.1016/S0306-4522(96)00655-0 |
| [30] |
Silva-Adaya D, Perez-De La Cruz V, Villeda-Hernandez J, et al. Perez-De La Cruz V, Villeda-Hernandez J, et al. Protective effect of L-kynurenine and probenecid on 6-hydroxydopamine-induced striatal toxicity in rats:implications of modulating kynurenate as a protective strategy. Neurotoxicol[J]. Teratol, 2011, 33: 303-312. |
| [31] |
Majláth Z, Toldi J, Vécsei L. The potential role of kynurenines in Alzheimer's disease:Pathomechanism and therapeutic possibilities by influencing the glutamate receptors[J]. J. Neural. Transm, 2014, 121: 881-889. DOI:10.1007/s00702-013-1135-5 |
| [32] |
Ting KK, Brew B, Guillemin G. The involvement of astrocytes and kynurenine pathway in Alzheimer's disease[J]. Neurotox. Res., 2007, 12: 247-262. DOI:10.1007/BF03033908 |
| [33] |
Zwilling D, Huang SY, Sathyasaikumar KV, et al. Kynurenine 3-monooxygenase inhibition in blood ameliorates neurodegeneration[J]. Cell, 2011, 145: 863-874. DOI:10.1016/j.cell.2011.05.020 |
| [34] |
Guidetti P, Luthi-Carter RE, Augood SJ, et al. Neostriatal and cortical quinolinate levels are increased in early grade Huntington's disease[J]. Neurobiol. Dis., 2004, 17: 455-461. DOI:10.1016/j.nbd.2004.07.006 |
| [35] |
Tan L, Yu JT, Tan L. The kynurenine pathway in neurodegenerative diseases:mechanistic and therapeutic considerations[J]. J. Neurol. Sci., 2012, 323: 1-8. DOI:10.1016/j.jns.2012.08.005 |
| [36] |
Kang A, Hao H, Zheng X, et al. Peripheral anti-inflammatory effects explain the ginsenosides paradox between poor brain distribution and anti-depression efficacy[J]. J Neuroinflammation, 2011, 8: 100-123. DOI:10.1186/1742-2094-8-100 |
| [37] |
Miller AH:Norman Cousins Lecture. Mechanisms of cytokine-induced behavioral changes:psychoneuroimmunology at the translational interface[J]. Brain Behav Immun, 2009, 23(2): 149-158. DOI:10.1016/j.bbi.2008.08.006 |
| [38] |
Zhao G, Gai Y, Chu WJ, et al. A novel compound N(1) N(5)-(Z)-N(10)-(E)-tri-pcoumaroylspermidine isolated from Carthamus tinctorius L. and acting by serotonin transporter inhibition[J]. Eur. Neuropsychopharmacol, 2009, 19: 749-758. DOI:10.1016/j.euroneuro.2009.06.009 |
| [39] |
Kuehnl S, Schroecksnadel S, Temml V, et al. Lignans from Carthamus tinctorius suppress tryptophan breakdown via indoleamine 2, 3-dioxygenase[J]. Phytomedicine, 2013, 20(13): 1190-1195. DOI:10.1016/j.phymed.2013.06.006 |
| [40] |
Yu CJ, Zheng MF, Kuang CX, et al. Oren-gedoku-to and its constituents with therapeutic potential in Alzheimer's disease inhibit indoleamine 2, 3-dioxygenase activity in vitro[J]. J Alzheimers Dis, 2010, 22(1): 257-266. DOI:10.3233/JAD-2010-100684 |
| [41] |
Yu D, Tao BB, Yang YY, et al. The IDO inhibitor coptisine ameliorates cognitive impairment in a mouse model of Alzheimer's disease[J]. J Alzheimers Dis., 2015, 43(1): 291-302. |
| [42] |
彭希, 曾南, 龚锡萍, 等. 逍遥散抗抑郁作用的BDNF/CREB信号机制[J]. 中药药理与临床, 2012, 28(3): 9-11. |
| [43] |
徐志伟, 吴丽丽, 严灿, 等. 逍遥散和丹栀逍遥散抗抑郁作用的实验研究[J]. 中医药学报, 2003, 31(3): 16-17. DOI:10.3969/j.issn.1002-2392.2003.03.010 |
| [44] |
Haiyan Jiao, Zhiyi Yan, Qingyu Ma, et al. In?uence of Xiaoyaosan on depressive-like behaviors in chronic stress-depressed rats through regulating tryptophan metabolism in hippocampus[J]. Neuropsychiatric Disease and Treatment, 2019, 1521-31. |
| [45] |
周静洋, 鲁艺, 李海娜, 等. 四逆散对LPS诱导抑郁小鼠模型的抗抑郁作用及IDO调节机制[J]. 中华中医药杂志, 2015, 12: 4431-4433. |
| [46] |
周静洋, 鲁艺, 徐向青, 等. 天丝饮的抗抑郁作用及其对IDO的调节[J]. 北京中医药大学学报, 2015, 38(3): 182-185. DOI:10.3969/j.issn.1006-2157.2015.03.008 |
 2019, Vol. 36
2019, Vol. 36