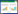文章信息
- 黄海超, 窦昊颖, 梁芳芳, 王泓午
- HUANG Haichao, DOU Haoying, LIANG Fangfang, WANG Hongwu
- 芪茵荷叶饮对糖耐量异常大鼠糖代谢及骨骼肌NF-κB信号通路的影响
- Effect of Qiyin Heye Decoction on glucose metabolism and NF-κB signaling pathway in skeletal muscle of rats with abnormal glucose tolerance
- 天津中医药, 2019, 36(11): 1110-1115
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(11): 1110-1115
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.11.21
-
文章历史
- 收稿日期: 2019-05-26
2. 天津市口腔医院, 天津 300041
糖尿病发生的一个必经阶段,称为“糖尿病前期”,包括糖耐量受损(IGT)和/或空腹血糖受损(IFG)[1]。其中,IGT患者存在明显的胰岛素抵抗及分泌障碍,是糖尿病的危险人群[2]。研究发现,糖尿病前期可增加肾脏、神经、视网膜及大血管病变的风险[3-6]。因此,对IGT患者进行有效的干预可阻止糖尿病进展,对糖尿病防治将起到重大作用。肥甘厚腻饮食是引发IGT甚至2型糖尿病(T2DM)的重要原因之一[7],以阴虚热盛和湿热困脾为主[8-9]。前期研究已证实[10-11],气虚和痰浊是T2DM主要的证候,气虚贯穿于糖尿病前期和T2DM病程的始终。T2DM以气阴两虚型和湿热困脾型为主,而糖尿病前期则以阴虚内热、湿热困脾为主。脾主运化、统血,输布水谷精微,喜燥恶湿,脾虚则气不足,堆积不能运化,淤积于体内助湿生痰。因此,按照益气补阴,补气益脾,清热除湿的治则可预防高脂高糖饮食引起的IGT向T2DM演变。本研究选取黄芪、茵陈蒿和荷叶三药配伍组成芪茵荷叶饮,并采用正交实验研究其能否预防IGT向T2DM演变,并从NF-κB信号通路入手,探明芪茵荷叶饮预防IGT向T2DM演变的作用机制。
1 材料 1.1 动物4~5周龄清洁级SD雄性大鼠,体质量150~180 g,共110只。由北京维通利华实验动物技术有限公司提供。
1.2 主要试剂与仪器罗氏活力型血糖检测仪和血糖试纸,大鼠胰岛素ELISA试剂盒(上海宝曼生物科技有限公司)。HWY-100C恒温培养箱,Bio-Rad iMark酶标仪,EnSpire酶标仪。
1.3 药物制备芪茵荷叶饮由黄芪、茵陈蒿和荷叶按比例配制,在天津中医药大学实验中心煎煮。每克中药加水6 mL浸泡30 min,武火煮沸后转文火煎煮30 min,过滤后收集煎液,原渣每克加水4 mL煎煮40 min,合并两次煎液,于60 ℃水浴浓缩成每毫升制剂相当于生药1 g,置4 ℃冰箱备用。给药前复温至25~30 ℃。
2 方法 2.1 造模方法[12]150~180 g清洁级雄性SD大鼠180只适应性喂养1周,随机抽取10只作为对照组(N)给予基础饲料喂养(碳水化合物65.42%,蛋白质占22.47%,脂肪占12.11%),其余为IGT造模组,给予45%的高脂高糖饲料(碳水化合物占35%,蛋白质占20%,脂肪占45%)。所有饲料由北京华阜康生物科技股份有限公司提供。实验期间各组大鼠自由饮水,每日投食1次。喂养12周时,IGT造模组禁食12 h后,经鼠尾采血测空腹血糖(FBG),以50%葡萄糖注射液2 g/kg体质量灌胃,2 h后再次鼠尾采血测OGTT 2 h血糖(2 h PG),以3.9 mmol/L≤FBG<6.1 mmol/L,7.8 mmol/L≤2 h PG<11.1 mmol/L并持续1周以上为造模成功,成模率60%。
2.2 分组及给药方法将100只建模成功的大鼠随机分为模型组1组和实验组9组(A,B,C,D,E,F,G,H,I),设对照组1组,共11组,每组10只。按照《中国药典》给药剂量,进行大鼠与人体等效剂量换算后的剂量为中剂量,低剂量为中剂量一半,高剂量为中剂量的两倍。9组实验组用药剂量配伍按正交表L9(34)设计,见表 1。水煎混合悬液灌胃,模型组和对照组生理盐水灌胃,各组灌胃体积相同,每日1次,持续12周。灌胃期间各组大鼠均普通饲料喂养。
分别在给药前、给药6周和给药12周,大鼠禁食12 h后采用葡萄糖氧化酶法测FBG、采用酶联免疫分析法空腹胰岛素(FINS)水平。计算HOMA胰岛素抵抗指数(HOMA-IR)=FBG×FINS/22.5。
2.3.2 骨骼肌取材给药12周后取大鼠后肢骨骼肌样本,冻存于-80 ℃冰箱,待指标检测。
2.3.3 苏木精-伊红(HE)染色将肌肉组织切片经苏木素浸染5 min左右,水洗l min,75%的盐酸乙醇分化30 s,水洗,氨水处理30 s,水洗1 min,酸化伊红乙醇液染12 min,流水快速冲洗、脱水、透明、封片固定。
2.3.4 实时荧光定量PCR检测方法应用实时荧光反转录-多聚酶链反应(RT-PCR)检测NF-κB信号通路节点基因相关mRNA含量。采用Trizol法提取骨骼肌总RNA,反转录为cDNA,反转录条件为37 ℃ 15 min,85 ℃ 5 s。荧光定量PCR仪进行基因表达量的检测,2-ΔΔCt法对Real-time PCR结果进行定量分析。扩增条件为预变性95 ℃ 30 s,扩增反应为95 ℃ 5 s,60 ℃ 34 s,反复40个循环。由生工生物工程(上海)股份有限公司合成引物,GAPDH作为内参照,GAPDH上游引物为:5’-GACATGCCGCCTGGAGAAAC-3’;下游引物为:5’-AGCCCAGGATGCCCTTTAGT-3’;NF-κBp65上游引物为:5’-GACCTGGAGCAAGCCATTAG-3’,下游引物为:5’-CACTGTCACCTGGAAGCAGA-3’;IκB-α上游引物为:5’-TTGGTCAGGTGAAGGGAGAC-3’,下游引物为:5’-GCTTTCAGAAGTGCCTCAGC-3’。
2.4 统计学方法采用SPSS 20.0进行统计学处理。符合正态分布的计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,正交实验采用直观分析和正交设计方差分析,重复测量资料采用重复测量方差分析,P<0.05为差异有统计学意义。
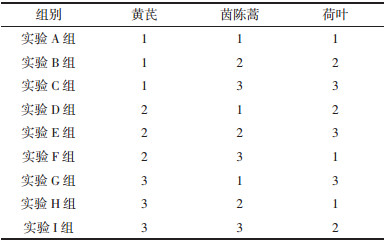
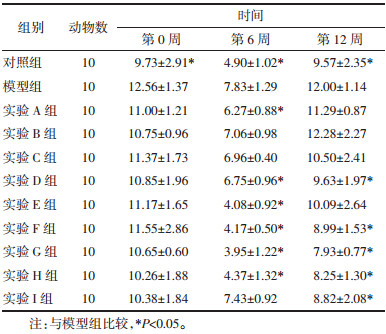
3 结果 3.1 对大鼠空腹葡萄糖的影响给药期各组大鼠空腹葡萄糖重复测量方差分析主效应结果显示:Mauchly球形检验P=0.326,满足“球对称”。不考虑时间因素,实验各组大鼠空腹葡萄糖有统计学意义(F组间=4.269,P=0.000)。不考虑干预因素,各组大鼠空腹葡萄糖随时间变化而变化(F时间=110.670,P=0.000)。时间与组别交互效应结果显示,实验各组大鼠空腹葡萄糖随时间的变化趋势差异有统计学意义(F交互=3.240,P=0.000)。各组大鼠空腹葡萄糖变化情况:给药6周时除实验I组外其余各组血糖值均较给药前降低,其中实验E组下降最明显,与模型组相比具有统计学差异(P<0.05)。给药12周时,各实验组FBG值均反弹,其中实验B组和E组均较模型组升高,差异有统计学意义(P<0.05)。见表 2。
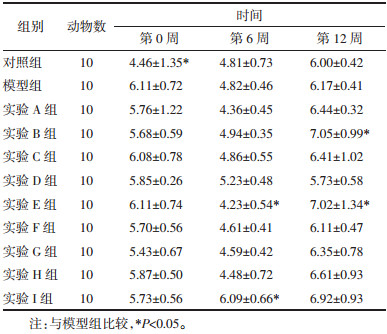
给药期各组大鼠FINS重复测量方差分析主效应结果显示:Mauchly球形检验P=0.037,不满足“球对称”,采用校正法。不考虑时间因素,实验各组大鼠FINS有统计学意义(F组间=13.922,P=0.000)。不考虑干预因素,各组大鼠FINS随时间变化而变化(F时间=286.082,P=0.000)。时间与组别交互效应结果显示,实验各组大鼠FINS随时间的变化趋势差异有显著性(F交互=5.118,P=0.000),各组FINS随时间变化的趋势不一致。各组大鼠FINS变化:给药6周时各组FINS均较模型组降低,且有统计学差异(P<0.05)。给药12周时各组FINS水平均较给药6周时升高,但各实验组(除A和B组)较模型组降低差异有统计学意义(P<0.05)。见表 3。
给药期各组大鼠HOMA-IR重复测量方差分析主效应结果显示:Mauchly球形检验P=0.335,满足“球对称”。不考虑时间因素,各组大鼠HOMA-IR有统计学意义(F组间=8.784,P=0.000)。不考虑干预因素,各组大鼠HOMA-IR随时间变化而变化(F时间=247.592,P=0.000)。时间与组别交互效应结果显示,实验各组大鼠HOMA-IR随时间的变化趋势差异有统计学意义(F交互=2.631,P=0.001),各组HOMA-IR随时间变化的趋势不一致。各组大鼠HOMA-IR变化情况:给药6周时除实验B组、C组及I组外,其余各组HOMA-IR均较模型组降低,差异有统计学意义(P<0.05)。给药12周,实验D组、F组、G组、H组和I组HOMA-IR均较模型组降低,差异有统计学意义(P<0.05)。见表 4。
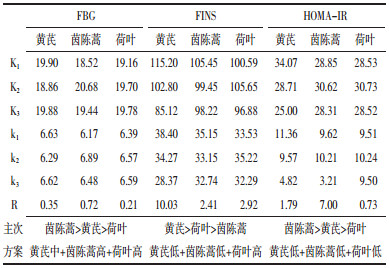
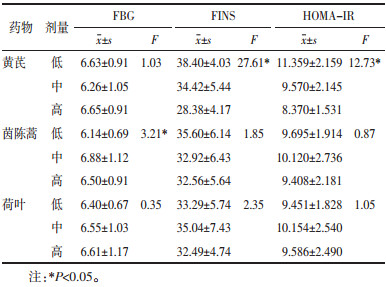
给药12周时正交结果极差分析和方差分析显示,对FBG影响的主次因素为茵陈蒿>黄芪>荷叶,最佳配伍方案为中剂量黄芪+高剂量茵陈蒿+高剂量荷叶;对FINS影响的主次因素为黄芪>荷叶>茵陈蒿,最佳配伍方案为高剂量黄芪+高剂量茵陈蒿+中剂量荷叶;对HOMA-IR影响的主次因素为茵陈蒿>黄芪>荷叶,最佳配伍方案为低剂量黄芪+低剂量茵陈蒿+低剂量荷叶。方差结果分析显示,不同剂量的茵陈蒿对FBG影响存在统计学差异,不同剂量黄芪对FINS和HOMA-IR存在统计学差异。见表 5、表 6。
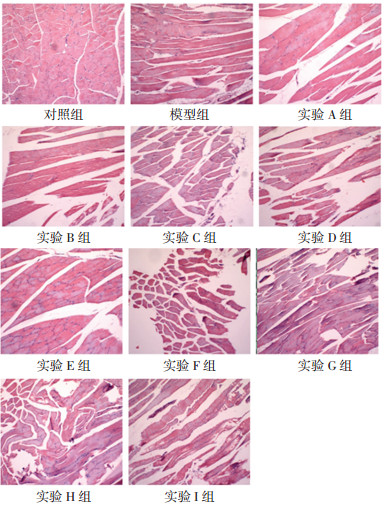
给药12周末,大鼠肌肉组织HE染色结果显示:对照组大鼠骨骼肌形态完整、肌纤维排列整齐;模型组及9组实验组大鼠骨骼肌肌纤维排列紊乱、均有水肿,模型组水肿较为明显、可见炎症细胞浸润,见图 1。
|
| 图 1 大鼠骨骼肌病理组织学变化 Fig. 1 Histopathological changes of skeletal muscle among groups of rats |
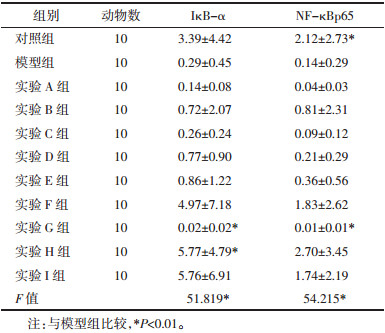
给药期间各实验组大鼠骨骼肌IκB-α表达经方差分析具有统计学差异(F=51.819,P<0.01),其中实验H组IκB-α明显高于模型组,差异有统计学意义。各组大鼠NF-κBp65mRNA方差分析结果显示具有统计学差异(F=51.819,P<0.01)。与实验M组相比,A、C、G 3组NF-κBp65下降,其中G组差异有统计学意义(P<0.05),见表 7。
|
IGT是消渴症的前驱状态,中医称之为脾瘅。《圣济总录·消渴》中记有:“消瘅者,膏粱之疾也,肥美之过,积为脾瘅,瘅病既成。”饮食失节、劳逸失调,则脾运不健,水谷运化失司,痰湿凝聚,燥热内生。因此,按照补气益脾,清热除湿的治疗原则对高脂高糖饮食引起的IGT患者进行干预,可有效预防IGT向T2DM演变。据此自拟芪茵荷叶饮,本方中黄芪性味甘温、归肺、脾经,具有益气补虚功效,现代药理学研究也表明黄芪具有降血糖、降血脂之功效[13],是中医临床常用的降糖组方用药。茵陈蒿,性微寒味苦,归脾、胃、肝和胆经,具有清利湿热之效,研究表明茵陈蒿中的有效化合物β-谷甾醇、槲皮素等可通过多条信号通路作用于靶标蛋白发挥其抗炎、降脂作用[14-15]。荷叶,性微温平味辛,归肝、脾经,清热除湿、利水通便,适用痰湿体质,荷叶具有降脂抗氧化之功效[16]。
本研究通过高糖高脂饮食诱导的方法,成功构建了IGT大鼠模型,造模成功的大鼠出现了血糖升高、糖耐量受损等症状。给予芪茵荷叶饮干预6周后,除实验I组外其余各干预组FPG均有所下降,其中实验E组具有统计学差异(P<0.05);干预12周时FPG较干预6周时回升,除实验D组外均超过干预前水平,D组为唯一低于干预前水平组别,说明芪茵荷叶饮对IGT大鼠FPG具有调节作用,可能为高剂量茵陈蒿发挥主要作用,但调节血糖效果不稳定,仍需延长观察时间以确定疗效。FINS水平与胰岛β细胞功能、血糖的稳定以及T2DM发生发展密切相关,研究表明IGT的发生与FINS浓度的进一步增加有关[17]。本研究干预6周时FINS下降,12周时略有回升但均未达到给药前水平,说明芪茵荷叶饮可通过调节FINS改善β胰岛细胞功能。HOMA-IR可以反映胰岛素抵抗状态和胰岛素敏感性,指数随胰岛素抵抗程度增加而升高。本研究中模型组大鼠HOMA-IR上升,出现IR状态,而经芪茵荷叶饮干预6周和12周后,部分实验组HOMA-IR较模型组下降,且除A和B组外均低于给药前水平,说明芪茵荷叶饮在保护胰岛β细胞、改善胰岛功能、减轻胰岛素抵抗方面具有一定功效。
正交实验结果提示,仅不同剂量茵陈蒿对FBG影响存在统计学差异,茵陈蒿取高剂量效果最佳;仅不同剂量黄芪对FINS和HOMA-IR存在统计学差异,黄芪取低剂量效果最佳。荷叶对3项指标的影响均不显著,从经济学角度可取低剂量。综合分析,黄芪为君、茵陈蒿为臣、荷叶为辅,低剂量黄芪、高剂量茵陈蒿配伍低剂量荷叶为最优方案。
本研究病理切片显示模型组大鼠骨骼肌组织水肿、有炎症细胞浸润,说明IGT大鼠骨骼肌存在炎性反应。研究表明,糖尿病前期就可能已经存在炎性反应[18]。骨骼肌是机体慢性炎症发生、发展的重要组织,骨骼肌慢性炎症是T2DM发病的早期分子事件[19]。胰岛素抵抗是IGT的主要表现,长期高脂饮食引起体重增加,可使体内炎性因子分泌增加、炎症信号通路激活,从而诱发胰岛素抵抗,导致骨骼肌稳态失调、肌组织结构受损[20]。
NF-κB是重要转录激活因子,在静息状态下IκBα与NF-κB杂二聚体以结合形式位于细胞质中,抑制NF-κB活化。当机体受到某些外界刺激时,IκBα磷酸化从NF-κB二聚体解离,NF-κB活化并进入细胞核,调控细胞功能[21]。相关研究表明NF-κB作为机体重要的炎症转录因子,与葡萄糖摄取紊乱及胰岛素抵抗密切相关,其表达水平在糖尿病前期即开始升高[22]。本研究通过NF-κBp65和IκBα基因表达水平来反映NF-κB信号通路的激活状况。本研究中实验G组较M组NF-κBp65蛋白表达水平下降显著,G组为低剂量黄芪+高剂量茵陈蒿+低剂量荷叶,说明此配伍可能会抑制NF-κB信号通路进而减轻炎症反应,与正交实验结果一致。
5 结论黄芪、茵陈蒿和荷叶三药存在交互作用,按影响主次顺序为黄芪>茵陈蒿>荷叶,最佳配伍为半量黄芪、2倍量茵陈蒿和半量荷叶。此配伍组方可改善IGT大鼠胰岛素抵抗,通过抑制NF-κB信号通路、减轻炎症反应,从而控制或延缓IGT向T2DM演变。
| [1] |
American Diabetes Association Classification and diagnosis of diabetes[J]. Diabetes Care, 2015, 38(Suppl. 1): S8-S16. doi: 10.2337/dc15-S005.
|
| [2] |
Tabák AG, Herder C, Rathmann W, et al. Prediabetes:a high-risk state for diabetes development[J]. Lancet, 2012, 379: 2279-2290. DOI:10.1016/S0140-6736(12)60283-9 |
| [3] |
Plantinga LC, Crews DC, Coresh J, et al. Prevalence of chronic kidney disease in US adults with undiagnosed diabetes or prediabetes[J]. Clin J Am Soc Nephrol, 2010, 5: 673-682. DOI:10.2215/CJN.07891109 |
| [4] |
Putz Z, Tabak AG, Toth N, et al. Noninvasive evaluation of neural impairment in subjects with impaired glucose tolerance[J]. Diabetes Care, 2009, 32: 181-183. DOI:10.2337/dc08-1406 |
| [5] |
Nguyen TT, Wang JJ, Wong TY. Retinal vascular changes in pre-diabetes and prehypertension:new findings and their research and clinical implications[J]. Diabetes Care, 2007, 30: 2708-2715. DOI:10.2337/dc07-0732 |
| [6] |
Seshasai SR, Kaptoge S, Thompson A, et al. Diabetes mellitus, fasting glucose, and risk of cause-specific death[J]. N Engl J Med, 2011, 364: 829-841. DOI:10.1056/NEJMoa1008862 |
| [7] |
徐鹏, 石岩. 从脾虚探讨糖尿病(消渴)的病因病机[J]. 辽宁中医杂志, 2018, 45(9): 1841-1844. |
| [8] |
晏丽丽.新诊断2型糖尿病常见中医证型与非酒精性脂肪肝及其相关危险因素分析[D].沈阳: 辽宁中医药大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10162-2010268409.htm
|
| [9] |
张玉修, 孙建楠, 黄慧, 等. 糖尿病前期中医体质研究进展[J]. 光明中医, 2018, 33(9): 1364-1366. DOI:10.3969/j.issn.1003-8914.2018.09.065 |
| [10] |
Dou HY, Wang YY, Yang N, et al. The association between genetic variants and characteristic symptoms of type 2 diabetes:A matched case-control study[J]. Chinese Journal of Integrative Medicine, 2017, 23(6): 415-424. DOI:10.1007/s11655-015-2290-3 |
| [11] |
Haoying Dou, Enting Ma, Liqun Yin, et al. The Association between Gene Polymorphism of TCF7L2 and Type 2 Diabetes in Chinese Han Population:A Meta-Analysis[J]. PLOS ONE, 2013, 8(3): e59495. DOI:10.1371/journal.pone.0059495 |
| [12] |
陈珊珊, 梁芳芳, 王泓午, 等. 高脂低糖和高脂高糖饲料建立糖耐量受损大鼠模型[J]. 中国老年学杂志, 2018, 38(8): 1930-1932. DOI:10.3969/j.issn.1005-9202.2018.08.057 |
| [13] |
尤良震, 林逸轩, 方朝晖, 等. 黄芪甲苷治疗糖尿病及其并发症药理作用研究进展[J]. 中国中药杂志, 2017, 42(24): 4700-4706. |
| [14] |
曹锦花. 茵陈的化学成分和药理作用研究进展[J]. 沈阳药科大学学报, 2013, 30(6): 489-494. |
| [15] |
陈国铭, 汤顺莉, 邝梓君, 等. 基于系统药理学的茵陈作用机制研究[J]. 中国药房, 2018, 29(10): 1312-1319. DOI:10.6039/j.issn.1001-0408.2018.10.05 |
| [16] |
柴金珍, 蒋丽, 韦经强, 等. 荷叶降脂、抗氧化作用研究进展[J]. 食品研究与开发, 2016, 37(8): 209-212. DOI:10.3969/j.issn.1005-6521.2016.08.049 |
| [17] |
朱洁宜.希美宁对2型糖尿病模型大鼠糖脂代谢及肝脏AMPK/ACC信号通路的影响[D].哈尔滨: 黑龙江中医药大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10228-1018147010.htm
|
| [18] |
Sohrab G, Nasrollahzadeh J, Zand H, et al. Effects of pomegranate juice consumption on inflammatory markers in patients with type 2 diabetes:A randomized, placebcrcontrolled trial[J]. Res Med Sci, 2014, 19(3): 215-220. |
| [19] |
Bleau C, Karelis A, David H., et al. Crosstalk between intestinal microbiota, adipose tissue and skeletal muscle as an early event in systemic low-grade inflammation and the development of obesity and diabetes[J]. Diabetes/Metabolism Research and Reviews, 2015, 31(6): 545-561. DOI:10.1002/dmrr.2617 |
| [20] |
张坦, 崔迪, 张喆, 等. 游泳运动对糖尿病小鼠骨骼肌AMPK/SIRT1/NF-κB炎症信号通路的影响[J]. 体育科学, 2016, 36(9): 40-47. |
| [21] |
陈丽, 陈瑞, 梁凤霞, 等. NF-κB信号通路与胰岛素抵抗[J]. 华中科技大学学报(医学版), 2015, 44(5): 608-611. DOI:10.3870/j.issn.1672-0741.2015.05.026 |
| [22] |
隋蕾.核因子-κB在不同糖耐量者及口服抗糖尿病药失效强化治疗患者中表达的研究[D].合肥: 安徽医科大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10366-2009200265.htm
|
2. Tianjin Stomatological Hospital, Tianjin 300041, China
 2019, Vol. 36
2019, Vol. 36