文章信息
- 唐旭东, 张路, 杨秀鹏, 唐玉凤, 王德秀
- TANG Xudong, ZHANG Lu, YANG Xiupeng, TANG Yufeng, WANG Dexiu
- 定量PCR检测TRAF3通路基因变化在青黄散治疗骨髓增生异常综合征中的机制
- Mechanism of treatment on myelodysplastic syndrome with Q-PCR detection of TRAF3 gene pathway under the function of Qinghuang Powder
- 天津中医药, 2019, 36(11): 1121-1125
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(11): 1121-1125
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.11.23
-
文章历史
- 收稿日期: 2019-07-08
2. 北京中医药大学管理学院, 北京 100029;
3. 中国中医科学院西苑医院检验科, 北京 100091;
4. 北京中医药大学研究生院, 北京 100029
骨髓增生异常综合征(MDS)是一组起源于造血干/祖细胞的恶性克隆性肿瘤性疾病,特点是由于凋亡增加而导致无效造血以及外周血细胞减少,并具有最终向白血病转化的趋势。近年来,MDS的发病率呈现逐步增高的趋势,并成为严重危胁中老年人生命和生活质量的主要恶性肿瘤之一。但到目前为止,现代医学对本病尚无特效疗法,以化疗为中心的治疗方式费用昂贵,部分患者出现较严重的不良反应或生命危险,生活质量低下,且生存期较短。寻找新的治疗MDS的途径和药物一直是本领域的热点和难点课题。本科室从事中西医结合治疗MDS 20余年,针对MDS毒瘀内阻的病机本质,以青黄散为主,以解毒化瘀为法,明显提高了生活质量和延长生存期[1-6]。
MDS患者存在抑癌基因高度甲基化[7],DNA甲基化与MDS的发生、发展有关,是MDS向急性白血病进展的主要机制[8]。前期的研究,青黄散(每粒0.3 g,含青黛0.2 g、雄黄0.1g,西苑医院药厂提供),每日1粒,晚饭后口服。治疗后MDS患者DNA甲基化程度显著减低,提示含砷中药治疗的主要作用机制是去甲基化,青黄散可能通过调控信号转导生物学途径等发挥作用[9]。目前国内外尚无相关的研究青黄散等砷剂作用于MDS的过度甲基化肿瘤坏死因子受体相关因子3(TRAF3)基因机制研究,本研究以明雄黄和靛玉红(青黛提取物)模拟青黄散,通过Q-PCR探讨人骨髓增生异常综合征细胞(MUTZ-1)在明雄黄和靛玉红(青黛提取物)组合干预后TRAF3通路基因基因的变化,从而揭示青黄散治疗MDS的作用机制。
1 材料与方法 1.1 主要试剂和仪器 1.1.1 试剂GoScriptⓇ Reverse Transcription System A5001(Promega公司);GoTaqⓇqPCR Master Mix A6001(Promega公司);RQ1 Rnase-Free Dnase M610A (Promega公司)
1.1.2 仪器Millipore超纯水制备系统(美国Millipore公司),CFX96 Q-PCR仪(BIO-RAD公司),-80 ℃冰箱(Thermo公司)。
1.1.3 引物设计GAPDH的上游引物:5’TCATTGACCTCAACTACATGG3’,下游引物:TCGCTCCTGGAAGATGGTG;TRAF3的上游引物:5’CAAGTGCTCGGAACACAG3’,下游引物:5’CACTCAGCATCTGGTCATGC3’;RIP的上游引物:5’GTGTACAAGGGGCCCAACT3’,下游引物:5’CGGCTGTGTCTCAGTCTGTT3’;IRF3的上游引物:5’CCTCTCCGGACACCAATG3’,5’CCCAGTAACTCCAGAATGTC3’;IFN-γ的上游引物:5’GGCATTTTGAAGAATTGGAAAG3’,5’TTTGGATGCTCTGGTCATCTT3’;IL-10的上游引物:5’GATGCCTTCAGCAGAGTGAA3’,下游引物:5’GCAACCCAGGTAACCCTTAAA3’。
1.2 细胞培养和处理 1.2.1 MUTZ-1细胞复苏MUTZ-1细胞株的培养基为RPMI1640液,其含10%的灭活胎牛血清。培养条件为5%二氧化碳(CO2),温度为37 ℃。从液氮罐中取出冷冻管;迅速放入37 ℃水浴中,并不时摇动,在2 min内使其完全融化,然后在无菌下取出细胞;在1 000 r/min速度下离心5 min,弃去上层液,加入适量培养液后接种于培养瓶中,接种浓度2×105/L,体积为5 mL,置37 ℃温箱静置培养。
1.2.2 MUTZ-1细胞换液、传代与细胞冻存从培养箱内取出培养瓶,放在显微镜下观察细胞生长状态;用吸管吸取细胞及培养液,转入10 mL离心管中,轻轻吹打混匀细胞,计算细胞密度为7×105/mL;离心,1 000 r/min,5 min;弃掉原培养液,加入新鲜培养液5 mL,并轻轻吹打细胞,使之均匀悬浮;吸取1.4 mL细胞悬液至新培养瓶中,加入3.6 mL新鲜培养液,吹打数次;放入培养箱中继续培养;剩余细胞悬液置于离心管中离心(1 000 r/min,5 min);去上清液,加入与1 mL的冻存液,用吸管轻轻吹打使细胞均匀,并转移至冻存管中;冷存管置于4 ℃ 10 min、-20 ℃ 30 min、-80 ℃隔夜后,置于液氮罐中长期储存;记录每一个冷冻管的位置以确保在以后应用时能够找到每一个冷冻管。
1.2.3 细胞的药物处理 1.2.3.1 药物配置AS2S2母液配置:取适量AS2S2溶解于1 mol/L的氢氧化钠(NaOH)溶液中,然后用盐酸(HCL)调节使溶液的pH计达7.35~7.45,最终储存液浓度达0.5 mmol/L。使用时用蒸馏水稀释至工作浓度。
靛玉红母液配置:取适量靛玉红溶解于1 mol/L的二甲基亚砜(DMSO)溶液中,制成储存液浓度达5 mmol/L。使用时用DMSO稀释至工作浓度。
1.2.3.2 药物处理调整细胞浓度至2×105个/mL,10 mL,轻轻吹打100次左右,制成单个细胞悬液,按照20万/mL的接种密度,充分混匀后,用排枪吸取96 μL悬液至孔中,每孔2 mL。边缘孔用无菌水填充100 μL。准备将96孔板放置在培养箱中培养72 h。3 d后从CO2培养箱中取出96孔板,每孔加入10 μL的WST-8,放回培养箱并培养2 h。用酶联免疫检测仪在460 nm波长处测定其光吸收值。上述实验重复做3次。
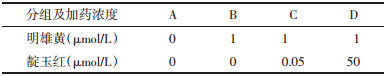
进行分组及加药处理:A组为空白对照,B组为雄黄组(浓度1 μmol/L),C组为雄黄(浓度1 μmol/L)+低剂量靛玉红(浓度0.05 μmol/L)组,D组为雄黄(浓度1 μmol/L)+高剂量靛玉红(浓度50 μmol/L)组。见表 1。
从-80 ℃冰箱中取出样品,每个样品加入750 μL TrIzol Reagent,用枪吹打数次,室温放置5 min,使核酸蛋白复合物完全分离;每1 000 μL Trizol加200 μl氯仿,盖好管盖,用手快速震荡15 s,室温放置3 min;4 ℃ 12 000 rpm离心15 min,样品会分成3层。将上清液移入一个新的离心管中,在上清液中加入10 μg的糖原,混匀,在上清液中加入上清等体积异丙醇,-20 ℃孵育10 min,4 ℃ 12 000 rpm离心10 min。
1.3.1.2 RNA洗涤离心后弃上清,留RNA沉淀,向沉淀中加入1 000 μL 75%乙醇。4 ℃ 7 500 rpm离心2 min,弃上清,放置晾干RNA沉淀。
1.3.1.3 RNA再悬浮加入25 μL H2O(Rnase free);55 ℃孵育10 min使RNA完全溶解;取少量RNA进行0.8%琼脂糖胶电泳,270 V 5 min。拍照,检测RNA完整性;测定各组RNA浓度分别为:A组:249.640 ng/μL,B组:283.720 ng/μL,C组:193.640 ng/μL,D组:193.640 ng/μL;进行下游实验,剩余mRNA样品放-80 ℃保存。
1.3.2 Dnase消化基因组DNA取9 μL mRNA进行Dnase消化,37 ℃孵育30 min,加入1 μL of RQ1 DNase Stop Solution停止酶反应。65 ℃孵育10 min灭活DNase活性。反应体系终体积10 μL,包括:RNA 8 μL,RNase-Free DNase 10X Reaction Buffer 1 μL,RQ1 RNase-Free DNase 1 μL。
1.3.3 cDNA合成将上面经DNase消化的mRNA用于下面的cDNA合成。
1.3.3.1 引物模板退火混合RNA 5 μl,Oligo(dT) 1 μL,Rnase free H2O 4 μL配成终体积10 μL。在70 ℃ 5 min。立即放入冰水混合物中冷却5 min。在微型离心机离心10 s。放置在冰上进行逆转录混合物配制。
1.3.3.2 反转录反应按顺序在冰上准备反转录反应混合物,每一个cDNA反应体系10 μL,包括GoScriptTM 5X反应缓冲液4.0 μL,氯化镁(MgCl2) 3.0 μL,PCR混合核苷酸1.0 μL,GoScriptTM逆转录酶1.0 μL,无核酸酶的水1.0 μL。
10 μL逆转录混合物(第3步制得)+10 μL RNA和引物(第1步制得);25 ℃退火5 min;42 ℃延伸1 h;70 ℃ 5 min灭活逆转录酶。
1.3.4 Q-PCR过程用CFX96 Q-PCR仪进行扩增,扩增程序为:95 ℃ 2 min,(95 ℃10 s,60 ℃ 50 s)×34个循环。RealTime反应体系为:2×GoTaqⓇ qPCR Master Mix:5 μL,上游引物(10 μmol/L):0.25 μL,下游引物(10 μmol/L):0.25 μL。cDNA模板:2 μL,加入灭菌蒸馏水至120 μL。样品Real-Time PCR检测,将各样品cDNA 10倍稀释后取2 μL作模板,分别用目的基因引物和内参基因引物进行扩增。同时在60~95 ℃进行溶解曲线分析。
1.4 统计学分析每个样本均重复3个复孔,并根据同组间实验结果计算平均值。结果经内参均一化处理后,以空白对照组目的基因表达量为参照因子,采用2-△△Ct法进行分析,结果计算公式为:相对表达量=2-(Ct目的基因-Ct内参基因)。表达水平比较采用t检验,P<0.05提示有统计学意义。
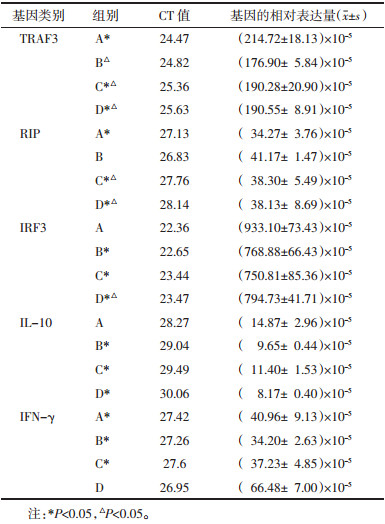
2 结果各组基因的相对表达量变化,见表 2。
由表 2结果可知,TRAF3基因在B组表达较低,在C和D组表达较高,B、C和D组皆低于A组(P<0.05)。RIP基因在B组表达较高,在C和D组表达较低,B、C和D组皆高于A组(P<0.05)。IRF3基因在B和C组表达较低,在D组表达较高,B、C和D组皆低于A组(P<0.05)。IL-10基因在C组表达较高,在B组次之,在D组表达较低,B、C和D组皆低于A组(P<0.05)。IFN-γ在D组表达较高,在C组次之,在B组较低,D组高于A组(P<0.05)。
3 讨论MDS的治疗一直是本领域的热点和难点,因为MDS兼具病态造血和原始细胞高两大特点,化疗目前有效率相对较低,主要也是因为只能解决原始细胞高的问题,而对病态造血束手无策。因此,研究治疗骨髓增生异常综合征具有重大的现实意义。
中医古典记载并无MDS病名,因其临床表现为神疲乏力、少气懒言、头晕目眩、心悸气短、嗜睡纳差、面色苍白等气血两虚证,兼有午后低热或五心烦热、齿衄鼻衄、肌肤瘀斑瘀点、胁下积块、舌淡苔薄白,脉细弱或细数等,多归属于“虚劳”、“血证”、“癥积”、“热劳”、“内伤发热”等范畴。中国中西医结合学会血液学专业委员会于2008年召开专门“常见血液病中医命名规范化研讨会”,提出MDS中医病名为“髓毒劳”,其中“髓”代表病位,“毒劳”代表病情与病性[10]。本MDS虽然临床表现为血细胞减少而致的气血亏虚之象,但其骨髓象多表现为增生活跃,部分患者伴有肝、脾、淋巴结肿大,应辨证为实证、瘀证,病位在血分、骨髓,是造血器官的病变。患者素体正气虚损,复感邪毒,邪毒内蕴,深伏于精血骨髓之内,因毒致瘀,毒瘀互阻,致使机体精亏血少,形体失充,日渐羸弱,血液化生不足,故而呈现一派虚损之象。其病机特点为虚实夹杂、邪实正虚、正不胜邪、以实为主,虚实夹杂贯穿整个疾病过程[11]。
青黄散系本科在长期临床实践中总结出来的有效方药,由青黛、雄黄组成,青黛性味咸寒,入肝经,可消肿散瘀、凉血解毒;雄黄味辛温,可解百毒,消积聚,化腹中之瘀血。因此青黄散具有祛邪解毒、活血化瘀之功效,适用于骨髓增生异常综合征的临床治疗,能够改善患者的临床症状,提高生存质量,且价格低廉。笔者已在2006年(31例)、2008年(55例)、2011(124例),2012年(30例),2014年(107例),2015年(308例)连续报道青黄散为主综合治疗MDS的结果,青黄散为主综合治疗MDS具有确切的临床疗效,总有效率79.5%~82.3%,缓解率24.3%~26.5%[1-6]。
MDS患者存在抑癌基因高度甲基化,笔者已经发现,青黄散治疗前MDS患者的TRAF3基因甲基化程度很高,治疗后显著减低,提示含砷中药治疗的主要作用机制是去甲基化。TRAF3是肿瘤坏死因子(TNF)超家族和Toll样/白细胞介素-1受体(Toll/IL-1 receptor,TIR)超家族重要的接头分子,是细胞内信号传导通路上的关键接头分子,一方面接受外来刺激信号,另一方面又可通过其TRAF同源结构域募集胞浆内其它含有TRAF结构域的基因分子来传递信号。而TLRs是天然免疫和获得性免疫之间的桥梁。TLRs可以通过TRAF3,激活转录因子NF-κB和AP-1,活化后的转录因子NF-κB、AP-1进入细胞核促进前炎性细胞因子(如TNF-α和IL-1,6,8,12等)和黏附分子CD80、CD86等基因转录,最终产生IFN(IFN-β、IFN-α、IFN-γ)和IL-10。干扰素的释放可以促进巨噬细胞吞噬肿瘤细胞,IFN-γ对B细胞和CD8+T细胞的分化有促进作用,而且能增强Th1细胞的活性,增强细胞免疫功能。IL-10等细胞因子可以促进Th3的分化,Th3分泌的TGF-β抑制Th1细胞介导的免疫应答和炎症反应,还可下调Toll样受体(TLR4)的表达,从而间接减轻炎症反应,促炎性因子共同对细胞免疫进行调控。所以TRAF3可以通过TRIF信号转导途径产生的细胞因子及黏附分子(如:IRF3、RIP)对获得性免疫进行调控[12-15]。
研究发现,根据以上结果,可以得出结论:青黄散(明雄黄和靛玉红的组合)在青黛浓度较低时可以引起RIP基因表达增加,TRAF3、IRF3、IL-10、IFN-γ基因表达减低,在青黛浓度较高时可以引起RIP、IFN-γ基因表达增加,IRF3、TRAF3、IL-10基因表达减低,都可以促进机体产生IFN-γ,增强NK细胞对肿瘤细胞的杀伤能力,不同在于随着青黛浓度增加,IFN-γ基因继续上调,IL-10继续下调,NK细胞对肿瘤细胞的杀伤能力继续增强。所以,未来可能通过调整青黛溶液的浓度,影响MUTZ-1人细胞株的TRAF3及其信号通路,从而达到良好的治疗目的。
总之,研究从基因基因水平进一步证实了青黄散治疗MDS的作用机制,丰富了青黄散等砷剂治疗MDS的理论依据,将进一步推动笔者把药物机制研究引向深入,促进MDS临床疗效的提高。下一步的研究将对青黄散比例进行细化,进一步探讨青黛和雄黄的比例与TRAF等基因的关系,为临床调整青黄散剂量,提高疗效并降低毒副作用提供客观依据。
| [1] |
Xu S, Liu F, Ma R. Clinical observation on qinghuang powder for treatment of 31 cases of myelodysplastic syndrome[J]. Journal of Traditional Chinese Medicine, 2006, 47(7): 514-516. |
| [2] |
Xu S, Hu XM, Xu YG, et al. Effect of treatment for myelodysplastic syndrome by Qinghuang Powder combined with Chinese herbs for reinforcing shen and strenghening[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2008, 28(3): 216-219. |
| [3] |
Xu S, Ma R, Hu XM, et al. Clinical observation of the treatment of myelodysplastic syndrome mainly with Qinghuangsan[J]. Chin J Integr Med, 2011, 17(11): 834-839. DOI:10.1007/s11655-011-0894-9 |
| [4] |
Gao F, Ma R, Hu XM, et al. Study of the long-term efficacy of Qinghuang Powder on reating MDS-RAEB[J]. Journal of Clinical Hematology, 2013, 26(1): 16-18. |
| [5] |
周庆兵, 王洪志, 杨秀鹏, 等. 青黄散及健脾补肾方药联合西药治疗骨髓增生异常综合征107例临床观察[J]. 中医杂志, 2014, 55(10): 838-841. |
| [6] |
周庆兵, 王洪志, 杨晓红, 等.青黄散为主方案治疗骨髓增生异常综合征伴多系发育异常308例临床观察[J].2015, 24(1): 54-57. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=bxblbl201501016
|
| [7] |
黄建英, 曾宪昌, 陈飞, 等. MDS患者P15基因高度甲基化的研究[J]. 湖北医科大学学报, 2000, 21(2): 130-131. DOI:10.3969/j.issn.1671-8852.2000.02.015 |
| [8] |
Ying J, Andrew D, Lukasz P, et al. Aberrant DNA methylation is a dominant mechanism in MDS progression to AML[J]. Blood, 2009(113): 1315-1325. |
| [9] |
Sun SZ, Ma R, Hu XM, et al. Karyotype and DNA-methylation responses in myelodysplastic syndromes following treatment with traditional Chinese formula containing arsenic[J]. Evid Based Complement Alternat Med, 2012(7): 969476. |
| [10] |
陈信义, 麻柔. 规范常见血液病中医病名建议[J]. 中国中西医结合杂志, 2009, 29(11): 1040-1041. DOI:10.3321/j.issn:1003-5370.2009.11.020 |
| [11] |
徐述. 麻柔治疗骨髓增生异常综合征经验[J]. 中医杂志, 2011, 52(12): 1004-1005. |
| [12] |
Ely KR, Kodandapani R, Wu S. Protein-protein interactions in TRAF3[J]. Adv Exped Biol, 2007(597): 14-21. |
| [13] |
Takada H, Chen NJ, Mirtsos C, et al. Role of SODD in regulation of tumornecrosis actor responses[J]. Mol Cell Biol, 2003(23): 4026-4033. |
| [14] |
Zhang JY, Adams AE, Ridky TW, et al. Tumor necrosis factor eceptor1/c-Jun-NH2-kinase signaling promotes human neoplasia[J]. Cancer Res, 2007(67): 827-3834. |
| [15] |
Tesz GJ, Guilherme A, Guntur KV, et al. Tumor necrosis factor alpha (TNF alpha) stimulates Map4k4 expression through TNFalpha receptor 1 signaling to-Jun and activating transcription factor 2[J]. Biol Chem, 2007(282): 19302-19312. |
2. School of Management, Beijing University of Chinese Medicine, Beijing 100029, China;
3. Laboratory, Xiyuan Hospital China Academy of Chinese Medical Sciences, Beijing 100091, China;
4. Graduate School, Beijing University of Chinese Medicine, Beijing 100029, China
 2019, Vol. 36
2019, Vol. 36