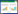文章信息
- 赵金龙, 曾令烽, 赵第, 潘建科, 韩燕鸿, 梁桂洪, 李嘉晖, 刘军
- ZHAO Jinlong, ZENG Lingfeng, ZHAO Di, PAN Jianke, HAN Yanhong, LIANG Guihong, LI Jiahui, LIU Jun
- 基于系统药理学的骨碎补治疗骨质疏松的通路及靶标探讨
- Pathways and targets of Gusuibu in the treatment of osteoporosis based on systematic pharmacology
- 天津中医药, 2019, 36(11): 1126-1132
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(11): 1126-1132
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.11.24
-
文章历史
- 收稿日期: 2019-05-20
2. 广东省中医药科学院骨与关节退变及损伤研究团队, 广州 510120;
3. 广州中医药大学第二附属医院, 广东省中医院, 广州 510120
骨碎补首载于《药性论》,是水龙骨科植物槲蕨的根茎部分。在中医学的草药应用中,骨碎补用于多种骨伤科相关疾病,如肝肾不足引起的骨关节炎、腰肌劳损等[1]。根据中国最新的人口普查数据,2013年中国60岁以上老年人口约为2.02亿,而到2050年此数据可上升至4亿,中国骨质疏松患者或骨密度低的人群数量将达2.12亿[2-3],骨质疏松症病患人群的不断增长,必然会带来一系列的社会、经济等压力。因此充分利用和发掘可用于抗骨质疏松的药物,为抗骨质疏松提供更有效的药物成分,是社会和医学发展的迫切要求。随着现代药理学研究的发展以及临床实践的探索应用,骨碎补也被发掘应用于抗骨质疏松治疗[4]。Cai YL等[5]的研究显示,骨碎补可以作用于去势骨质疏松大鼠,能增强实验小鼠的骨密度,并改善骨小梁的显微结构。临床药学中所应用的抗骨质疏松中成药如强骨胶囊、骨疏康颗粒等,都包含有骨碎补这一味中药成分[6]。骨碎补是中医骨伤科广泛应用的经典草药,具有巨大的应用潜力,探讨并发掘骨碎补在抗骨质疏松中的潜在机制,可有利于促进抗骨质疏松的临床用药进展。基于系统药理学的生物信息学推导方法,对骨碎补的相关生物学、药理学等生物信息数据进行分析,将从分子层面及通路领域探讨骨碎补治疗骨质疏松的生物学原理,以期为骨碎补的临床推广应用及开发新的可用于抗骨质疏松物药提供有力的循证支持。
1 资料和方法 1.1 骨碎补的化学分子信息库本研究通过中药系统药理学分析平台(TCMSP),以“骨碎补”作为中药名检索骨碎补的化学成分。
1.2 化合物的信息提取通过口服方式表现出来的生物利用度是药物动力学(ADME)中最重要的药物代谢动力学的其中一个参数,其代表口服药物到达体循环所占口服剂量的多少,作用比率高的口服生物利用度也许是决定生物活性分子类药性的重要指标[7]。文章研究以口服生物利用度(OB)最低大于或等于30%和类药性(DL)最低大于或等于0.18作为活性化合物的选取标准,将数据库中具有较高活性的成分进行提取,以保证数据的有效性。
1.3 化合物与靶点网络的构筑将“骨碎补”相关的化合物及靶点通过软件Cytoscape 3.5.1构筑化合物-靶点网络,并对其进行拓扑学的数据分析,从而研讨骨碎补的药理学作用机制,其中靶点度值(Degree)和中介中心度(Betweenness Centrality)是拓扑学数据中两个关键参数,可评判该方剂相关化合物和靶标的关键性。
1.4 蛋白互作(PPI)网络的构建蛋白质一般以相互组合的方式方能实现其生理学功能,因此蛋白相互作用网络的分析及研究是理解生命活动如生理过程等的基础条件。为了阐明靶点蛋白在系统层面的用途,将“骨碎补”相关的靶点输入数据库STRING 10.5,使用相关设置功能,将评分设为0.90及以上,以此提升信息的可信性。通过以上数据处理而导出蛋白互作的可视化图,并根据相关数据提取相关靶标蛋白的关联频数。
1.5 KEGG通路富集分析KEGG(Kyoto Enclopedia of Genes and Genomes)是东京大学和日本京都大学共同开发的数据库,研究可以通过此信息库进行相关通路的研究,且该信息库与David在线互联。为了阐明本研究中方剂中相关化合物的靶点蛋白在信号通路中的作用机制,文章采用David v6.8数据库对靶点蛋白进行信号通路富集分析,从而分析骨碎补所涉及的相关通路。
2 结果 2.1 骨碎补的有效化合物数据通过TCMSP共提取到骨碎补中有效化合物75种,以OB大于或等于30%及DL大于或等于0.18作为提取标准,筛选出活性化合物共18种,相关信息如表 1所示。
化合物-靶点网络中共计有185个节点(其中化合物节点共计有14个、靶点节点171个)和608条边,其中化合物分子以红色节点进行标注,药物靶点以蓝色节点进行标注,每条边代表化合物和靶点之间相关性,见图 1。其中共有4个化合物未进行网络构筑。在网络中,一个节点的度值的多少代表网络中节点之间相连边的数量。根据网络拓扑学的特点选取度值较大的节点进行探讨分析。表 2显示了化合物-靶点网络中的关键节点及其拓扑学性质。网络拓扑学相关结果如下:网络集中度:0.328,网络密度:0.018,网络异质性:2.340,最短路径:34040(100%)。平均度值结果:3.286486486,大于平均度值的节点共计24个;节点平均中介中心度:0.01225238,大于平均中介中心度的节点共计29个。根据节点的度值和中介中心度等拓扑学特征选用核心节点分析。这些联接化合物或靶点较多的节点在整个网络中甚至起到决定性的作用,可能是核心的化合物或靶点。

|
| 图 1 化合物-靶标关系图 Fig. 1 Compound-target relationship diagram |
网络拓扑学分析最后表明骨碎补的核心化合物有柚皮苷(naringenin)、圣草酚(eriodictyol)、山奈酚(kaempferol)等;重要的靶标有前列腺素G/H合成酶2(Prostaglandin G/H synthase 2)、Heat shock protein HSP 90、Caspase-3等。
柚皮苷(naringenin)是中药骨碎补中的最主要成分之一,其为一种黄酮类化合物[8],研究结果表明骨碎补中以柚皮苷为代表的黄酮类物质是一种类雌激素类的单体成分[9],具有代替传统雌激素药物在人体中发挥相应的生物学作用。Pang等[10]研究结果表明柚皮苷这一具有类雌激素作用的单体成分,可能是激活城固细胞上配体依赖性的雌激素受体,从而发挥其抗骨质疏松的作用,证明了柚皮苷在激素水平上抗骨质疏松的作用。Wu JB等[11]研究结果发现,柚皮苷可促进蛋白激酶B(Akt)的磷酸化、c-fos及c-jun的激活而促进BMP-2的表达,继而发挥抗骨质疏松的作用。Li等[12]提出,柚皮苷通过促进相关成骨细胞的分化、促进成骨细胞的骨钙蛋白表达,从而达到抗骨质疏松的作用。现代药理学研究结果证明[13],柚皮苷具有较强的抗炎作用,其抗炎机制可能是主要通过抑制核转录因子-κB(NF-κB)的表达,而NF-κB的表达对于炎症因子肿瘤坏死因子-α(TNF-α)、环氧合酶(COX-2)、白介素-6(IL-6)等均有促进作用。相关的动物实验结果也表明,柚皮苷能够显著减少外周血中的炎症因子含量,减少了TNF-α的表达[14]。
山奈酚(kaempferol)一种存在于多种中药材中的黄酮类化合物,具有抗氧化、抗炎、抗骨质疏松等多种生物功能[15]。相关研究结果表明,山奈酚对去卵巢大鼠具有较好的抗骨质疏松治疗作用,其研究发现山奈酚主要是通过抑制大鼠骨钙的流失及骨吸收关键酶的活性,从而起到抗骨质疏松作用[16]。通过抑制前列腺素G/H合成酶2(Prostaglandin G/H synthase 2)的产生或释放,也是抑制炎症反应的一种重要途径。最新的研究结果显示[17],许多植物药材的总黄酮等均可以降低炎症组织中前列腺素G/H合成酶2的含量,其作用亦与抑制炎症因子前列腺素G/H合成酶2的产生和释放有关。Cox团队研究结果发现[18],山奈酚可显著性抑制前列腺素G/H合成酶2的产生[19]。
前列腺素G/H合成酶2(Prostaglandin G/H synthase 2)是一个与细胞炎症反应的关键因素[20]。中性粒细胞调节炎症的其中一个机制是促进Prostaglandin G/H synthase 2的分泌[21]。前列腺素G/H合成酶2又称COX-2,是一种诱导性酶,在大多细胞中少量表达。当细胞受到促癌剂、促炎细胞因子等刺激时,COX-2表达会上调,进而参与炎症的发生和发展[22]。许多研究结果表明,下调COX-2可以减轻炎症反应[23-24]。
天冬氨酸特异性半胱氨酸蛋白酶-3 (Caspase-3)及天冬氨酸特异性半胱氨酸蛋白酶-9 (Caspase-9)的细胞凋亡活化复合体激活,其结果会导致细胞凋亡。天冬氨酸特异性半胱氨酸蛋白酶(Caspase)家族是软骨细胞凋亡调控的中心执行者[25]。Caspases是一种具有切割蛋白供血的生物酶,这种酶会引起细胞结构崩解,包括始动因子Caspase2、8、9及执行因子Caspase 3、6、7 [26],Caspase3被激活,细胞死亡将不可被逆转[27]。刘嘉眉等[28]探讨Caspase 3、9与绝经后骨质疏松症发病机制的影响的研究显示,在骨质疏松症组中的案例Caspase-3、Caspase-9含量增加,这表明在骨质疏松症组的成骨细胞凋亡过程中,Caspase依赖性凋亡途径激活。有相关研究结果表明[29],药物的干预可以诱导相关信号通路及Caspases的激活来引导软骨细胞的凋亡,这也可能提示笔者,可能骨碎补等中药或其单体成分是通过Caspase-3等执行因子的作用,诱导相关的细胞凋亡,如成骨细胞等,这可能会促进骨质疏松的进展,同时也给予相关研究者予提示,通过干预相关Caspase-3等执行因子或启动因子,从而起到阻断成骨细胞凋亡等作用,进而阻碍骨质疏松症的进展,起到抗骨质疏松的作用。另有研究显示,杜仲叶中的抗氧化活性物质,可通过抑制Caspases 3、9等的表达,拮抗H2O2诱导的前成骨细胞MC3T3-E的凋亡,从而起到促进抗骨质疏松的作用。经过生物信息学的分析,Caspase-3这一靶点占据重要的地位,可能骨碎补发挥类似杜仲通过抑制成骨细胞的凋亡,从而起到抗骨质疏松的作用。
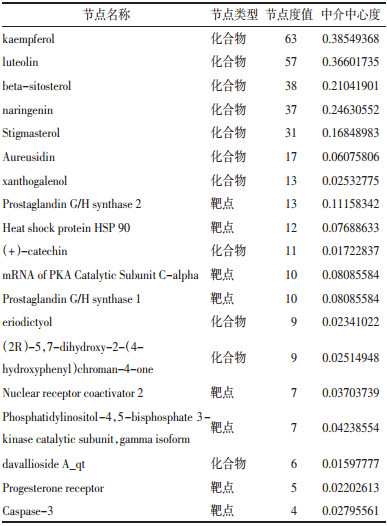
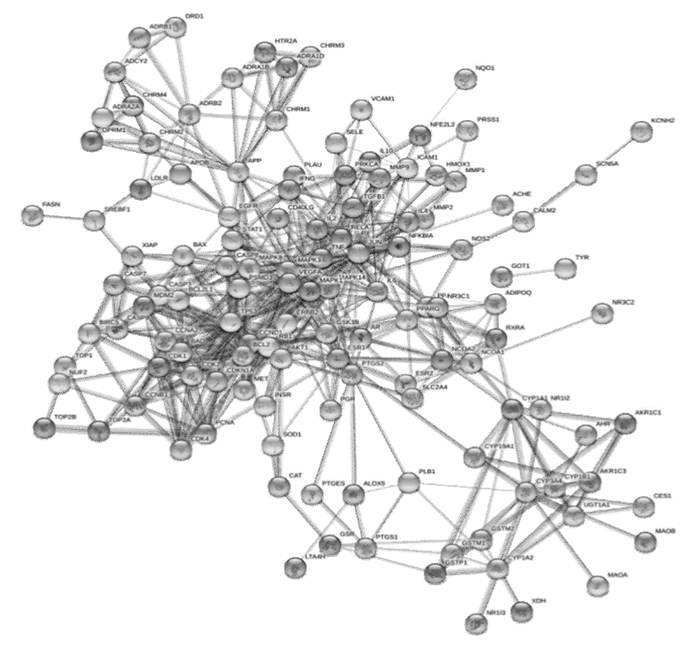
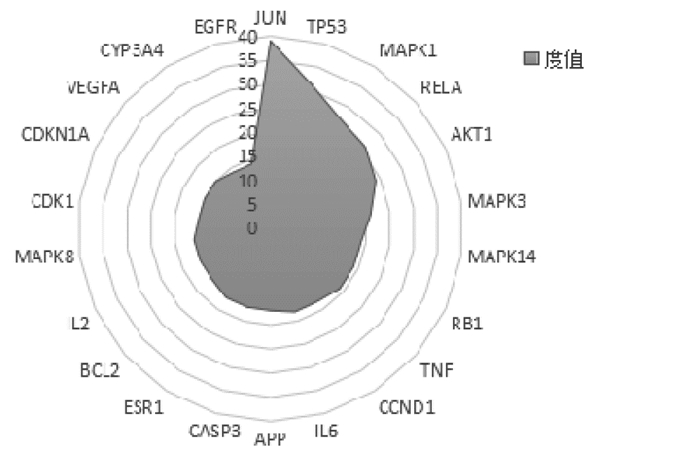
2.3 骨碎补PPI网络的构建与分析为了更好地理解与分析骨碎补的作用机制及原理,基于蛋白之间相互作用的关系,利用STRING构造了“骨碎补”相关靶标的蛋白互作网络图(见图 2)。设置置信度大于或等于0.90,去除孤立于网络的相关靶标蛋白,得到的PPI网络共计126个节点,1058条边,平均度值:8.396825,其中节点代表靶标蛋白,每条边表示靶标蛋白之间的关联性。根据节点的度值绘制大于平均度值且度值较高的22个关键蛋白质节点的表格和雷达图(见表 3和图 3)。度值较高的5位分别为JUN、TP53、MAPK1、RELA、AKT1。其中JUN度值(度值为39)高于其他节点,说明这个蛋白在网络中发挥了相对重要的作用,成为联通网络中其他节点的关键节点。
|
| 图 2 骨碎补靶蛋白互相作用网络图 Fig. 2 Target protein interaction network diagram of Gusuibu |
|
| 图 3 靶标蛋白频次雷达图 Fig. 3 Target protein frequency radar map |
PPI网络分析表明JUN、TP53、MAPK1、IL-6、ESR1等靶蛋白度值远高于其它。c-jun蛋白水平的循环变化在腺上皮细胞的增殖和凋亡中是显着的。c-jun蛋白的持续基质表达可以防止基质细胞在晚期分泌期进入细胞凋亡[30]。RelA/p65为NF-Kβ的亚单位,且在炎症反应及炎症反应相关疾病的过程中有着重要的影响。NF-κB能够引导单核巨噬细胞产生炎性细胞因子,如白细胞介素2、6、12等,从而引起强烈的炎症反应[31]。研究显示[32-33],外源性物质刺激生物体可以引起机体TNF-α和白细胞介素6等促炎因子的分泌,从而抗炎因子水平会降低,因而引起细胞因子水平的不平衡等,最终使得体内炎症的发生及发展。而近来的研究发现,骨质疏松的发生发展,与炎症的内在联系愈加紧密,LI-6、白介素-2(IL-2)等炎症因子均能促进破骨细胞分化,增强骨吸收,从而促使骨质疏松症的发生[34-36]。由此推测骨碎补可能是通过作用于JUN、RELA等靶蛋白,从而调整IL-2等促炎因子在体内的生物学活动,起到抗炎等生理功能,这与骨碎补在临床上与动物实验上应用于炎症的干预相一致,从机制理论和临床实际应用两个层面证实了其抗炎作用。
雌激素受体1基因(ESR1)位于人染色体6q21上,雌激素与雌激素受体(ER)相互结合,可以介导目标基因的表达,从而参与骨的重构,同时相关结果也表明,ESR1与骨密度关系密切[37]。另有研究结果发现[38],ESR1活化能够抑制相关通路的磷酸化,由此可以促进自噬、抑制凋亡,从而促进细胞增殖,从而维持或促进骨量或软骨的优势变化。骨丢失、骨质疏松的发生发展和雌激素受体α蛋白表达异常相关,因此雌激素受体α蛋白表达异常,也会影响到ER的相关生物学进程,进而对人体的骨密度产生影响,推动或阻断骨质疏松的发展进程[39]。Qu等[40]发现在成骨细胞上存在雌激素受体,在小鼠骨髓培养过程中,雌激素可通过ER依赖方式刺激成骨细胞的分化,从而起到抗骨质疏松的作用。Oreffo等[41]发现破骨细胞前体中有ESR1表达,但在破骨细胞成熟和进行骨吸收时ESR1表达消失,表明雌激素受体的表达和调控可能在破骨细胞的形成中发挥重要作用,对骨质疏松症的控制表现为抑制骨吸收,促进骨形成。
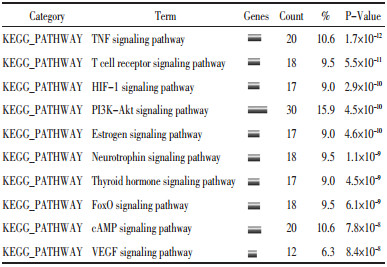
2.4 KEGG通路富集分析使用David v6.8数据库对骨碎补靶蛋白基因进行信息通路富集,结果共有139条生物信息通路,计算每条富集通路的P值(P值小于0.01为显著富集),去除部分具有普遍性和广泛性的生物学通路,提取与骨碎补治疗骨质疏松症相关的或有可能成为关键途径的生物学通路,并对其P值排序后取前10名进行分析。见表 4。
为了更深层次探究骨碎补作用靶点在生物信号通路层面的机制,文章利用KEGG通路富集对骨碎补靶标基因进行研究,结果表明具有显著统计学意义的10条相关通路分别是TNF signaling pathway、T cell receptor signaling pathway、HIF-1 signaling pathway、PI3K-Akt signaling pathway、Estrogen signaling pathway、Neurotrophin signaling pathway、Thyroid hormone signaling pathway、FoxO signaling pathway、cAMP signaling pathway、VEGF signaling pathway。由上述KEGG富集结果分析可知,骨碎补与TNF signaling pathway、PI3K-Akt signaling pathway、Estrogen signaling pathway、cAMP signaling pathway、VEGF signaling pathway等相关通路有较大联系。因此文章试图从以上几个主要方面进行机制探讨与分析,试图理解骨碎补在基因功能及信号通路层面的作用机制。
TNF signaling pathway经TNF与TNFR1结合而激活,激活的TNF信号通路可导致NF-κB核易位和JNK,p38,AP-1活化,促使促炎性细胞因子、趋化因子、生长因子和TNF-α本身等基因的表达[42]。近年来,许多研究认为,骨质疏松可能不仅与内分泌系统的紊乱,如雌激素缺乏等相关,同时也提出观点:骨质疏松症的生化进展与免疫系统功能失常而产生炎症反应有直接关系[34]。许多炎性细胞因子如TNF、NF-κB受体活化因子配体(RANKL)、IL-2、IL-6等参加了各类骨质疏松症的生化进展,同时发挥着关键的作用[43-44]。而炎性细胞因子促进骨吸收或降低骨形成来打破骨转换平衡,参与骨质疏松症的发生和发展,因此阻断炎症反应已成为防治骨质疏松的重要靶点与途径。在利用STRING10.5数据分析软件进行PPI分析时也发现,TNF、IL-6、IL-2、RELA等靶蛋白的度值比较高。因此,骨碎补可能是通过其独特的化合物或单体成分,通过TNF signaling pathway这一信号通路,发挥抗炎作用而起到抗骨质疏松的生化作用。
Estrogen signaling pathway亦可能是骨碎补发挥其抗骨质疏松作用的最重要通路之一。雌激素通过相关受体激活途径的调节机制成骨细胞上存在肿瘤坏死因子受体等,且在成骨细胞的功能发挥中起重要作用,TNF-α等均属于TNF超家族,许多实验表明[45]诱导活化成骨细胞胞膜上受体Fas等可诱导成骨细胞凋亡,因此骨碎补相关有效成分可能通过Estrogen signaling pathway减少成骨细胞胞膜上受体Fas等受体的活化,从而减少成骨细胞凋亡,至少阻断或延缓了骨质疏松平衡的加快打破。研究表明[45]成骨细胞上存在雌激素受体,在小鼠骨髓培养过程中,雌激素可通过ER依赖方式刺激成骨细胞的分化,从而起到抗骨质疏松的作用,因此骨碎补有关成分,可能是通过Estrogen signaling pathway调控相关成骨细胞上的ER,从而促进钙盐等的沉积,促进骨形成,从而起到抗骨质疏松的作用。
3 讨论文章运用系统药理学的方法对骨碎补的作用机制及原理进行分子机制、基因及信号通路等层面的分析,结果发现骨碎补在抗骨质疏松治疗方面具有很强的科学性,由化合物-靶标网络分析可知其可能是通过柚皮苷等黄酮等类雌激素类化合物发挥其抗骨质疏松的生物学作用。由PPI分析、David通路富集分析可知骨碎补在理论上具有从抗炎、内分泌系统等途径发挥抗骨质疏松的作用机制。此外,通过相关的生物学信息分析,笔者发现骨碎补与Neurotrophin signaling pathway、Thyroid hormone signaling pathway、FoxO signaling pathway等生物学通路关系密切,可能与骨质疏松有一定的关联,但目前关于这方面的研究尚少,因此骨碎补是否与以上通路存在一定的生物学联系以及在以上通路发挥抗骨质疏松的效用,尚需大量的临床、实验研究进行探索验证,同时本课题为以后基础实验及药物开发提供了一个新方向。
| [1] |
陈蔚文, 高学敏. 中药学[M]. 北京: 人民卫生出版社, 2012: 286.
|
| [2] |
Yuan L, Lin X, Xiong D, et al. Epidemiology and management of osteoporosis in the People s Republic of China:current perspectives[J]. Clinical Interventions in Aging, 2015, 10(1): 1017-1033. |
| [3] |
白璧辉, 谢兴文, 李鼎鹏, 等. 我国近5年来骨质疏松症流行病学研究现状[J]. 中国骨质疏松杂志, 2018, 24(2): 253-258. DOI:10.3969/j.issn.1006-7108.2018.02.024 |
| [4] |
Qiu Z, Dong X, Dai Y, et al. Discovery of a New Class of Cathepsin K Inhibitors in Rhizoma Drynariae as Potential Candidates for the Treatment of Osteoporosis[J]. International Journal of Molecular Sciences, 2016, 17(12): 2116. DOI:10.3390/ijms17122116 |
| [5] |
Cai YL, Zhang XC. Protective effect of Rhizoma Drynariae extract on osteoporosis in ovariectomized rat model[J]. Trop J Pharm Res, 2016, 15(7): 1447. DOI:10.4314/tjpr.v15i7.13 |
| [6] |
周喜玲, 朱爱英. 补肾壮骨中成药治疗绝经后骨质疏松症机理的临床研究[J]. 临床医学研究与实践, 2017, 35(2): 107-108. |
| [7] |
谢燕, 马越鸣, 王长虹, 等. 改善中药制剂口服生物利用度的研究概况与思考[J]. 国际药学研究杂志, 2011, 38(3): 195-200. |
| [8] |
宋双红, 余倩, 王喆之, 等. 骨碎补防治骨质疏松研究概况[J]. 生命的化学, 2015, 35(1): 73-80. |
| [9] |
高颖, 房德敏. 骨碎补黄酮类化合物的研究进展与开发前景[J]. 中草药, 2009, 40(2): 323-326. DOI:10.3321/j.issn:0253-2670.2009.02.050 |
| [10] |
Pang WY, Wang XL, Mok SK, et al. Naringin improves bone properties in ovariectomized mice and exerts oestrogen-like activities in rat osteoblast-like (UMR-106) cells[J]. Bri J Pharm, 2010, 159(8): 1693. DOI:10.1111/j.1476-5381.2010.00664.x |
| [11] |
Wu JB, Fong YC, Tsai HY, et al. Naringin-induced bone morphogenetic protein-2 expression via PI3K, Akt, c-Fos/c-Jun and AP-1 pathway in osteoblasts[J]. Eur J Pharmacol, 2008, 688(2-3): 333-341. |
| [12] |
Li N, Jiang Y, Wooley PH, et al. Naringin promotes osteoblast differentiation and effectively reverses ovariectomy-associated osteoporosis[J]. J Orthop Sci, 2013, 18(3): 478. DOI:10.1007/s00776-013-0362-9 |
| [13] |
Kawaguchi K, Maruyama H, Hasunuma R, et al. Suppression of inflammatory responses after onset of collagen induced arthritis in mice by oral administration of the Citrus flavanone naringin[J]. Immunopharmacol Immunotoxicol, 2011, 33(4): 723-729. DOI:10.3109/08923973.2011.564186 |
| [14] |
殷方明, 肖涟波, 张昀. 骨碎补柚皮苷对炎症及骨作用的相关研究进展[J]. 中国骨伤, 2015, 28(2): 182-186. DOI:10.3969/j.issn.1003-0034.2015.02.020 |
| [15] |
张雅雯, 邵东燕, 师俊玲, 等. 山奈酚生物功能研究进展[J]. 生命科学, 2017, 29(4): 400-405. |
| [16] |
Serra D, Rufino AT, Mendes AF, et al. Resveratrol modulates cytokine-induced JAK/STAT activation more efficiently than 5-aminosalicylic acid:an in vitro approach[J]. PLoS One, 2014, 9(10): e109048. DOI:10.1371/journal.pone.0109048 |
| [17] |
SKim SH, Park JG, Lee J, et al. The Dietary flavonoid kaempferol mediates anti-inflammatory responses via the Src, Syk, IRAK1, and IRAK4 molecular targets[J]. Mediators of Inflammation, 2015, 26(1): 1-15. |
| [18] |
Cox DG, Crusius JB, Peeters PH, et al. Haplotype of prostaglandin synthase 2/cyclooxygenase 2 is involved in the susceptibility to inflammatory bowel disease[J]. World J Gastroenterol, 2005, 11(38): 6003-6008. DOI:10.3748/wjg.v11.i38.6003 |
| [19] |
Fasano MB, Wells JD, Mccall CE. Human neutrophils express the prostaglandin G/H synthase 2 gene when stimulated with bacterial lipopolysaccharide[J]. Clin Immunol Immunopathol, 1998, 87(3): 304-308. DOI:10.1006/clin.1998.4545 |
| [20] |
刘智豪, 刘叔文, 余乐. COX-2抑制剂联合抗肿瘤的研究进展[J]. 中国药理学通报, 2012, 28(12): 1651-1654. |
| [21] |
黄小华, 孙永, 沈能, 等. 双亲姜黄素衍生物减轻大鼠肝纤维化与抗炎抗氧化作用的研究[J]. 中国药理学通报, 2015, 31(4): 470-475. DOI:10.3969/j.issn.1001-1978.2015.04.007 |
| [22] |
王斌, 曹慧, 沈甜, 等. 麝香、冰片对大鼠脑缺血-再灌注急性期和恢复早期炎性损伤的保护作用及机制研究[J]. 中药材, 2015, 38(10): 2139-2143. |
| [23] |
张红莲, 王雅楠, 王建华. 补骨脂的化学成分及药理活性研究概况[J]. 天然产物研究与开发, 2010, 22(5): 909-913. DOI:10.3969/j.issn.1001-6880.2010.05.039 |
| [24] |
邱蓉丽, 李璘, 乐巍. 补骨脂的化学成分与药理作用研究进展[J]. 中药材, 2010, 33(10): 1656-1659. |
| [25] |
袁长青, 丁振华. Caspase的活化及其在细胞凋亡中的作用[J]. 生理科学进展, 2002, 46(3): 220-224. DOI:10.3321/j.issn:0559-7765.2002.03.006 |
| [26] |
Allen MR. The effects of bisphosphonates on jaw bone remodeling, tissue properties, and extraction healing[J]. Odontology, 2011, 99(1): 8-17. DOI:10.1007/s10266-010-0153-0 |
| [27] |
Hengartner MO. The biochemistry of apoptosis[J]. Nature, 2000, 407(6805): 770-776. DOI:10.1038/35037710 |
| [28] |
刘嘉眉, 李颖. 成骨细胞中Caspase蛋白和Bcl-2蛋白在绝经后骨质疏松症发病机理中的作用[J]. 中华关节外科杂志(电子版), 2015, 9(6): 780-783. DOI:10.3877/cma.j.issn.1674-134X.2015.06.017 |
| [29] |
周琦, 魏立, 江莉婷, 等. 利塞膦酸钠干预骨质疏松模型大鼠髁突软骨Bcl-2、Bax及Caspase3的表达[J]. 中国组织工程研究, 2016, 20(27): 3970-3976. DOI:10.3969/j.issn.2095-4344.2016.27.003 |
| [30] |
Udou T, Hachisuga T, Tsujioka H, et al. The role of c-jun protein in proliferation and apoptosis of the endometrium throughout the menstrual cycle[J]. Gynecologic & Obstetric Investigation, 2004, 57(3): 121-126. |
| [31] |
Leng CH, Chen HW, Chang LS, et al. A recombinant lipoprotein containing an unsaturated fatty acid activates NF-kappaB through the TLR2 signaling pathway and induces a differential gene profile from a synthetic lipopeptide[J]. Molecular Immunology, 2010, 47(11-12): 2015-2021. DOI:10.1016/j.molimm.2010.04.012 |
| [32] |
凌娜, 陈莹. 妇炎宁汤对慢性盆腔炎大鼠模型体内TNF-α影响[J]. 辽宁中医药大学学报, 2013, 15(5): 110-112. |
| [33] |
王莉, 吕耀凤, 姚丽娟. 慢性盆腔炎患者促炎因子与抗炎因子的关系[J]. 中国妇幼保健, 2012, 27(33): 5292-5294. |
| [34] |
杨远超, 王颖, 方志远, 等. 抗炎产生抗骨质疏松作用的植物[J]. 中国组织工程研究, 2018, 22(4): 638-643. |
| [35] |
钱兴皋, 刘宇恒, 王琴, 等. 炎症因子对骨质疏松症发病影响的研究进展[J]. 中国康复理论与实践, 2013, 19(7): 645-646. DOI:10.3969/j.issn.1006-9771.2013.07.013 |
| [36] |
Braidman I, Banis C, Wood L, et al. Preliminery evidence for impaired estrogen receptor-alpha protein expression in osteblasts and osteocytes from men with idiopathic osteoporosis[J]. Bone, 2000, 26(5): 423. DOI:10.1016/S8756-3282(00)00246-5 |
| [37] |
Edwards CJ. The role of interleukin-6 in rheumatoid arthritis-associated osteoporosis[J]. Osteoporos Int, 2010, 21(8): 1287-1293. DOI:10.1007/s00198-010-1192-7 |
| [38] |
刘敏, 谢巍伟, 郑维, 等. 雌二醇与ESR1靶向结合通过ERK信号通路调控软骨细胞的增殖[J]. 南方医科大学学报, 2019, 39(2): 134-143. |
| [39] |
张月红. 骨质疏松发病机制研究进展[J]. 解放军预防医学杂志, 2004, 22(2): 151-153. DOI:10.3969/j.issn.1001-5248.2004.02.035 |
| [40] |
Qu Q, Perala HM, Kapanen A, et al. Estrogen enhances differentiation of osteoblast in mouse bone marrow culture[J]. Bone, 1998, 22(3): 201. DOI:10.1016/S8756-3282(97)00276-7 |
| [41] |
Oreffo RO, Kusec V, Virdi AS, et al. Expression of estrogen receptor-α in cells of the osteoclastic lineage[J]. Histochem Cell Biol, 1999, 111(2): 125. DOI:10.1007/s004180050342 |
| [42] |
Varfolomeev E, Goncharov T, Maecker H, et al. Cellular inhibitors of apoptosis are global regulators of NF-kappaB and MAPK activation by members of the TNF family of receptors[J]. Sci Signal, 2012, 5(216): a22. |
| [43] |
Blumenfeld O, Williams FM, Valdes A, et al. Association of interleukin-6 gene polymorphisms with hand osteoarthritis and hand osteoporosis[J]. Cytokine, 2014, 69(1): 94-101. DOI:10.1016/j.cyto.2014.05.012 |
| [44] |
Ivanova JT, Boyanov MA, Toshev AK. Polymorphisms of the human IL-1 receptor antagonist gene and forearm bone mineral density in postmenopausal women[J]. Indian J EndocrMetab, 2012, 16(4): 580-584. DOI:10.4103/2230-8210.98015 |
| [45] |
李传洁, 李亚男. 雌激素通过信号通路对成骨细胞分化、成熟与凋亡的调控[J]. 口腔颌面修复学杂志, 2013, 14(6): 361-365. DOI:10.3969/j.issn.1009-3761.2013.06.011 |
2. Guangdong Academy of Traditional Chinese Medicine, Research Team on Bone and Joint Degeneration and Injury, Guangzhou 510120, China;
3. Second Affiliated Hospital of Guangzhou University of Traditional Chinese Medicine, Guangzhou 510120, China
 2019, Vol. 36
2019, Vol. 36