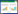文章信息
- 李丽, 顾文燕, 姜红
- LI Li, GU Wenyan, JIANG Hong
- 萝卜硫素介导Wnt/β-catenin信号通路诱导胃癌细胞凋亡的研究
- Study on the apoptosis of gastric cancer cells induced by sulforaphane mediated Wnt/β-catenin signaling pathway
- 天津中医药, 2019, 36(11): 1133-1136
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(11): 1133-1136
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.11.25
-
文章历史
- 收稿日期: 2019-07-25
萝卜硫素(Sulforaphane)是一种从十字花科植物中提取的异硫氰酸盐,易溶于水,还易溶于二氯甲烷和乙酸乙酯,沸点较高,还易被氧化降解,并且萝卜硫素在抗肿瘤、抗氧化、抗炎及免疫调节等方面具有较强的药理作用[1-4]。前期研究发现萝卜硫素主要通过激活胃癌细胞Ⅱ型解毒酶的生成发挥抗肿瘤作用[5]。萝卜硫素还能通过抑制炎症蛋白表达来降低胃癌细胞的生长和侵袭[6]。近期研究也提出萝卜硫素可通过影响MAPK信号通路活化诱导胃癌细胞凋亡[7-8]。相关报道提出对胃癌细胞内Wnt/β-catenin信号通路进行阻断,能抑制胃癌细胞的增殖并诱导其凋亡[9-10],然而关于萝卜硫素诱导胃癌细胞凋亡是否通过作用Wnt/β-catenin信号通路,目前尚不清楚。胃癌在中国的发病率及死亡率较高,主要是术后肿瘤细胞转移及复发风险较高,因此寻找安全有效的药物对胃癌进行预防及治疗迫在眉睫。基于萝卜硫素在抗肿瘤方面具有明显的药理活性,文章研究了萝卜硫素对胃癌细胞增殖的抑制作用及其作用机制,以期为临床应用提供理论参考。因此,笔者将以胃癌SGC-7901细胞内Wnt/β-catenin信号通路关键蛋白β-catenin、GSK-3β、TCF4 /LEF为主要研究对象,阐述萝卜硫素诱导胃癌细胞凋亡的作用机制。
1 材料及方法 1.1 胃癌细胞SGC-7901细胞株由武汉巴菲尔生物有限公司提供(来源于美国ATCC细胞库)。
1.2 仪器DNM-9602G酶标仪(美国Thermo公司);DYY-6C电泳仪(北京六一仪器厂);5000 Plus凝胶成像系统(美国ProteinSimple公司);H2050R型台式冷冻高速离心机(德国EPPENDORF公司);BBS-V800型单人超净台(山东鑫贝西公司);SPX-250型细胞培养箱(美国Thermo公司)。
1.3 药物与试剂萝卜硫素(山东绿叶制药,批号H2011265418,纯度≥98%);胎牛血清、RMPI-1640培养基及0.25%胰蛋白酶购自英国Abcam公司;鼠抗β-catenin、GSK-3β、c-Myc及Caspase3抗体购自英国Abcam公司;CCK8试剂盒购自北京智杰方远科技有限公司(批号:CK57);Annexin V/PI凋亡试剂盒购自北京庄盟国际生物基因科技有限公司;荧光素酶报告基因试剂盒购自New England Biolabs(Beijing)公司。
1.4 细胞培养采用1640完全培养基培养SGC-7901细胞,条件为37℃、5%CO2浓度的恒湿培养箱,用0.25%胰酶-EDTA消化传代培养。当细胞生长状态良好时,取对数生长期细胞用于后续实验。
1.5 CCK8实验取对数生长期细胞消化、计数,以5×104个/mL细胞密度接种于96孔板中,培养过夜,然后用10、20、40 μmol/L萝卜硫素处理细胞24、48、72 h后吸去旧培养基,每孔加入10 μL的CCK8试剂,继续培养2 h后,在450 nm波长处检测每孔吸光度OD值,并计算细胞增殖抑制率。细胞增殖抑制率(%)=(1-药物组OD值/对照组OD值)×100%。
1.6 细胞凋亡检测取对数生长期细胞消化、重悬、计数后,以1×105/mL的浓度接种于6孔板,培养24 h后,加入10、20、40 μmol/L萝卜硫素干预细胞24 h后,收集细胞,先用预冷的PBS清洗细胞2遍,然后分别加入Annexin-V FITC和PI处理细胞(按照试剂盒操作说明书进行),最后用流式细胞仪分析细胞周期。
1.7 荧光素酶报告基因实验把对数生长期细胞接种于T25培养瓶,贴壁后用Lipofectamine转染LEF/TCF4报告质粒(pTOP-Luc)3 μg,4 h后换液。12 h后将细胞消化接种于24孔板中,贴壁后加入10、20、40 μmol/L萝卜硫素进行干预。24 h后收集细胞裂解,按试剂盒操作说明书测定荧光素酶活性。
1.8 蛋白表达检测按照“1.6”项处理完细胞后,收集细胞裂解、超声破碎、12 000 r/min离心12 min后收集上清,BCA试剂盒测定上清蛋白浓度。每个样本上样50 μg进行凝胶电泳,待蛋白完全分离后进行转膜实验。结束后加入5%脱脂奶粉封闭液于摇床上室温封闭1 h后,分别加入β-catenin、GSK-3β、c-Myc及Caspase3抗体(体积稀释比例均为1:1 000)4 ℃反应过夜。次日TBST洗膜3次后加入HRP标记的山羊抗兔IgG(体积稀释比例为1:3 000),室温反应1 h。再用TBST洗膜3次,每次10 min,以ECL试剂显影后进行蛋白条带灰度值分析。
1.9 数据分析采用SPSS 20.0软件统计,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,重复测量资料采用重复测量设计方差分析,组间两两比较采用Bonferroni分析,P<0.05为差异具有统计学意义。
2 结果 2.1 萝卜硫素对SGC-7901细胞增殖抑制率的影响经过10、20、40 μmol/L萝卜硫素干预SGC-7901细胞24、48、72 h后增殖抑制率比较结果见表 1。萝卜硫素干预24、48、72 h后,与对照组比较,低、中、高剂量萝卜硫素组SGC-7901细胞抑制率明显升高,并且各药物组之间细胞抑制率存在显著性差异(P<0.05),呈现出剂量依赖性;在同一药物浓度条件下,相比于药物处理24 h,药物干预48和72 h后细胞增殖抑制率也明显升高,且各时间点之间差异均有显著性(P<0.05),表现出时间依赖性。
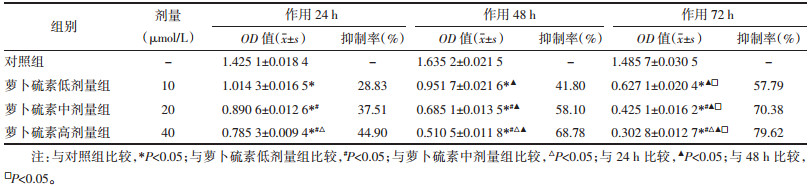
流式细胞仪检测了萝卜硫素对SGC-7901细胞周期的影响,见表 2、图 1。结果提示SGC-7901细胞经萝卜硫素干预后,处于G0/G1期的细胞数显著增多,而S期及G2/M期细胞数相对减少,由此说明萝卜硫素能诱导SGC-7901细胞凋亡。
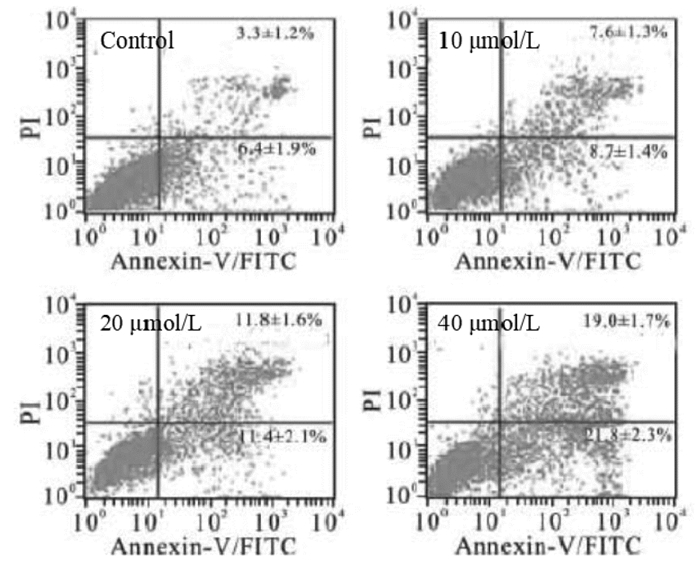
|
| 图 1 各组间细胞凋亡率比较 Fig. 1 Comparison of cell apoptotic rates in each group |
与对照组(1.00±0.00)比较,10、20、40 μmol/L萝卜硫素组TCF4/LEF转录活性[(0.72±0.21)、(0.51±0.17)、(0.37±0.28)]随药物剂量升高呈逐渐下降的趋势,差异有显著性(F=521.357,P=0.000)。结果提示萝卜硫素能显著抑制TCF4/LEF转录活性,还表现出浓度依赖性,说明萝卜硫素可显著抑制Wnt /β-catenin信号的传导。
2.4 萝卜硫素对促凋亡蛋白及Wnt/β-catenin通路蛋白的影响各组间胃癌SGC-7901细胞中β-catenin、GSK-3β、c-Myc及Caspase3蛋白表达水平比较见图 2,结果提示不同剂量萝卜硫素均能抑制β-catenin及c-Myc蛋白表达,而诱导GSK-3β及Caspase3蛋白表达,并且它们的表达水平与对照组相比,差异具有统计学意义(P<0.05)。
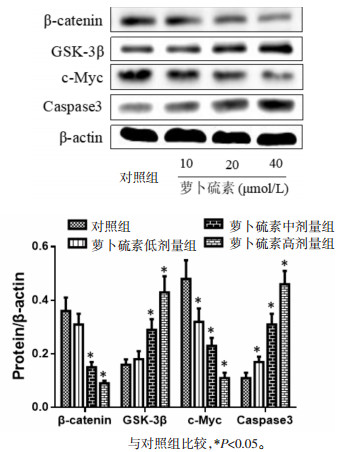
|
| 图 2 各组间β-catenin、GSK-3β、c-Myc及Caspase3蛋白表达水平比较 Fig. 2 Comparison of expression levels of β-catenin, GSK- 3β, c-Myc and Caspase3 proteins in each group |
对于胃癌发病机制的研究还存在较大争议,目前对于胃癌的治疗手段以手术为主,然而术后化疗药物不仅疗效不佳,还会导致病灶周围正常组织的损伤,进而诱发免疫功能紊乱[11-12]。因为目前缺少对胃癌患者早期诊断的标志物,大多数患者确诊后处于中晚期,术后患者又会出现肿瘤细胞转移、复发及化疗药物带来的不良反应,极大降低了患者的生存质量。随着物质生活水平的提升,胃癌患病率也在不断提升,所以提高临床诊断率、早期干预、改善患者术后生存质量是急需解决的问题[13-15]。因此,寻找对胃癌药理作用较强的天然活性成分已成为目前研究的热点。
萝卜硫素是十字花科植物中的一种天然活性成分,对多种肿瘤细胞增殖均表现出较强的抑制作用,其中包括胃癌细胞[5-8];但是萝卜硫素是通过何种机制作用于胃癌细胞的研究较少。萝卜硫素具有毒副作用低、不产生交叉耐药的特点,能够联合其他药物进行治疗患者,可能成为辅助治疗肿瘤的新药。前期有相关报道提出萝卜硫素可通过Wnt /β-catenin信号通路下调miR-211表达,从而诱导胶质母细胞瘤的凋亡[16];还提出萝卜硫素可通过抑制Wnt /β-catenin信号传导增强伊马替尼对慢性白血病癌症干细胞治疗的有效性[17]。文章实验结果发现萝卜硫素对胃癌SGC-7901细胞的增殖有显著的抑制作用,且能诱导SGC-7901细胞的早期凋亡,进一步研究发现其作用机制可能与抑制Wnt /β-catenin信号通路有关。
Wnt/β-catenin信号通路中的正性调节因子是β-catenin,主要表达于细胞膜,维持同型细胞间的黏连;然而磷酸化肌醇3激酶β(GSK-3β)为Wnt信号通路的负性调控因子,可与Axin、APC等形成复合体诱导β-catenin的磷酸化,导致β-catenin很快被蛋白酶体水解,进而保证β-catenin在生理条件下的低表达状态。文章研究也发现萝卜硫素能呈浓度依赖性的抑制β-catenin及c-Myc蛋白表达,而诱导GSK-3β及Caspase3蛋白表达,说明萝卜硫素可以抑制Wnt/β-catenin信号通路活化达到降低胃癌细胞增殖的效果。当前β-catenin已成为治疗胃癌药物的重要靶点之一[9],关于β-catenin信号传导的探讨较多集中于β-catenin的表达及其转核,对其下游转录因子TCF4/LEF的研究甚少。本文荧光素酶报告基因实验结果提示萝卜硫素能呈剂量依赖性的显著抑制TCF4/LEF转录活性,从而抑制Wnt/β-catenin信号传导。总之,萝卜硫素能明显抑制SGC-7901细胞增殖,并诱导其凋亡,可能作用机制与抑制Wnt /β-catenin信号通路有关。
| [1] |
Tortorella SM, Royce SG, Licciardi PV, et al. Dietary sulforaphane in cancer chemoprevention:the role of epigenetic regulation and HDAC inhibition[J]. Antioxid Redox Signal, 2015, 22(16): 1382-1424. DOI:10.1089/ars.2014.6097 |
| [2] |
Nallasamy P, Si H, Babu PV, et al. Sulforaphane reduces vascular inflammation in mice and prevents TNF-α-induced monocyte adhesion to primary endothelial cells through interfering with the NF-κB pathway[J]. J Nutr Biochem, 2014, 25(8): 824-833. DOI:10.1016/j.jnutbio.2014.03.011 |
| [3] |
Li B, Kim DS, Yadav RK, et al. Sulforaphane prevents doxorubicin-induced oxidative stress and cell death in rat H9c2 cells[J]. Int J Mol Med, 2015, 36(1): 53-64. DOI:10.3892/ijmm.2015.2199 |
| [4] |
Park JH, Kim JW, et al. Sulforaphane inhibits the Th2 immune response in ovalbumin-induced asthma[J]. BMB Rep, 2012, 45(5): 311-316. DOI:10.5483/BMBRep.2012.45.5.311 |
| [5] |
Chen CT, Hsieh MJ, Hsieh YH, et al. Sulforaphane suppresses oral cancer cell migration by regulating cathepsin S expression[J]. Oncotarget, 2018, 9(25): 17564-17575. |
| [6] |
贺云冲, 贾侃, 王川, 等. 西兰花提取物萝卜硫素抑制胃癌和胰腺癌的生长与侵袭[J]. 科技通报, 2015, 31(9): 62-68. DOI:10.3969/j.issn.1001-7119.2015.09.014 |
| [7] |
Choi YH. ROS-mediated activation of AMPK plays a critical role in sulforaphane-induced apoptosis and mitotic arrest in AGS human gastric cancer cells[J]. Gen Physiol Biophys, 2018, 37(2): 129-140. DOI:10.4149/gpb_2017026 |
| [8] |
Mondal A, Biswas R, Rhee YH, et al. Sulforaphene promotes Bax/Bcl2, MAPK-dependent human gastric cancer AGS cells apoptosis and inhibits migration via EGFR, p-ERK1/2 down-regulation[J]. Gen Physiol Biophys, 2016, 35(1): 25-34. |
| [9] |
李康, 旦增. Wnt/β-catenin信号与胃癌防治研究进展[J]. 南方医学大学学报, 2014, 34(12): 1852-1856. |
| [10] |
贾永森, 江春花, 韩炳生, 等. 通芪方对胃癌MGC803细胞周期和Wnt/β-catenin信号通路的影响[J]. 中华中医药学刊, 2016, 34(5): 1126-1129. |
| [11] |
吴异兰, 郑国华, 庞书勤, 等. 白藜芦醇预防性给药对胃癌大鼠血清PG及相关细胞因子水平的影响[J]. 长江大学学报自然科学版:医学下旬, 2014, 13(10): 3-6. |
| [12] |
刘庆生, 蔡丹莉, 陈芝芸, 等. 益气活血方对胃癌前病变大鼠NF-κB、cyclinD1和p16表达的影响[J]. 中华中医药学刊, 2014, 34(8): 1979-1982. |
| [13] |
陈宗营. 胃癌的发病机制及治疗的研究进展[J]. 社区医学杂志, 2012, 10(4): 56-58. |
| [14] |
王婕敏, 林三仁. 胃癌研究及诊治新进展[J]. 胃肠病学和肝病学杂志, 2012, 21(1): 3-5. DOI:10.3969/j.issn.1006-5709.2012.01.002 |
| [15] |
廖毅, 邓媛, 傅建伟. 胃癌分子机制的研究进展[J]. 中国肿瘤, 2014, 23(4): 58-62. |
| [16] |
Lan F, Pan Q, Yu H, et al. Sulforaphane enhances temozolomide-induced apoptosis because of down-regulation of miR-21 via Wnt/β-catenin signaling in glioblastoma[J]. J Neurochem, 2015, 134(5): 811-818. DOI:10.1111/jnc.13174 |
| [17] |
Lin LC, Yeh CT, Kuo CC, et al. Sulforaphane potentiates the efficacy of imatinib against chronic leukemia cancer stem cells through enhanced abrogation of Wnt/β-catenin function[J]. J Agric Food Chem, 2012, 60(28): 7031-7039. DOI:10.1021/jf301981n |
 2019, Vol. 36
2019, Vol. 36