1. 天津市医药科学研究所, 天津 300020;
2. 天津同仁堂集团股份有限公司, 天津 300385;
3. 中山市中医院, 中山 528400
收稿日期:2019-07-24
基金项目:天津市卫生和计划生育委员会中医中西医结合科研课题(2017082);广东省中医药局科研课题(20182166)
作者简介:王宏(1986-), 女, 硕士, 助理研究员, 主要从事心脑血管药理研究.
天津同仁堂冠脉通片是治疗冠心病的中成药,由补肾与活血开窍方药构成,淫羊藿、桑寄生温补肾阳,枸杞子、何首乌滋补肝肾,红花活血通经,丹参活血祛瘀,石菖蒲、冰片醒神开窍,共奏补肾活血之功,用于肝肾不足、痰瘀阻络之胸痹。然而以往研究仅局限在对心肌和冠状动脉的改善作用观察[1-2],进一步挖掘冠脉通片“补肾活血”中医治则对明确其临床定位具有重要意义。
血管钙化是慢性肾病(CKD)患者严重并发症,是导致CKD患者心血管疾病发病率和病死率明显升高的重要原因[3]。CKD血管钙化属于异位钙化,是由肾脏损及心血管的病理变化[4],对应中医“肾虚血瘀”证候[5-6],与冠脉通片补肾活血法的证治范围非常符合。因此,本实验通过建立CKD血管钙化大鼠模型,观察冠脉通片对CKD血管钙化的防治作用,为突显冠脉通片“补肾活血”的证治特色提供有力的研究手段。
1 材料
1.1 实验动物
SPF级雄性SD大鼠60只,体质量160~180 g,购自北京维通利华实验动物技术有限公司[动物合格证编号:SCXK(京)2016-0006]。5只/笼饲养于屏障环境,室温(23±2)℃、相对湿度40%~70%,自由饮水,饲料由北京科澳协力饲料有限公司提供[许可证号:SCXK(京)2014-0010]。
1.2 实验药物
冠脉通片:0.3 g/片,由天津同仁堂集团股份有限公司提供(批号HP06001);维生素D滴剂(VD3,胶囊型):400 U/粒,由国药控股星鲨制药(厦门)有限公司生产(批号12973038);维生素B4片:10 mg/片,由天津力生制药股份有限公司生产(批号1608008)。
1.3 试剂及仪器
磷酸二氢钠(批号2017年7月5日)购自天津市风船化学试剂科技有限公司,总蛋白定量测试盒[二喹啉甲酸(BCA)法,货号A045-3]、钙试剂盒(货号C004-1)均购自南京建成生物工程研究所。
日立7080全自动生化仪(日本积水医疗科技有限公司),XHF-1高速分散器(上海金达生化仪器厂],PL203电子天平[梅特勒-托利多仪器(上海)有限公司],LDZ5-2低速自动平衡离心机(北京京立离心机有限公司),Infinite M200多功能酶标仪(瑞士Tecan公司),ASP200S自动真空组织脱水机、EG1150H自动生物组织包埋机、RM2255切片机(德国Leica公司),Ci-L显微镜(日本Nikon公司)。
2 方法
2.1 动物分组及给药
将雄性SD大鼠按体质量随机分为5组:正常组、模型组、VD3组(10 μL/只,相当于人用剂量的6倍)、冠脉通片0.46、0.23 g/kg组(相当于人用剂量的6、3倍),每组12只(2只备用)。造模当天开始给药,给药体积10 mL/kg,每日1次,连续10周。
2.2 CKD血管钙化模型的建立
除正常组外,其余4组灌胃给予腺嘌呤200 mg/kg加高磷饮水制备CKD血管钙化模型。分组当天开始灌胃给予腺嘌呤溶液,给药体积10 mL/kg,每日1次,连续10周。正常组以等量纯净水对照处理。除正常组给予普通饮水外,其余4组均给予高磷饮水(0.5 g/只,2.5 g溶入500 mL饮用水中),每笼每日1瓶,连续10周。以硝酸银染色观察到血管钙化灶作为模型成立的评价标准。
2.3 指标检测
2.3.1 血清生化指标
大鼠腹主动脉取血,冰上静置1 h,3 000 r/min离心10 min取血清,酶联免疫吸附法测定血清尿素、肌酐、钙和磷的水平。
2.3.2 血管钙含量测定
剖取大鼠腹主动脉,生理盐水洗去血液,剔净脂肪。准确称取动脉组织(0.050±0.001)g,加入9倍体积生理盐水,冰水浴条件下机械匀浆。2 500 r/min离心10 min取上清液,得10%组织匀浆。取20 μL 10%组织匀浆再用生理盐水按1:9稀释成1%组织匀浆,按总蛋白定量测试盒测总蛋白浓度;另取60 μL 10%组织匀浆按钙测试盒说明书测定钙含量。
2.3.3 肾脏和血管组织学病理检测
剖取大鼠肾脏和胸主动脉,生理盐水洗去血液,10%中性甲醛固定。苏木精-伊红(HE)染色观察肾脏和血管组织的病理改变情况。
2.3.4 硝酸银染色观察血管钙化
剖取大鼠胸主动脉,生理盐水洗去血液,10%中性甲醛固定。硝酸银染色观察血管钙化灶。
2.4 统计学方法
采用SPSS 20.0软件分析实验数据,计量资料采用均数±标准差(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P < 0.05为差异有统计学意义。
3 结果
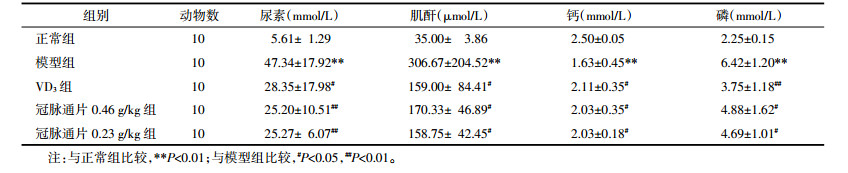
3.1 冠脉通片对大鼠血清尿素、肌酐、钙和磷水平的影响
表 1显示,与正常组大鼠相比,模型组大鼠血清尿素、肌酐及磷水平明显升高(P < 0.01),钙水平明显降低(P < 0.01)。灌胃给药10周后,冠脉通片0.46、0.23g/kg组能显著降低模型大鼠血清尿素、肌酐及磷的含量(P < 0.01或P < 0.05),升高钙含量(P < 0.05),与VD3组比较,冠脉通片高、低剂量组未见统计学差异。
表 1 冠脉通片对大鼠血清尿素、肌酐、钙和磷水平的影响(x±s)
Tab. 1
Effects of Guanmaitong Tablets on serum urea, creatinine, calcium and phosphorus levels in rats (x±s)
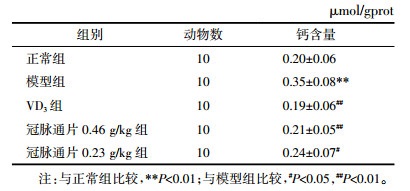
3.2 冠脉通片对大鼠腹主动脉钙含量的影响
表 2显示,与正常组比较,模型组大鼠腹主动脉钙含量明显升高(P < 0.01);与模型组相比,冠脉通片0.46、0.23 g/kg组腹主动脉钙含量显著降低(P < 0.01或P < 0.05);与VD3组比较,冠脉通片高、低剂量组未见统计学差异。
表 2 冠脉通片对大鼠腹主动脉钙含量的影响(x±s)
Tab. 2
Effect of Guanmaitong Tablets on calcium content in rats abdominal aorta (x±s)
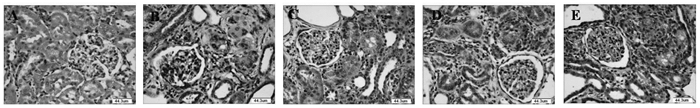
3.3 冠脉通片对大鼠肾组织病理学的影响
正常组大鼠肾小球数目正常,未见纤维化及新月体等病变,肾小管上皮完好,未见变性、坏死及管型,肾间质未见炎症细胞浸润及纤维化。模型组肾小球结构紊乱,肾小管扩张,局部见棕褐色结晶沉积,肾脏间质弥漫淋巴和单核细胞浸润,大量成纤维细胞增生,形成广泛纤维化,肾脏血管明显减少。冠脉通片较模型组正常肾小球数目增多,肾小管扩张程度降低,炎性细胞数量下降,腺嘌呤结晶减少。其中,冠脉通片0.46 g/kg组效果更好。
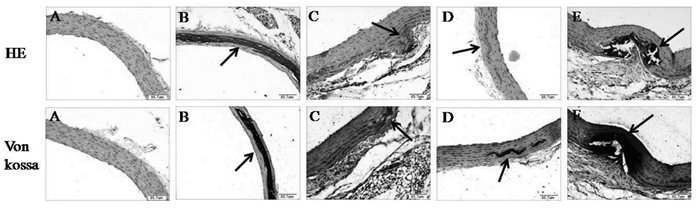
3.4 冠脉通片对大鼠胸主动脉血管钙化的影响
图 2显示,正常组大鼠胸主动脉内膜完整、中膜无异常;CKD血管钙化模型大鼠是钙化异位到胸主动脉,中膜可见明显的钙化结节且呈连续线性分布,硝酸银染色后可见黑色钙化灶呈连续性分布于胸主动脉。冠脉通片0.46、0.23 g/kg组大鼠胸主动脉钙化灶面积缩小,其中冠脉通片0.46 g/kg组效果更好。
4 讨论
CKD血管钙化由矿物质骨代谢异常引起,属于CKD矿物质及骨代谢紊乱(CKD-MBD)的范畴[7]。运用中医病机分析,血管钙化归为“肾虚血瘀”范畴[8]。精血同源,元气根于肾,久病入络是肾虚血瘀形成的重要基础。《黄帝内经》 “骨萎”“骨枯”“骨痹”的记载,对应CKD-MBD的病理状态,清代王清任《医林改错》阐述了因虚致瘀的实质[9]。上述理论为冠脉通片补肾活血法防治CKD血管钙化奠定了理论基础。本课题组前期研究证实冠脉通片兼具补肾和活血双重作用,能明显改善肾阳虚大鼠的肾功能[10-11]。
本实验通过灌胃给予腺嘌呤加高磷饮水的方法构建CKD血管钙化大鼠模型。腺嘌呤在黄嘌呤氧化酶的作用下转变成极难溶解于水的2,8-二羟基腺嘌呤,后者机械性阻塞肾小管,导致肾功能障碍[12]。高血磷是CKD患者发生血管钙化的直接危险因素。升高的血清磷诱导血管平滑肌细胞向成骨样细胞表型转换、促进细胞凋亡以及激活氧化应激和炎症反应等多方面促进血管钙化[13]。模型组大鼠肾功能异常,肾脏组织病变明显,钙、磷代谢紊乱,胸主动脉钙化明显,说明CKD血管钙化模型复制成功。
维生素D3(VD3)在血管钙化的防治中发挥重要作用[14]。VD3缺乏导致钙、磷代谢紊乱及高甲状旁腺素水平,进而引发血管钙化。因此,本实验设置VD3为阳性对照药。CKD时,肾1α-羟化酶分泌减少,VD3合成受损,损害肠道钙吸收,导致低钙血症和继发性甲状旁腺功能亢进。甲状旁腺激素升高降低尿钙排泄,增加尿磷酸盐排泄,增加钙的骨吸收[15]。因此,CKD血管钙化大鼠模型血清钙水平降低而血管中钙含量增加。
冠脉通片能明显降低模型大鼠血清尿素和肌酐水平,改善肾组织病变程度,提示冠脉通片对CKD具有防治作用,体现了其补肾方药的作用;此外,冠脉通片能够纠正模型大鼠钙、磷代谢紊乱状态,降低腹主动脉钙含量,缩小胸主动脉钙化面积,提示冠脉通片对血管钙化的防治作用,体现了其活血开窍的作用。CKD血管钙化属于异位钙化,病理变化由肾及心。因此,冠脉通片虽然对血管钙化有直接的治疗作用,但有可能更侧重于通过CKD的治疗发挥对血管钙化的防治作用。
冠脉通片对CKD血管钙化有明显防治作用,突显了其“补肾活血”的证治特色,为扩大其临床适应症提供了有力的数据支持。
Effect of Guanmaitong Tablet on prevention and treatment of vascular calcification in rats with chronic kidney disease
1. Tianjin Institute of Medical and Pharmaceutical Sciences, Tianjin 300020, China;
2. Tianjin Tongrentang Group Co., Ltd., Tianjin 300385, China;
3. Hospital of Traditional Chinease Medicine of Zhongshan, Zhongshan 528400, China
 2019, Vol. 36
2019, Vol. 36