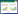文章信息
- 王单单, 郭丽娜, 田会东, 杨忠杰, 王瑞
- WANG Dandan, GUO Lina, TIAN Huidong, YANG ZhongJie, WANG Rui
- 基于网络药理学的白花蛇舌草-半枝莲药对治疗大肠癌的作用机制研究
- Mechanism of herb pair contining Hedyotis Diffusa-Scutellaria Barbata on colorectal cancer based on network pharmacology
- 天津中医药, 2019, 36(12): 1227-1233
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(12): 1227-1233
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.12.21
-
文章历史
- 收稿日期: 2019-07-22
大肠癌包括结肠癌和直肠癌,是常见的消化道恶性肿瘤,其发病率及病死率均较高[1]。目前,大肠癌的西医治疗手段以手术、放疗及化疗为主。现代药理学研究表明中药与化疗联用是综合治疗大肠癌的手段之一,能够抑制肿瘤细胞的增殖,同时具有增效减毒及改善患者生存质量的作用[2]。
白花蛇舌草是以茜草科耳草属植物1 a生白花蛇舌草的干燥全草入药,味苦、甘,性寒,可清热解毒、利尿消肿[3]。半枝莲为唇形科黄芩属多年生草本植物,以全草入药,味辛、苦,性寒,具有清热解毒、化瘀利尿之功效[4]。两者均为清热解毒类中药,具有清热解毒、活血化瘀等功效,对肿瘤、炎症疗效确切,常以药对形式出现在肿瘤和方、二半二白汤等各种治疗肿瘤的临床经验方中[5]。研究发现半枝莲提取物在体内外均可通过促进细胞凋亡及抑制肿瘤内部血管生成从而抑制结肠癌的发生发展,具有一定的抗结肠癌作用[6]。据报道白花蛇舌草乙醇提取物能够抑制信号转导及转录激活因子3(STAT3)信号通路从而促进人结肠肿瘤细胞凋亡,抑制肿瘤细胞的增殖[7]。晋小婷等[8]研究发现白花蛇舌草、半枝莲醇提取物的混合物与单味药醇提物相比能够显著抑制人结肠癌细胞株的生长,表明两者配伍抗结肠癌作用会有所增强。近年来对白花蛇舌草及半枝莲治疗结肠癌的研究多集中在单一靶点及单一通路上[6-7],然而中药具有多成分、多靶点、多通路协同发挥药效作用的特点,同时人体也是一种复杂的系统,故很难从单一方面阐述白花蛇舌草-半枝莲药对治疗大肠癌的机制。
网络药理学是一种建立在计算机信息技术高速发展基础上的研究中药药理新模式,其整合了系统生物学和多向药理学的方法,通过对中药成分、作用靶点以及涉及的生物通路进行分析,从而能够系统阐明中药产生药效的物质基础以及配伍规律等,利用网络药理学可阐明中药活性成分及作用机制,预测中药作用靶点,发现新的适应症,从而增加中药及其制剂的认可度和接受度[9]。本研究拟利用网络药理学方法,对白花蛇舌草-半枝莲药对治疗大肠癌的主要物质基础和配伍机制进行研究,以期为深入研究该药对配伍治疗结肠癌的科学内涵提供参考。
1 材料与方法 1.1 白花蛇舌草-半枝莲成分筛选利用中药系统药理分析平台(TCMSP)[10],以半枝莲、白花蛇舌草两味中药为关键词搜索出与这两味中药相关的全部化学成分。本研究以口服生物利用度(OB)化合物类药性(DL)作为该药对成分的筛选条件[11-12],并结合文献调研,最终确定本研究的候选化合物。
1.2 白花蛇舌草-半枝莲药对靶蛋白筛选利用TCMSP平台查询候选化合物的作用靶点。通过Uniprot数据库中的UniprotKB查询规范靶点名称。
1.3 大肠癌疾病靶点的筛选通过比较毒物基因组学数据库(CTD),以“Colorectal cancer”为关键词检索与结肠癌相关的基因。
1.4 构建白花蛇舌草-半枝莲药对成分-靶点网络利用Cytoscape 3.6.1软件分析药对成分-靶点关联信息,构建出白花蛇舌草-半枝莲药对成分-靶点网络图,并分析候选化合物和靶蛋白间的度值(degree)。
1.5 构建蛋白质相互作用(PPI)网络通过构建蛋白质相互作用网络可从生物化学和信号转导角度出发研究候选化合物和疾病相关蛋白间的相互作用关系[13]。将药对作用的靶点与大肠癌相关的靶蛋白的交集蛋白导入STRING 10.5数据库中获取蛋白质相互作用信息,并得到蛋白质相互作用网络图。
1.6 核心靶点的通路分析为了进一步分析上述筛选出的核心蛋白功能及在信号通路中的作用,将所得到白花蛇舌草-半枝莲药对治疗大肠癌的靶点导入DAVID数据库,进行生物学过程富集分析(GO)和通路富集分析(KEGG)[14]。
1.7 成分-靶点-信号通路网络构建将交集蛋白与其相关联的药对中成分构建成与大肠癌相关的白花蛇舌草-半枝莲药对成分-靶点网络图。交集蛋白与KEGG富集出的生物通路构建出大肠癌靶点-通路网络图。利用Cytoscape 3.6.1软件中的合并功能将以上2种网络合并,从而得出成分-靶点-信号通路网络图。
2 结果 2.1 活性化合物的筛选利用TCMSP,检索出半枝莲包含化学成分94种,白花蛇舌草包含化学成分37种。通过OB和DL预测化学成分的成药性,本研究基于样本量以及文献调研综合考虑[15-16],最终选择OB≥30%与DL≥0.18为筛选条件。结果显示,半枝莲中有29种化学成分符合条件,白花蛇舌草有7种化学成分符合条件,其中M98(槲皮素)、M359(谷甾醇)及M358(β-豆甾醇)为半枝莲和白花蛇舌草的共有化学成分,共筛选出33个候选化合物。“半枝莲-白花蛇舌草”药对中候选化合物的基本信息见表 1。

|
将药对筛选出的成分与靶点间关联信息导入Cytoscape 3.6.1,从而得到成分-靶点网络图,见图 1。成分-靶点网络图中共有266个节点和625条边,其中有30个化合物节点用橙色正六边形表示,236个靶节点用绿色圆点表示。通过限定OB值和DL值共筛选出33个候选化合物,但是化合物M2719、M1646、M1663无相关靶点,故在成分-靶点网络图中只显示了30化合物靶点。在网络中,1个节点与其他节点相连接的边越多,该节点的度值越高。度值高的节点在网络中发挥枢纽作用,可能为该网络的关键节点。在该网络中,每个成分平均与20.83个靶点存在相互作用,每个靶点平均与2.65个成分相关联,因此白花蛇舌草-半枝莲药对可通过多成分、多靶点发挥药理作用。其中最多的化合物为M98有151个潜在靶点,其次是M6(木犀草素)有57个靶点。这些度值较高的候选化合物,可能是“半枝莲-白花蛇舌草”药对发挥药效的核心成分。具有较高度值的靶点为前列腺素G/H合成酶1(PTGS1)、前列腺素G/H合成酶2(PTGS2)、热休克蛋白90(HSP90),具有较高度值的靶点可能是药对发挥药效的关键或者上游靶点。

|
| 图 1 “半枝莲-白花蛇舌草”成分-靶点网络图 Fig. 1 Compound-target network of Scutellaria Barbata-Hedyotis Diffusa |
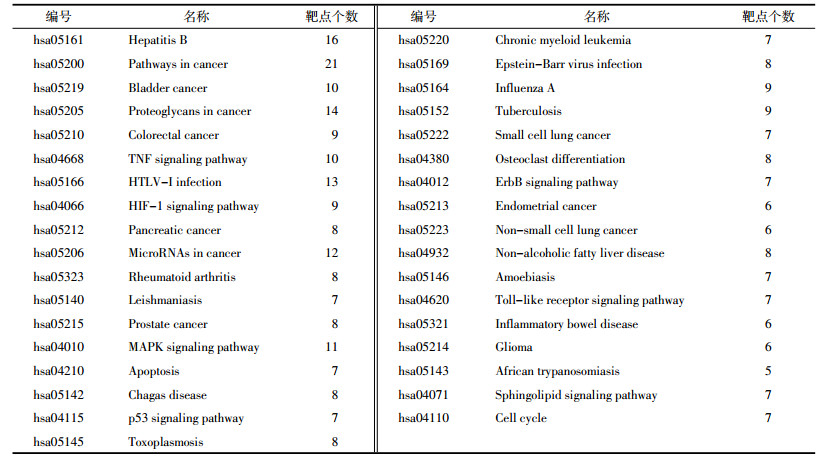
利用TCMSP数据库查询出白花蛇舌草候选化合物181个靶点,半枝莲候选化合物230个靶点,大肠癌403个相关基因。通过在线韦恩图得出半枝莲、白花蛇舌草与大肠癌存在40个共有基因,半枝莲与大肠癌存在1个共有基因。即白花蛇舌草-半枝莲药对候选化合物作用靶点与大肠癌共有41个交集蛋白,见图 2。
|
| 图 2 白花蛇舌草-半枝莲与大肠癌相关交集基因韦恩图 Fig. 2 Intersection gene of Hedyotis Diffusa-Scutellaria Barbat and colorectal cancer related target |
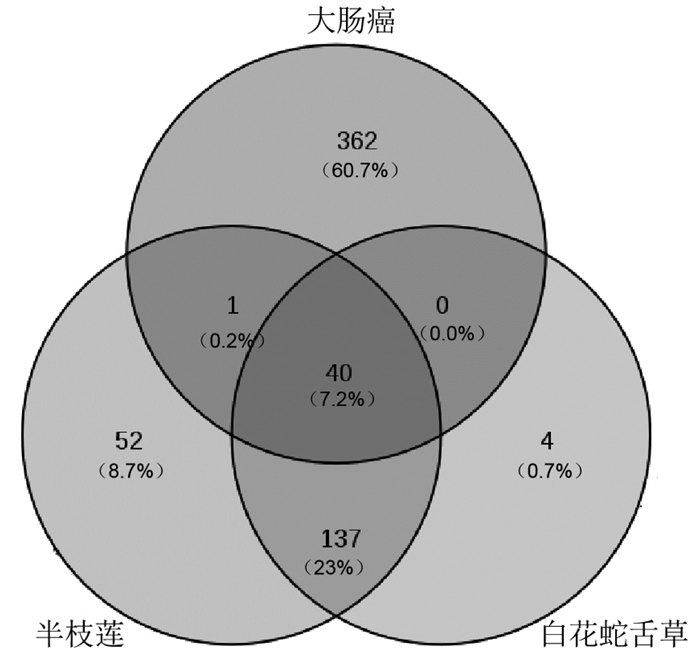
将“2.3项”下得到的41个交集蛋白导入STRING 10.5数据库中进行分析,从而得到PPI网络图,见图 3。图中有41个节点,357条边,其中节点代表交集蛋白,边则表示蛋白间的关联作用,线条的粗细表示关联度的大小,图中节点的平均度值为8.7。
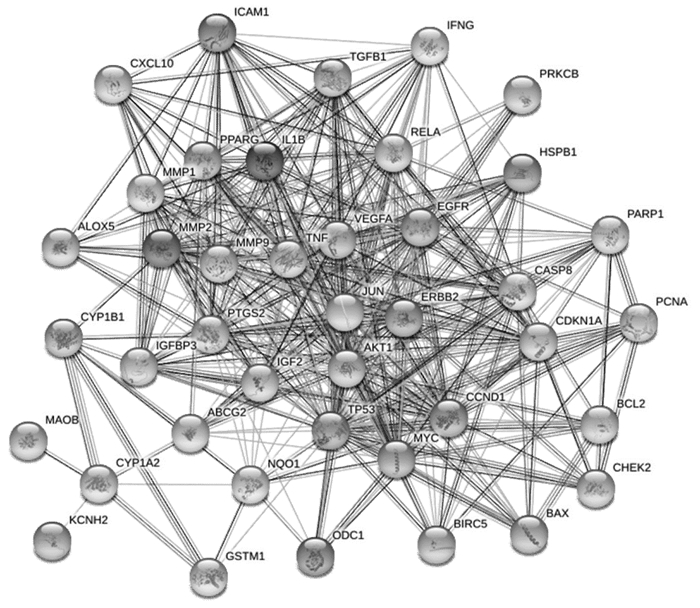
|
| 图 3 “白花蛇舌草-半枝莲”与大肠癌蛋白相互作用网络图 Fig. 3 Protein-protein interaction network diagram of Hedyotis Diffusa-Scutellaria Barba and colorectal cancer |
将41个交集蛋白上传至DAVID中通过GO功能富集分析得到284个GO条目(P < 0.05),其中包括生物过程(BP)229个、细胞组成(CC)22个、分子功能(MF)33个,见图 4。
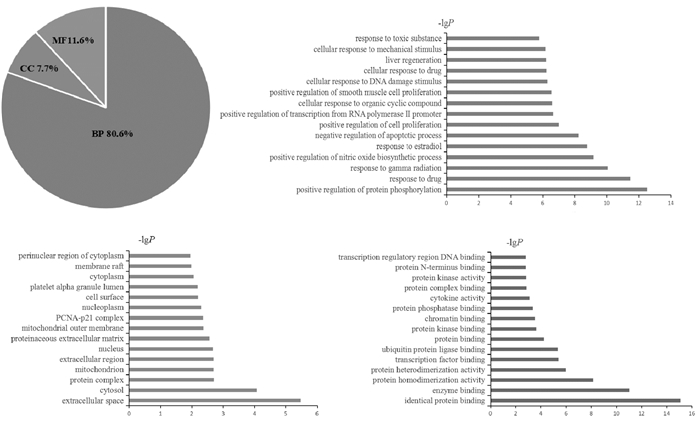
|
| 图 4 白花蛇舌草-半枝莲靶标的GO富集分析图 Fig. 4 GO enrichment analysis of targets of Hedyotis Diffusa-Scutellaria Barba |
通过KEGG通路富集筛选得到80条信号通路(P < 0.05),前35条显示如图 5所示。其中包括结肠癌信号通路、肿瘤坏死因子信号通路、P53信号通路、凋亡信号通路及炎症性肠病等。
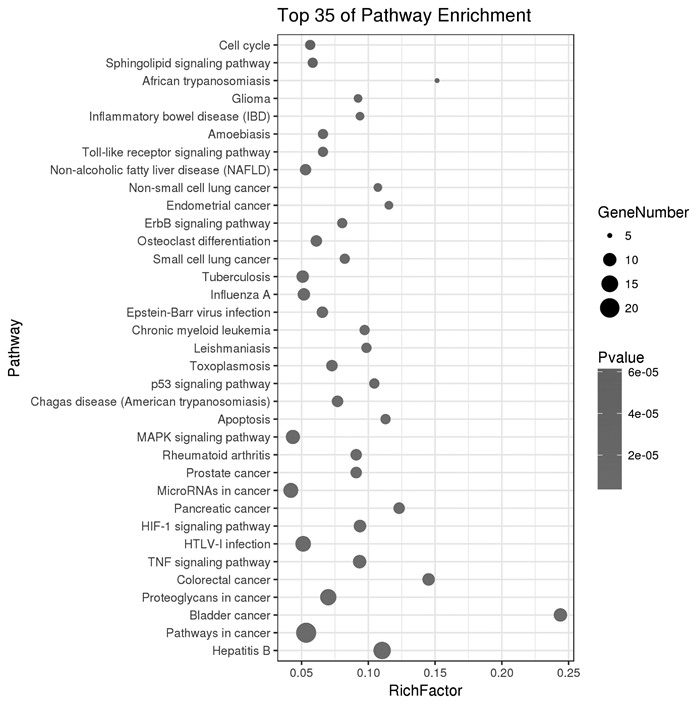
|
| 图 5 白花蛇舌草-半枝莲治疗大肠癌相关靶蛋白KEGG富集分析的35条通路图 Fig. 5 Thirty five channels of analysis of KEGG concentration in treatment of colorectal cancer by Hedyotis Diffusa-Scutellaria Barbata |
整理大肠癌相关的成分靶点关联信息以及相关靶点通路的关联信息如表 2、表 3所示,并将这些关联信息上传至Cytoscape 3.6.1软件中,并利用该软件的合并功能构建白花蛇舌草-半枝莲活性成分-作用靶点-信号通路网络图,如图 6所示。图中包括成分19种,大肠癌相关靶点33个,信号通路25条。筛选出的该药对候选活性成分的作用靶点分布在不同的信号通路,相互协调,通过调控不同的信号通路发挥治疗大肠癌作用。

|

|
| 图 6 白花蛇舌草-半枝莲治疗大肠癌成分-靶点-信号通路 Fig. 6 Compounds-targets-pathway network of Hedyotis Diffusa-Scutellaria Barba |
大肠癌是一种受多种因素影响的系统性疾病,其发生发展过程由多种信号分子和多条生物通路调控,由于大肠癌发病机制的高度复杂性,从而单一分子单一靶点的治疗策略很难取得满意的效果。本研究利用网络药理学方法,通过分析半枝莲-白花蛇舌草药对所包含的成分、作用靶点及调控的信号通路,建立该药对治疗大肠癌的“成分-靶点-信号通路”多层次网络模型,从整体角度出发研究半枝莲-白花蛇舌草药对发挥治疗大肠癌作用的主要物质基础和药理机制。
本研究运用网络药理学技术预测到白花蛇舌草-半枝莲药对治疗大肠癌的19个活性成分、33个潜在作用靶点以及25条信号通路,该药对治疗大肠癌成分、靶点及信号通路的多样性也在一定程度上体现了中药治疗疾病的整体性和系统性。通过分析成分-靶点-信号通路网络图,槲皮素、木犀草素、黄芩素、汉黄芩苷及β-谷甾醇在网络中的关联度较高,这几种成分可能是白花蛇舌草、半枝莲治疗大肠癌的物质基础。据报道关联度较高的前5种化合物均有显著的抗大肠癌作用[17-21],槲皮素可通过抑制细胞周期、增加细胞凋亡、抑制血管生成和转移等多种机制发挥抗结肠癌作用[17];黄芩素通过抑制蛋白激酶B(AKT)信号通路降低基质金属蛋白酶2(MMP-2)和基质金属蛋白酶9(MMP-9)的表达,从而抑制结直肠癌细胞迁移和侵袭[19]。靶点AKT1、肿瘤抑制蛋白(TP53)、MMP-2、MMP-9、肿瘤坏死因子(TNF)及前列腺素内源性过氧化物合酶(PTGS2)在网络的中心位置可能为白花蛇舌草、半枝莲治疗大肠癌的潜在靶点,这些靶点涉及凋亡、细胞周期、免疫系统,这些生物过程与大肠癌的发生发展密切相关,进一步印证了白花蛇舌草、半枝莲药对具有治疗大肠癌的作用。其中靶点MMP-2、MMP-9是参与肿瘤细胞迁移侵袭和转移的主要蛋白水解酶,研究表明MMP-2、MMP-9的表达会影响结肠癌细胞的浸润和转移[22]。前列腺素合成的主要限速酶PTGS2,在心血管疾病、炎症、肿瘤中都发挥重要作用[23]。在炎症及促有丝分裂的刺激下会诱导PTGS2的表达,进而参与前列腺素E2的表达,前列腺素E2可参与肿瘤细胞的增殖、血管生成及侵袭等多种生物过程[24]。临床研究表明,在大肠癌早期治疗中选择性PTGS2抑制剂具有较显著的抗肿瘤作用[25]。通过GO基因分析和KEGG通路富集分析表明白花蛇舌草、半枝莲药对通过促进肿瘤细胞凋亡、抑制肿瘤细胞增殖分化及增强机体免疫等多种途径发挥抗大肠癌的作用,体现了中药治疗疾病的整体性与系统性。
本研究从网络药理学角度出发,初步阐述了白花蛇舌草-半枝莲治疗大肠癌的潜在活性成分、可能作用的靶点及发挥药效的关键生物学通路,为进一步的实验验证研究奠定了良好的基础。当然,本研究也存在一定的局限性,由于篇幅有限只是通过挖掘数据对白花蛇舌草-半枝莲治疗大肠癌的药理作用机制进行预测,忽略了各成分含量、化合物间相互作用及药物体内代谢过程的影响,还需要进一步通过药理和临床研究验证。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30. DOI:10.3322/caac.21387 |
| [2] |
张欢, 耿耘, 陈熙. 近年中医药治疗结肠癌的研究进展[J]. 中华中医药学刊, 2015, 34(2): 305-307. |
| [3] |
马河, 李方丽, 王芳, 等. 白花蛇舌草化学成分研究[J]. 中药材, 2016, 39(1): 98-102. |
| [4] |
梁晨, 杨国春, 李丹慧, 等. 半枝莲化学成分研究[J]. 中草药, 2016, 47(24): 4322-4325. DOI:10.7501/j.issn.0253-2670.2016.24.004 |
| [5] |
罗金强, 刘宏斌. 半枝莲、白花蛇舌草抗肿瘤的研究进展[J]. 现代肿瘤医学, 2014, 22(2): 481-484. DOI:10.3969/j.issn.1672-4992.2014.02.77 |
| [6] |
Zhang L, Fang Y, Feng JY, et al. Chloroform fraction of Scutellaria barbata D. Don inhibits the growth of colorectal cancer cells by activating miR-34a[J]. Oncol Rep, 2017, 37(6): 3695-3701. DOI:10.3892/or.2017.5625 |
| [7] |
Peng J, Wei X, Shen A, et al. Hedyotis diffusa willd inhibits colorectal cancer growth in vivo via inhibition of STAT3 signaling pathway[J]. Int J Mol Sci, 2012, 13(5): 6117-6128. DOI:10.3390/ijms13056117 |
| [8] |
晋小婷, 贾宇鑫, 李卓玉, 等. 三种抗癌中草药单一提剂及其组合剂抑瘤率比较研究[J]. 山西大学学报, 2013, 36(3): 480-483. |
| [9] |
Pang XC, Kang D, Fang J, et al. Network pharmacology-based analysis of Chinese herbal Naodesheng formula for application to Alzheimer's disease[J]. Chin J Nat Med, 2018, 16(1): 53-62. |
| [10] |
Ru J, Peng L, Wang J, et al. TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014, 6(1): 13-18. DOI:10.1186/1758-2946-6-13 |
| [11] |
Kim MT, Sedykh A, Chakravarti SK, et al. Critical evaluation of human oral bioavailability for pharmaceutical drugs by using various cheminformatics approaches[J]. Pharm Res, 2014, 31(4): 1002-1014. DOI:10.1007/s11095-013-1222-1 |
| [12] |
Machado D, Girardini M, Viveiros M, et al. Challenging the drug-likeness dogma for new drug discovery in tuberculosis[J]. Front Microbiol, 2018, 3(9): 1-23. |
| [13] |
刘鑫馗, 吴嘉瑞, 张丹, 等. 基于网络药理学的参附汤作用机制分析[J]. 中国实验方剂学杂志, 2017, 23(16): 203-210. |
| [14] |
李晓燕, 董姝, 魏滨, 等. 六味地黄汤中药成分-靶标-疾病网络分析及效应机制预测[J]. 中国实验方剂学杂志, 2017, 23(5): 189-195. |
| [15] |
师帅, 胡元会, 吴华芹, 等. "丹参-三七"药对作用机制的网络药理学探讨[J]. 中国实验方剂学杂志, 2018, 24(18): 192-197. |
| [16] |
吴嘉瑞, 金燕萍, 段笑娇, 等. 基于网络药理学的"桔梗-甘草"药对作用机制分析[J]. 中国实验方剂学杂志, 2017, 23(5): 184-188. |
| [17] |
Darband SG, Kaviani M, Yousefi B, et al. Quercetin:a functional dietary flavonoid with potential chemo-preventive properties in colorectal cancer[J]. J Cell Physiol, 2018, 233(9): 6544-6560. DOI:10.1002/jcp.26595 |
| [18] |
Liu Y, Lang T, Jin B, et al. Luteolin inhibits colorectal cancer cell epithelial-to-mesenchymal transition by suppressing CREB1 expression revealed by comparative proteomics study[J]. J Proteomics, 2017, 24(161): 1-10. |
| [19] |
Rui X, Yan X, Zhang K. Baicalein inhibits the migration and invasion of colorectal cancer cells via suppression of the AKT signaling pathway[J]. Oncol Lett, 2016, 11(1): 685-688. DOI:10.3892/ol.2015.3935 |
| [20] |
Feng Q, Wang H, Pang J, et al. Prevention of wogonin on colorectal cancer tumorigenesis by regulating p53 nuclear translocation[J]. Front Pharmacol, 2018, 23(9): 1-11. |
| [21] |
Sayeed MSB, Ameen SS. Beta-Sitosterol:a promising but orphan nutraceutical to fight against cancer[J]. Nutr Cancer, 2015, 67(8): 1216-1222. DOI:10.1080/01635581.2015.1087042 |
| [22] |
Banday MZ, Sameer AS, Mir AH, et al. Matrix metalloproteinase (MMP)-2, -7 and-9 promoter polymorphisms in colorectal cancer in ethnic Kashmiri population-a case-control study and a mini review[J]. Gene, 2016, 589(1): 81-89. DOI:10.1016/j.gene.2016.05.028 |
| [23] |
Williams C, Mann M, DuBois RN. The role of cyclooxygenases in inflammation, cancer, and development[J]. Oncogene, 1999, 18(55): 7908-7916. DOI:10.1038/sj.onc.1203286 |
| [24] |
Hsu HH, Lin YM, Shen CY, et al. Prostaglandin E2-Induced COX-2 expressions via EP2 and EP4 signaling pathways in human LoVo colon cancer cells[J]. Int J Mol Sci, 2017, 18(6): 50-53. |
| [25] |
Benelli R, Ven R, Ferrari N. Prostaglandin-endoperoxide synthase 2(cyclooxygenase-2), a complex target for colorectal cancer prevention and therapy[J]. Transl Res, 2018, 6(196): 42-61. |
 2019, Vol. 36
2019, Vol. 36