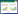文章信息
- 王中华, 窦志英, 王洋, 陈涛, 王远志
- WANG Zhonghua, DOU Zhiying, WANG Yang, CHEN Tao, WANG Yuanzhi
- 基于毛蕊花糖苷含量分析陈皮和砂仁在熟地黄炮制中的影响性研究
- Study on the influence of Tangerine and Amomum on Rehmannia glutinosa-processed on the content of Verbascoside
- 天津中医药, 2019, 36(12): 1234-1240
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(12): 1234-1240
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.12.22
-
文章历史
- 收稿日期: 2019-07-25
2. 天津中医药大学, 天津 301617;
3. 南开大学经济学院, 天津 300071
熟地黄在中医临床使用广泛,是补精益髓、养血滋阴的要药,也是配伍组方使用频率较高的中药品种之一,主要应用于心悸、失眠、血虚萎黄、月经不调、眩晕、崩漏等病的治疗。其药典中规定的指标性成分“毛蕊花糖苷”是地黄中苯乙醇苷类的主要化合物,现代药理学认为其具有肝脏保护及抑制胸主动脉的血管收缩作用[1]。由于熟地黄炮制后的药性由微寒转微温,补益滋腻之性增强,其性易滋腻滞脾,有碍消化,故脾胃虚弱、气滞痰多、脘腹胀满及食少便溏者忌服,因此限制了其临床应用范围。当前由于市场化需求及成本、人工、工艺等方面的问题,熟地黄主要有两种常规炮制方法[2]:1)将生地黄用酒拌后,火炖至酒吸尽,取出晾晒至外皮黏液稍干,切厚片,干燥即得。2)将生地直接蒸至断面显黑润,晒至八成干后切厚片,干燥即得。两种方法都需要将地黄蒸煮至断面乌黑色,一般需要蒸1~2次,晒干后的熟地黄柔软、黏性强、味甜,温性增强。
目前针对熟地黄常规炮制的研究较多,但基于中医药药性理论及配伍原则,采用不同药材或辅料复合炮制的研究较少。同时缺乏相应的炮制规范及其指标性成分的含量分析与质量标准,本次研究尚属首次探索。所以根据熟地黄临床用药的特点,针对目前饮片市场上缺乏供应的情况,而临床又有治疗使用需求的熟地黄炮制品种,采用新型的炮制工艺,其中陈皮制熟地黄、砂仁制熟地黄(酒蒸法),选用主产地的生药材,借鉴并参考地方炮制规范和古籍文献中的方法,逐级分步炮制。同时采用砂仁制熟地黄(拌制法),来考察日常中药市场上供应的常规炮制的熟地黄饮片再次复合炮制后的含量变化及可行性分析。以2015版《中华人民共和国药典》[3](简称《中国药典》)中规定的熟地黄性状及毛蕊花糖苷的含量标准(≥0.020%)为检测指标。为提高检测精度和速度,采用超高压液相色谱-串联质谱(UPLC-MS)法进行含量检测,并结合其性状评分进行综合评价,结果使用SPSS 22.0数据分析软件进行统计学分析。
1 材料 1.1 仪器美国Waters公司液质联用系统UPLC(I-Class)-MS(XEXO TQD),MassLynx V4.1工作站;离心机:Thermo LEGEND MICRO 17R,Precisa水分测定仪(XM60/120,广州合华科技有限公司),电子分析天平(型号:AL204,分度值0.000 1 g,梅特勒-托利多仪器有限公司上海分公司),单列六孔电热恒温水浴锅(TWS-16,上海喆图科学仪器有限公司),玻璃仪器等。
1.2 药材、标准品、试剂 1.2.1 药材地黄(Rehmannia glutinosa Libosch.)药材(2017年10—12月采收自河南焦作,个子货约40头/kg,直径约为2~4 cm,长约6~14 cm,大小均匀,性状呈不规则的纺锤形,表面呈棕黄色至黄棕色,外表皮皱缩且具有许多不规则的横纹,体重,质地较软而具有韧性,不容易折断,断面棕黄色,稍有黏性,气味微甜而稍带酸苦味,经天津中医药大学第一附属医院陈涛主任药师鉴定为玄参科植物地黄干燥块根);砂仁(Amomum villosum Lour.)饮片(产地云南,批号171004,经陈涛主任药师鉴定为姜科植物阳春砂的干燥成熟果实);陈皮(Citrus reticu1ata Blanco.)饮片(产地浙江,批号171001,经陈涛主任药师鉴定为芸香科植物橘的干燥成熟果皮);熟地黄(Rehmannia glutinosa Libosch.)饮片(产地河南,批号170901,经陈涛主任药师鉴定为玄参科植物地黄干燥块根,为地黄的炮制加工品)。以上药材均由河北安国普天和中药饮片有限公司提供。
1.2.2 标准品毛蕊花糖苷标准品(规格:20 mg,国家批号:111530-201713,ID:RY59-K596,中国食品药品检定研究院,标注纯度以麦角甾苷计为92.50%)
1.2.3 试剂甲醇色谱级(批号:181024,天津市化学试剂供销公司第二分公司),绍兴花雕黄酒(批号:20170308,浙江谷越龙山绍兴酒股份有限公司)。
2 方法与结果 2.1 炮制方法参考江西、河南、贵州、上海等省市《中药饮片炮制规范》[4-7]《实用中药手册》[8]及《全国中药炮制规范》1988版[9]中熟地黄的炮制方法。具体炮制方法如下。
2.1.1 陈皮制熟地黄取地黄药材1 000 g,抢水洗净备用。取陈皮饮片100 g,加冷水浸泡30 min,因陈皮是芳香之品不宜久煎,先武火后文火,以水开后记时,煎煮2次,每次约20 min,过滤残渣压榨后取汁,合并2次滤液,陈皮的滤液以完全能淹没地黄药材为宜(地黄与陈皮的用量比例10:1)。
取洗净备用的地黄与陈皮滤液混合拌匀,置陶瓷锅内盖严锅盖,武火加热并开始记录时间,至沸腾后改用文火保持微沸,加热期间要注意锅内水量变化,不足时应补充开水,以防药材焦化,连续炖制48 h(至药材乌黑发亮,味转甜时)后停止加热,然后用余温再加盖闷制12 h(锅内应保持适量的汁液,供药材在闷制过程中充分吸收)。炮制期间每隔4 h提取20 g熟地黄样品(样品编号为A0~A15),所提样品取出后切约0.4 cm厚片,置阴凉干燥处晾干备用。
2.1.2 砂仁制熟地黄(酒蒸法)取地黄药材1 000 g、绍兴花雕黄酒300 g、砂仁10 g(打碎成末),首先将地黄抢水洗净后与黄酒拌匀,置隔水蒸锅内,隔水加热蒸制2次。第1次蒸制12 h后停止加热,焖12 h。在第2次蒸制前拌入砂仁末(地黄与砂仁用量比例为100:1),第2次蒸制12 h后,停止加热,再焖24 h。炮制后的熟地黄内外乌黑发亮,有黏性,断面呈菊花芯或针刺孔状。炮制过程中每隔4 h提取20 g熟地黄样品(样品编号为B0~B15),所提样品取出后切约0.4 cm厚片,置阴凉干燥处晾干备用。
2.1.3 砂仁制熟地黄(拌制法)选取饮片市场中经质量检验合格的熟地黄饮片1 000 g,切制成约0.4 cm厚片,以其性状色泽光黑油润如漆,味甘如饴,软硬适中,断面有菊花芯或有似针刺孔状为标准。炮制时首先用砂仁20 g(打碎成末)与其充分混合拌匀(熟地黄与砂仁用量为50:1),然后置瓷缸内加盖密闭备用,每隔2 d提取20 g熟地黄样品(样品编号为C0~C15),所提样品置阴凉干燥处晾干备用。
2.2 检测指标依据《中国药典》2015版一部,熟地黄项下,水分含量不得超过15%,按干燥品计算,毛蕊花糖苷(C29H36O15)含量不得少于0.020%。
2.3 水分检测熟地黄样品进行水分检测时,采用Precisa水分测定仪(XM60/120)进行快速测定,其水分测定仪的原理[10]是利用红外的强穿透力以及加热效应将样品的水分快速蒸发,以加热前后样品的质量计算差值,得到样品水分含量,其红外干燥效率要远远大于烘箱干燥效率,相比药典烘箱烘干法,时间快、操作简单、测量准确。在预实验时,取3份生地粗粉,先用水分测定仪测定水分,再用药典方法进行测定,其结果近似,为提高效率,故本实验采用水分测定仪来测量熟地黄各样品的水分含量。
操作方法:取熟地黄炮制过程中提取的各样品,粉碎过2号筛,精密称取10 g均匀平铺于水分测定仪的托盘中,启动检测程序分别读取各样品数值,每个样品检测3次,并计算平均值及RSD值。2015版《中国药典》规定熟地黄水分不得 > 15%,各样品水分含量均符合药典标准,结果见表 1。
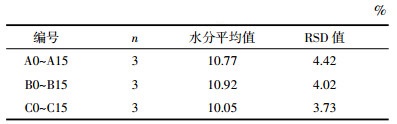
依据2015版《中国药典》熟地黄项下的性状描述以及传统炮制的质量鉴别标准,对各实验样品进行性状评价(8分为合格,9分为优秀,10分为最佳),评分标准见表 2。结果显示陈皮制熟地黄(样品编号A0~A15)随着炮制时间的不断增加,评分逐渐提高,逐步接近地黄药典和传统炮制黑如漆、甜如饴的性状标准,至40 h时分值达到最高,至52 h后分值才开始略有下降并维持至炮制结束。砂仁制熟地黄(酒蒸法,样品编号B0~B15)随着炮制时间的不断增加,性状评分逐渐提高,其分值最高阶段,是在炮制超过36 h时后(即拌入砂仁又蒸制12 h以后)。砂仁制熟地黄(拌制法,样品编号C0~C15)其炮制前后性状未发生明显变化,性状评分相同。
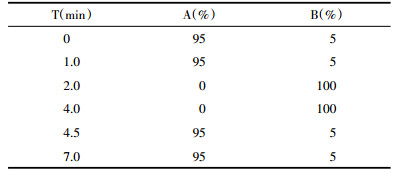
流动相:A:0.1%甲酸水溶液,B:0.1%甲酸乙腈溶液;流速:0.4 mL/min;色谱柱:Waters ACQUITY UPLC HSS T3,2.1 mm×100 mm,1.8 μm;柱温:35 ℃;样品室温度:10 ℃;进样量:1 μL;梯度洗脱程序结果见表 3。
毛蕊花糖苷的质谱检测参数:负离子扫描模式,MRM多反应检测模式;Source Voltages 2.70 KV;Source Temperature:400 ℃;Gas Flow:700 L/Hr;Cone:50 L/Hr;Parention(m/z):623.2;Daughterion(m/z)Quantitation:161.0;Cone(V):74;Collision(V):40。
2.5.3 标准品溶液的制备精密量取毛蕊花糖苷标准品适量,用甲醇(色谱级)定容于100 mL的容量瓶中,配置成含量为10.26 μg/mL的标准品溶液,过0.22 μm的滤膜备用。
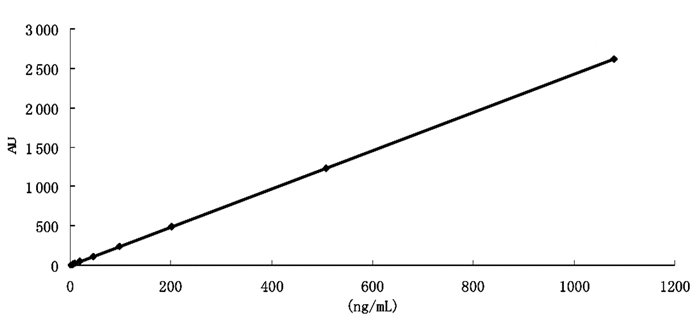
2.5.4 线性关系标准品储备液:取2.5.3项下制备的标准品溶液,稀释配制成1 μg/mL的储备液,用甲醇依次稀释成相应浓度的系列混合标准品溶液:1 000、500、200、100、50、20、10、5、2、1 ng/mL,按照2.5.1及2.5.2项下的检测条件进行检测,以标准品进样量为横坐标(X),峰面积积分值为纵坐标(Y),绘制标准曲线并计算相关系数,相关系数为r=1,直线方程为Y=2.432 3X-0.838 4,线性范围为1~1 000 ng/mL,结果见图 1。
|
| 图 1 毛蕊花糖苷标准曲线 Fig. 1 Standard curve line of Verbascoside glycoside |
取容量为250 mL具塞三角瓶,置恒温干燥箱中60 ℃干燥30 min至恒重。精密量取粉碎过2号筛的地黄各实验样品的粗颗粒约2 g,将已称定的实验样品置已知重量的三角瓶中,精密加入纯甲醇100 mL(色谱级)精密称重后,置超声提取器中40 ℃,40 Hz,240 W超声提取1 h,后静置至室温称质量,用甲醇补足缺失的质量,常压过滤后的续滤液密封冷藏备用。
精密量取备用的各样品续滤液30 mL,至蒸发皿内水浴60 ℃挥干甲醇至近干,残渣用甲醇溶解定容于5 mL的棕色容量瓶中作为储备液,检测时取储备液1 mL用甲醇定容于100 mL容量瓶中(即样品溶液稀释100倍),得样品溶液。同时用纯甲醇溶液定容作为空白试剂,各样品过0.22 μm的滤膜,进样量为1 μL。
2.5.6 精密度、重复性、稳定性、准确度 2.5.6.1 精密度实验取同一份已配置的毛蕊花糖苷混合标准品溶液,按照2.5.1及2.5.2项下的检测条件检测,进样量为1 μL,连续重复进样6次,并记录峰面积,计算RSD值为1.77%,说明仪器的精密度良好。
2.5.6.2 重复性实验精密称取同一熟地黄粉末样品6份各2 g,按2.5.5项下样品溶液制备方法制备,按照2.5.1及2.5.2项下的检测条件检测,进样量为1 μL,记录峰面积,并计算样品含量,其RSD值为2.03%,说明该方法的重复性良好。
2.5.6.3 稳定性实验精密称取一份熟地黄粉末样品2 g,按照2.5.5项下样品溶液制备方法制备,按照2.5.1及2.5.2项下的检测条件检测,在相同的色谱条件下分别在0、2、8、12、24 h进行检测,进样量为1 μL,记录峰面积,并计算样品含量,其RSD值为1.96%,说明样品溶液在常温24 h内稳定。
2.5.6.4 准确度实验取已知毛蕊花糖苷含量的同一熟地黄样品6份,每份各2 g,按2.5.5项下的样品溶液方法制备,精密量取制备后的各样品溶液1 mL,分别加入毛蕊花糖苷标准品溶液(精密量取2.5.4项下标准品溶液中浓度为500 ng/mL的混合标准溶液1 mL),与样品溶液中毛蕊花糖苷含量的比例约为1:1,按照2.5.1及2.5.2中的检测条件检测,进样量为1 μL,平均回收率为97.28%,RSD值为2.48%,结果见表 4。
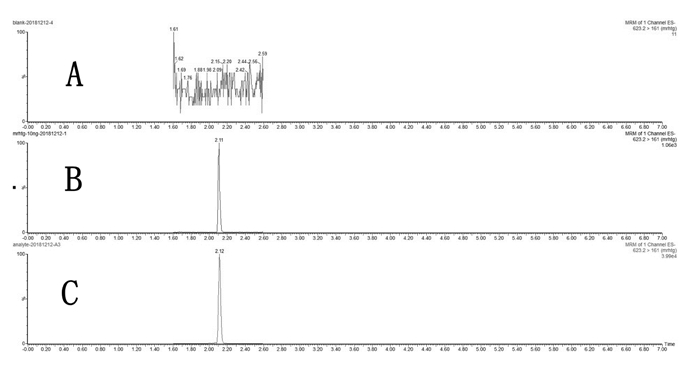
取熟地黄各实验样品,按照2.5.5项下进行制备,按照2.5.1及2.5.2项下的检测条件检测,进样量为1 μL,每个样品进样3次,检测结果换算成实际浓度,并计算样品含量的平均值及含量比例。结果显示熟地黄样品中毛蕊花糖苷的色谱峰与毛蕊花糖苷标准品色谱峰的保留时间相同,且显示相同的相对分子质量,结果见图 2、表 5。
|
| 图 2 阴性空白(A)、毛蕊花糖苷标准品(B)、熟地黄样品中毛蕊花糖苷(C) Fig. 2 Chromatogram of negative blank (A), standard of Verbascoside glycoside (B), Verbascoside glycoside in Rehmannia sample (C) |
|
本研究采用“相畏为制”的炮制原理,在陈皮制熟地黄的炮制过程中,借陈皮味苦性温,行气、调中、消痰之功,可缓解地黄炮制后的滋腻之性,起到补而不滞的效果,更好发挥地黄补血滋阴、益精填髓的作用。而砂仁香燥性温,为化湿理气温脾的要药,有宽中、下气、消胀之功,砂仁制熟地黄(酒蒸法)的目的是借砂仁香燥之性,来抑制或降低熟地黄的滋腻之性,可使熟地黄补而不腻。而且两种方法炮制后的熟地黄,其性状都达到了色黑如漆,味甜如饴的传统炮制要求。砂仁制熟地黄(拌制法)的炮制特点是将砂仁打碎与常规法炮制后熟地黄饮片物理混合,并同置一密闭容器内,这样可避免砂仁芳香性成分的散失,最大程度上保留砂仁的药性,使其更好地发挥抑制熟地黄滋腻之性的作用,且有利于长期保存。
本实验选取的以上炮制方法,遵循古法并符合基本炮制规范的要求,操作简单,炮制时间较短,节约能源,炮制效率较高,而且符合临床使用需求。在含量检测时应用超声提取方法[11],及UPLC-MS检测技术[12],对指标成分的损失少,提取效率高,含量检测的时间短、速度快、精确度高。
目前相关文献研究证明,常规炮制后的熟地黄中毛蕊花糖苷的含量成明显下降趋势,随着炮制程度的增加其下降幅度剧烈(研究显示炮制至约30~60 h时,其含量下降约40~70%)[13-16]。而《中国药典》中要求熟地黄中毛蕊花糖苷的含量比例要≥0.020%,与生地的含量标准相同,缺乏一定的合理性[13]。
本实验熟地黄炮制前后的性状评分变化提示,陈皮制熟地黄与砂仁制熟地黄(酒蒸法)随着炮制时间的不断增加,性状评分逐步提高,几近熟地黄药典及传统炮制要求的黑如漆、甜如饴的性状标准,分析其炮制过程中性状变化的原因,应与加热和蒸制时间及炮制辅料的参与密切相关。而砂仁制熟地黄(拌制法)其炮制前后的性状未发生明显变化,分析原因应为拌制法仅是单纯的物理混合,药材没有液体辅料的参与,以及加热蒸制的过程,结果见表 5。
熟地黄药典中规定了毛蕊花糖苷(C29H36O15)的含量比例要求(≥0.020%),通过表 5发现所有实验样品的毛蕊花糖苷含量均符合药典标准。其中在陈皮制熟地黄炮制过程中,毛蕊花糖苷的含量在炮制初始时有明显的跃升且达到较高峰值,而后随着炮制时间的增加,维持在相对平稳的水平,接近炮制后期含量仍有明显提高,至炮制终点时仍能稳定在炮制初期的含量水平,结果见图 3。对比表 5的结果显示最佳炮制时间约为52 h时(即连续炖制48 h后再闷4 h),其性状评分和毛蕊花糖苷的含量均相对较高。以药典中熟地黄毛蕊花糖苷含量标准(≥0.020%)作为参照比值,计算其单样本t检验值(t=14.224,P < 0.05),证明其差异性非常显著。实验证明陈皮制熟地黄可使其炮制后的性状在达到药典及传统标准的同时,仍能维持其毛蕊花糖苷的含量在较高水平,并不发生显著下降,证明其炮制方法具有一定的科学性与合理性及应用意义。
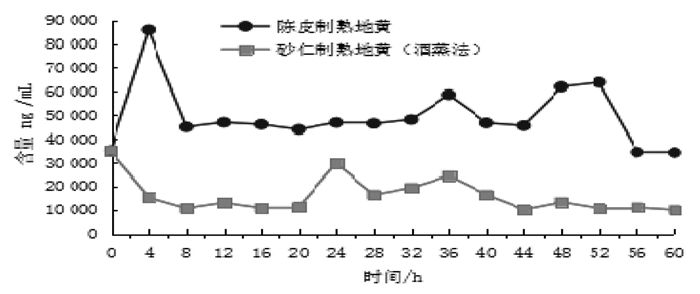
|
| 图 3 陈皮制熟地黄、砂仁制熟地黄(酒蒸法)中毛蕊花糖苷含量变化 Fig. 3 Changes of the content of Verbascoside glycoside in the Tangerine-processed Rehmannia and the Amomum-processed Rehmannia (wine steaming) |
分析砂仁制熟地黄(酒蒸法),其毛蕊花糖苷的含量在炮制初期下降明显。当第2次蒸制时(即拌入砂仁后),毛蕊花糖苷的含量又显著上升,并维持至36 h后开始逐步下降,结果见图 3。当蒸至36 h时(即拌入砂仁,第2次再蒸制12 h后)毛蕊花糖苷的含量与其性状评分均最高,结果见表 5。以药典中熟地黄毛蕊花糖苷的含量标准(≥0.020%)作为参照比值,计算其单样本t检验值(t=6.246,P < 0.05),证明整个炮制过程中毛蕊花糖苷的含量变化差异性非常显著。同时也证明砂仁的参与对其炮制过程中毛蕊花糖苷的含量变化产生了显著的影响,具有一定的科学性和应用意义。
分析砂仁制熟地黄(拌制法),其毛蕊花糖苷的含量整体呈震荡下降趋势,结果见图 4。其对应的性状评分在整个炮制过程中没有变化,结果见表 5。以药典中熟地黄毛蕊花糖苷的含量标准(≥0.020%)为参照比值,计算其单样本t检验值(t=2.577,P > 0.05),证明其含量变化差异性不显著,说明此炮制法中砂仁的参与对毛蕊花糖苷的含量没有明显的影响。但砂仁拌制后的熟地黄如与群药配伍组方后共同煎煮,在煎煮过程中由于加热时间、温度等因素的影响,可能会对毛蕊花糖苷的含量产生一定的影响,其炮制方法的合理性及临床意义还需进一步深入研究。
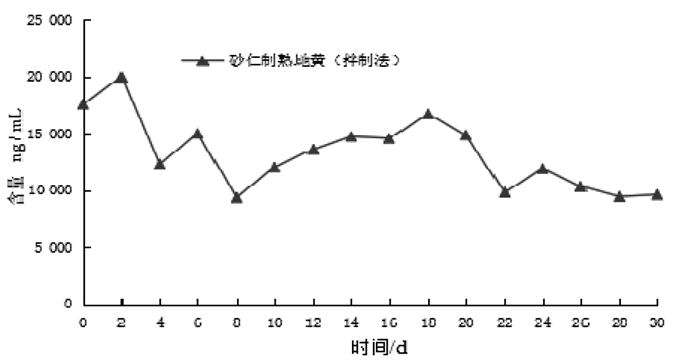
|
| 图 4 砂仁制熟地黄(拌制法)中毛蕊花糖苷的含量变化 Fig. 4 Changes of the content of Verbascoside glycoside in the Amomum-processed Rehmannia (mixed method) |
对比以上3种炮制方法证明炮制过程中陈皮制熟地黄的毛蕊花糖苷含量变化波动性最大,其炮制方法对毛蕊花糖苷含量的影响程度最高,相反砂仁制熟地黄(拌制法)含量变化波动性最小,对毛蕊花糖苷含量的影响程度最低。
综合本实验的各项结果可以看出,陈皮制熟地黄与砂仁制熟地黄(酒蒸法)炮制后的熟地黄无论从性状质量,还是指标性成分的含量,均优于常规炮制后的熟地黄。尤其是陈皮制熟地黄对熟地黄中毛蕊花糖苷的含量有显著影响,其炮制后毛蕊花糖苷的含量未发生显著下降,而且随着炮制程度的增加在终末期还有相应的提高。证明陈皮制熟地黄的炮制法可明显稳定和控制毛蕊花糖苷的下降趋势,对如何有效地保存熟地黄指标性成分的研究有实践意义,可为其质量标准的进一步优化提供思路。未来研究还应考虑地黄药材采收时的产地、个头等级、储存时间等影响因素。
文献研究还发现,熟地黄炮制过程中随着炮制程度的增加,部分毛蕊花糖苷转化成为异毛蕊花糖苷[14],两者成负相关性。而本实验熟地黄炮制中使用的陈皮和砂仁均不含毛蕊花糖苷的相关成分[17-18],但富含橙皮苷和乙酸龙脑酯,两者在熟地黄炮制过程中对毛蕊花糖苷的转化是否起到抑制和稳定的作用还需进一步的研究和分析。对于陈皮与砂仁在熟地黄炮制过程中毛蕊花糖苷的变化机制,及临床使用中对熟地黄性味功效产生影响和改变的机制,还应进一步开展相关药效学研究。
| [1] |
宋光西, 马玲云, 魏锋, 等. 苯乙醇苷的分布及药理活性研究进展[J]. 亚太传统医药, 2011, 7(4): 169-171. |
| [2] |
张丽萍, 李军, 张振凌, 等. 熟地黄炮制方法的历史沿革[J]. 河南中医学院学报, 2005, 20(2): 69-71. DOI:10.3969/j.issn.1003-5028.2005.02.049 |
| [3] |
国家药典委员会.中华人民共和国药典[S].一部.北京: 中国医药科技出版社, 2015: 115-117.
|
| [4] |
江西省食品药品监督管理局. 江西省中药饮片炮制规范[M]. 上海: 上海科技出版社, 2008: 66.
|
| [5] |
河南省食品药品监督管理局. 河南省中药饮片炮制规范[M]. 郑州: 河南人民出版社, 2005: 75.
|
| [6] |
贵州省食品药品监督管理局. 贵州省中药饮片炮制规范[M]. 贵阳: 贵州科技出版社, 2005: 88.
|
| [7] |
上海市食品药品监督管理局. 上海市中药饮片炮制规范[M]. 上海: 上海科学技术出版社, 2008: 34.
|
| [8] |
陈瑞华. 实用中药手册[M]. 上海: 上海科学技术出版社, 1994: 201-203.
|
| [9] |
中华人民共和国卫生部药政管理局. 全国中药炮制规范[M]. 北京: 人民卫生出版社, 1988: 47-48.
|
| [10] |
张民慧. 红外水分测定仪原理及应用范围[J]. 科技应用, 2008, 37(1): 13-15. |
| [11] |
柴茂, 董诚明, 江道会, 等. 不同品种怀地黄中梓醇和毛蕊花糖苷的高效液相色谱法测定[J]. 中医学报, 2013, 28(5): 690-692. |
| [12] |
王娟娟, 张振凌, 都盼盼, 等. UPLC法测定地黄叶及块根中的梓醇和毛蕊花糖苷[J]. 中成药, 2015, 37(9): 1981-1984. |
| [13] |
魏国栋, 刘焕, 温学森, 等. 关于中国药典熟地黄含量测定指标的商榷[J]. 中药材, 2013, 36(5): 853-856. |
| [14] |
尚伟庆, 贺清辉, 张建军. 地黄炮制过程中毛蕊花糖苷变化的研究[J]. 新中医, 2014, 46(5): 211. |
| [15] |
赵丹, 张振凌, 韩宁宁, 等. 酒炖炮制时间对熟地黄质量的影响[J]. 中医学报, 2017, 32(7): 1231-1235. |
| [16] |
于文娜, 张振凌, 张颖, 等. 地黄炮制过程中异毛蕊花糖苷含量的动态变化[J]. 中国实验方剂学杂志, 2017, 23(18): 22-26. |
| [17] |
马琳, 黄小方, 欧阳辉, 等. UHPLC/Q-TOF-MS/MS快速鉴定陈皮化学成分[J]. 亚太传统医药, 2015, 11(19): 33-37. |
| [18] |
余竞光, 孙兰, 周立东, 等. 中药砂仁化学成分研究[J]. 中国中药杂志, 1997, 22(4): 231-232. DOI:10.3321/j.issn:1001-5302.1997.04.018 |
2. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. School of Economics, Nankai University, Tianjin 300071, China
 2019, Vol. 36
2019, Vol. 36