文章信息
- 刘锐, 雷宁宁, 伍娟娟, 叶传冬, 陈斯宁
- LIU Rui, LEI Ningning, WU Juanjuan, YE Chuandong, CHEN Sining
- 麦门冬汤对大鼠骨髓间充质干细胞向肺泡上皮细胞分化的影响
- Effect of Maimendong Decoction on bone marrow mesenchymal stem cells(BMSC) to differentiate into alveolar epithelial cells of rat
- 天津中医药, 2019, 36(2): 171-175
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(2): 171-175
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.02.20
-
文章历史
- 收稿日期: 2018-11-16
2. 广西中医药大学, 南宁 530011
肺纤维化(Pulmonary Fibrosis)是多种病因引起的一种慢性炎症性间质性肺疾病,几乎是所有肺组织损伤及病变发展到末期的最终归宿,目前主要以抗炎、免疫调节等治疗方法为主,治疗效果不显著且存有局限性。因此,需从其发病机制入手,以发病机制为重点寻找有效的治疗手段迫在眉睫。研究表明,肺内上皮细胞与上皮干细胞衰竭可引起肺纤维化[1],近期更有研究发现,特发性肺纤维化可通过骨髓间充质干细胞(BMSCs)发挥作用从而改变其病理结果,表现为延缓甚至逆转肺纤维化的进程[2-3],这一发现为治疗肺纤维化提供了一条可能的新途径,并显示出巨大的研究前景。
肺纤维化在临床上的表现主要有进行性加重的呼吸困难、气短、喘息、刺激性干咳,中医属“肺痿”范畴。肺痿病名最早见于张仲景的《金匮要略》,麦门冬汤主治。本实验以张仲景治疗肺痿经方麦门冬汤为研究对象,观察麦门冬汤含药大鼠血清,对BMSC细胞肺表面活性蛋白C(SP-C)、水通道蛋白5(AQP-5)表达的影响,为麦门冬汤经BMSCs途径治疗肺纤维化寻找确切依据,并为BMSCs植入治疗肺纤维化寻找可靠的多环节调控中药。
1 实验材料与仪器 1.1 实验材料绿色荧光蛋白(GFP)标记的BMSC细胞株(GFP-BMSC)由杭州赫贝科技公司细胞库提供。
1.2 实验药物参照张仲景《金匮要略》麦门冬汤原方组成及剂量,麦门冬70 g,法半夏10 g,生晒参6 g,甘草6 g,大枣10 g。以上药物以500 mL水煎煮去渣,浓缩至100 mL,约含生药1.1 g/mL。由广西中医药大学附属瑞康医院药剂室制备。
1.3 含药血清制备 1.3.1 麦门冬汤含药血清的制备取雌性SD大鼠(体质量200~220 g),并予麦门冬汤按每100 g体质量1 mL药液进行灌胃(相当于成人每日有效剂量),每日1次,连续5 d,然后取10%水合氯醛麻醉大鼠,75%乙醇浸泡身体10 min,在无菌条件下下腔静脉取血,37 ℃静置1 h,后1 500 r/min离心15 min,取上清液。
1.3.2 肺纤维化模型血清的制备使用5%苯巴比妥钠腹腔麻醉8周龄雌性大鼠。待大鼠失去知觉之后,使用无菌剪刀在其咽喉部剪开5 mm左右的切口。然后用无菌弯镊拨开喉部肌肉,暴露气管,用1 000 μL微量注射器注入5 mg/kg博莱霉素溶液,轻轻摇晃,使药物分布均匀,缝合切口,待大鼠苏醒。造模24 h后取10%水合氯醛麻醉大鼠,75%乙醇浸泡身体10 min,在无菌条件下下腔静脉取血,37 ℃静置1 h,后1 500 r/min离心15 min,取上清液。
1.4 实验试剂基础培养基:Cyagen Company,货号:RASMX-90011。胎牛血清:Cyagen Company,货号:RASMX-05001-50。DMEM培养基:GIBCO Company。其余试剂均为国产分析纯。SP-C(FL-197)抗体:SANTA CRUZ,货号:sc-13979。
AQP5(H-200)抗体(SANTA CRUZ,货号:sc-28628),兔两步法检测试剂盒(北京中杉,货号:PV6001),高纯总RNA快速提取试剂盒(Generay公司,货号:GK3016;批次:1512G14),逆转录试剂盒PrimeScriptTM RT reagent Kit(TaKaRa公司,货号:RR037A;批次:AK5302-1),实时荧光定量聚合酶链反应(qPCR)试剂SuperReal PreMix Color(SYBR Green,TIANGEN公司,货号:FP215-02;批次:O3911)。实验引物由上海桑尼生物科技有限公司合成纯化。
1.5 实验仪器二氧化碳(CO2)培养箱(3111型,Thermo公司),倒置显微镜(IX73型,Olympus公司),台式低速离心机[80-2型,上海医疗器械(集团)有限公司]。细胞培养皿(Fisher Scientific公司),OD值测量仪器(高精度分光光度计)为Merinton SMA4000。定量PCR仪为CFX connect Real-Time PCR System,配套使用的分析软件为BIO-RAD CFX Manager。
2 实验方法 2.1 细胞培养GFP-BMSC细胞株的培养条件:含10% FBS和1×青链霉素的Cyagen基础培养基,37 ℃、5% CO2、饱和湿度培养箱中培养。
2.2 铺板取处于对数期正常培养的GFP-BMSC细胞株,用0.25% Typsin消化,1 500 r/min离心5 min,计数板下计数,铺24孔板,4组细胞每孔均加入1×104个细胞,放入培养箱中静置24 h。
2.3 加药细胞贴壁24 h后,每孔加入500 μL不同药物的大鼠血清,分别作用14 d,药物分组如下:
正常对照(DMEM)组:大鼠BMSCs培养液中加入等量的DMEM;麦门冬汤血清组:大鼠BMSCs培养液中加入5%麦门冬汤含药血清;模型大鼠血清组:大鼠BMSCs培养液中加入5%肺纤维化模型大鼠血清(博来霉素组);模型大鼠+麦门冬汤血清组:大鼠BMSCs培养液中加入5%肺纤维化模型血清及5%麦门冬汤含药血清。
2.4 免疫组化检测SP-C、AQP-5蛋白表达免疫组化蛋白表达的阳性信号表达为细胞胞浆呈现棕黄色。用平均灰度值来表示信号的强弱,阳性反应程度越高其灰度值越小,表达也越强。随机选择3个不同的视野(×200)来观察每张免疫组化切片阳性细胞的形态和分布,然后进行图像的采集与分析,使用联有三目光学显微镜的Optimas数字彩色图像显微系统进行采集并分析各区域平均灰度值。
2.5 qPCR检测SP-C、AQP-5 mRNA表达实时荧光定量聚合酶链反应(PCR)分析软件BIO-RAD CFX Manager对实验结果进行自动统计和计算。使用正常对照组作为对照模板计算每个样品的Ct值,以GAPDH作为内参基因,计算每个样品的目的基因的相对表达量2-△△Ct。
△△Ct=[待测组目的基因平均Ct值-待测组内参基因平均Ct值]-[对照组目的基因平均Ct值-对照组内参基因平均Ct值]。
引物序列如下:
Rat GAPDH Forward:
GGCAAGTTCAACGGCACAG
Rat GAPDH Reverse:
CGCCAGTAGACTCCACGACA
PCR产物大小为:142 bp
Rat AQP-5 Forward:
CTTCAAGGCGGTGTTCG
Rat AQP-5 Reverse:
GAGTAATGGCTGGATTGATGTG
PCR产物大小为:192 bp
Rat SP-C Forward:GAGCCAGTTTCGCATTCCC
Rat SP-C Reverse:CCCATGAGCAGAGCCCCTA
PCR产物大小为:108 bp
2.6 统计学处理所有数据均用SPSS 19.0统计软件包进行处理,计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析(One-Way ANOVA),方差齐时采用LSD法,方差不齐时采用组间两两比较Dunnett’s T3法,P < 0.05为差异有统计学意义。
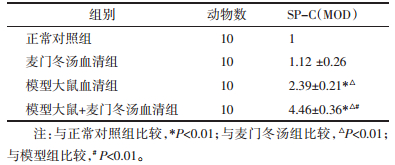
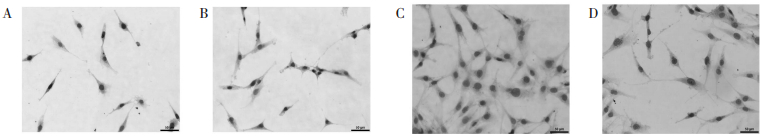
3 结果与分析 3.1 免疫组化检测SP-C、AQP-5蛋白表达结果 3.1.1 SP-C蛋白模型大鼠+麦门冬汤组、模型组SP-C蛋白表达,明显高于正常对照组、麦门冬汤组(P < 0.01),其中模型大鼠+麦门冬汤组SP-C蛋白表达又明显高于模型(P < 0.01)。见表 1、图 1。
|
|
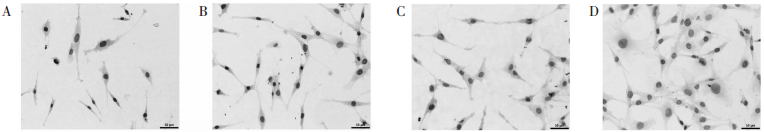
| A:正常对照组,B:麦门冬汤血清组,C:模型大鼠血清组,D:模型大鼠+麦门冬汤血清组 图 1 免疫组化检测SP-C在各组的表达(×200) Fig. 1 Expression of SP-C in each group by immunohistochemistry(×200) |
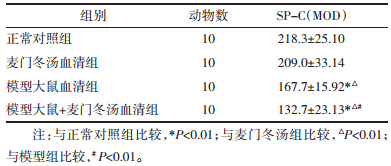
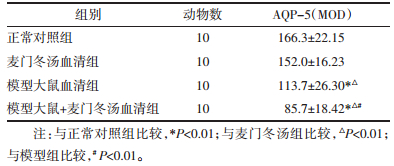
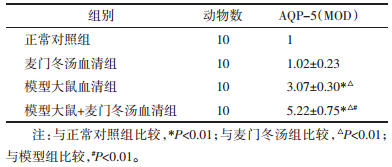
模型大鼠+麦门冬汤组、模型组AQP5蛋白表达,明显高于正常对照组、麦门冬汤组(P < 0.01),其中模型大鼠+麦门冬汤组AQP5蛋白表达又明显高于模型(P < 0.01)。见表 2、图 2。
|
|
| A:正常对照组,B:麦门冬汤血清组,C:模型大鼠血清组,D:模型大鼠+麦门冬汤血清组 图 2 免疫组化检测AQP-5在各组的表达(×200) Fig. 2 Expression of AQP-5 in each group by immunohistochemistry(×200) |
设正常对照组的相对表达量为1。模型大鼠+麦门冬汤血清组的相对表达量最高4.46±0.36,模型大鼠血清组为2.39±0.21,麦门冬汤血清组为1.12 ±0.26。模型大鼠+麦门冬汤血清组、模型大鼠血清组SP-C mRNA表达,明显高于正常对照组、麦门冬汤血清组(P < 0.01),其中模型大鼠+麦门冬汤组SP-C mRNA表达又明显高于模型大鼠血清组(P < 0.01)。见表 3。
设DMEM组的相对表达量为1。模型大鼠+麦门冬汤血清组的相对表达量最高14.46±0.36,模型组的相对表达量最低1.39±0.21,麦门冬汤血清组为4.332 ±0.221。模型大鼠+麦门冬汤血清组、模型大鼠血清组AQP-5 mRNA表达,明显高于正常对照组、麦门冬汤血清组(P < 0.01),其中模型大鼠+麦门冬汤组AQP-5 mRNA表达又明显高于模型大鼠血清组(P < 0.01)。见表 4。
|
肺纤维化在多种炎症性肺部疾病中常见,如肺炎、慢性阻塞性肺疾病、矽肺等,西医多采用免疫抑制剂、糖皮质激素或细胞毒药物进行治疗,虽有一定疗效,但不良反应较大[4]。一般认为,肺纤维化可对应中医学中的“肺痿”和“肺痹”,其在临床上的表现主要有进行性加重的呼吸困难、气短、喘息、刺激性干咳。中医对肺纤维化的主要治法为益气养阴、活血通络、养肺化痰和养肺清热;多数学者认同肺纤维化的中医病机主要是虚、瘀及痰[5-6]。张仲景的《金匮要略》中设有专方治疗肺痿,即麦门冬汤,其具有润肺益胃,降逆下气的功效;原文记载:“大(火)逆上气,咽喉不利,止逆下气者,麦门冬汤主之”。在治疗肺痿常用方剂中,根据马锦地[7]对文献的分析整理发现麦门冬汤应用频率最高,运用麦门冬汤治疗肺纤维化治法则多体现为益气养阴。临床实践证实麦门冬汤可以明显改善肺纤维化症状,保护肺功能,提高患者生活质量[8-9]。实验研究也发现麦门冬汤可以通过影响肺组织中肿瘤坏死因子-α(TNF-α)、转化生长因子-β1(TGF-β1)、血小板衍生因子(PDGF)、白介素(IL)-10等因子的表达,减轻博来霉素所致的大鼠肺纤维化[10-15]。
麦门冬汤以人参、麦门冬、半夏为主药,近年来研究发现人参中的多种成分具有促进BMSCs增殖[16],干预BMSCs转化为多潜能干细胞[17],诱导向BMSCs向心肌细胞、神经细胞分化的作用[18-19]。并且BMSCs具有自我更新和可多向分化的能力,在损伤的神经组织微环境中可以向神经细胞分化[20],或者分泌成纤维细胞生长因子(bFGF)、胶质细胞源性神经营养因子(GDNF)、源性神经营养因子(BDNF)、血管内皮生长因子(VEGF)、神经生长因子(NGF)、肝细胞生长因子(HGF)和睫状神经营养因子(CNTF)等多种神经营养因子[21-22]来促进轴突生长和髓鞘形成[23]。BMSCs可以感知损伤信号并迁移到受损区域。骨髓间充质干细胞也具有较强的免疫调节功能,可以避免同种异体移植时的免疫排斥[24]。人参皂苷对低氧-无血清培养诱导的BMSCs的凋亡有一定的保护作用,即能抑制其凋亡[25]。半夏也被证实具有促进胚胎干细胞增殖,并向心肌细胞分化的作用[26]。为此,笔者推测麦门冬汤可能通过促进BMSCs向肺泡上皮细胞的分化,而达到疗肺纤维化的作用。
干细胞移植后的治疗疗效与移植后的细胞存活数量多少有着密切的关系。在大量实验研究发现,中医药的预处理及其含药血清对干细胞增殖预处理具有促进作用,可以提高细胞移植后的存活数量,提高治疗疗效。张文信等[27]研究发现金匮肾气丸复方含药血清通过转化BMSCs的细胞有丝分裂间期,而抑制BMSCs的凋亡,并通过提高新西兰兔BMSCs的活性,从而促进其BMSCs的增殖。詹菲等[28]发现作为补肾益精的代表方—左归丸对衰老的大鼠BMSCs的凋亡有协同抑制作用,在相关方面上证实了后天之“精”相关中医基础理论研究与BMSCs的联系,验证了BMSCs衰老以及人类衰老的根本所在是“肾精亏虚”。
肺表面活性蛋白C(SP-C)是成熟的Ⅱ型肺泡上皮细胞合成和分泌的最具特征性的蛋白,AQP-5是Ⅰ型肺泡上皮细胞特异性标志物。在本研究中,麦门冬汤组+模型组SP-C、AQP-5蛋白表达显著高于模型组、正常对照组,说明其具有促进BMSC往肺泡上皮细胞分化的作用。该作用可能是麦门冬方有效改善肺纤维化的作用机制之一。同时,笔者也注意到肺纤维化模型组SP-C、AQP-5蛋白表达也明显高于正常对照组,据此笔者推测肺纤维化模型大鼠血清中可能含有某些物质,能够改变BMSC细胞微环境,并促使其往肺泡上皮细胞分化。但具体是何种物质改变了细胞微环境,值得进一步研究。
| [1] |
Chilosi M, Doglioni C, Murer B, et al. EpitheliaI stem cell exhaustion in the pathogenesis of idiopathic pulmonary fibrosis[J]. Sarcoidosis Vasc Diffuse Lung Dis, 2010, 27(1): 7-18. |
| [2] |
Mora AL, Rojas M. Aging and lung injury repair:a role for bone marrow derived mesenchymal stem cells[J]. Journal of cellular biochemistry, 2008, 105(3): 641-647. DOI:10.1002/jcb.v105:3 |
| [3] |
赵峰, 李圣青, 遆新宇, 等. 骨髓间充质干细胞对肺损伤大鼠转化生长因子β及单核细胞趋化蛋白1的影响[J]. 中国组织工程研究与临床康复, 2008, 12(29): 5627-5630. |
| [4] |
Liu Q, Jiang JX, Liu YN, et al. Grape seed extract ameliorates bleomycin-induced mouse pulmonary fibrosis[J]. Toxicology Letters, 2017(273): 1-9. |
| [5] |
黄云鉴, 龚婕宁. 中医治疗肺纤维化方药规律的文献分析[J]. 中国实验方剂学杂志, 2016, 22(15): 206-210. |
| [6] |
赵庆波, 吴洪军, 迟铁汉, 等. 特发性肺纤维化中西医发病机制研究进展[J]. 河北医学, 2016, 22(11): 1910-1912. DOI:10.3969/j.issn.1006-6233.2016.11.068 |
| [7] |
马锦地.基于现代名老中医经验的肺痿辨证与方药规律研究[D].郑州: 河南中医学院, 2015.
|
| [8] |
瓮恒, 曲中平. 麦门冬汤加减治疗特发性肺间质纤维32例临床观察[J]. 国医论坛, 2008, 23(1): 6-7. DOI:10.3969/j.issn.1002-1078.2008.01.004 |
| [9] |
王洪, 李霞, 辛大永, 等. 养阴益气合剂对特发性肺间质纤维化气阴两虚证患者生活质量的影响[J]. 中医杂志, 2016, 57(9): 767-770. |
| [10] |
宋建平, 刘方州, 李瑞琴, 等. 栝蒌薤白汤、麦门冬汤及肾气丸对平阳霉素所致肺纤维化的影响[J]. 国医论坛, 2001, 16(4): 40-41. DOI:10.3969/j.issn.1002-1078.2001.04.043 |
| [11] |
李瑞琴, 宋建平, 张瑞, 等. 麦门冬汤对肺纤维化模型早期阶段肺组织中TNF-α、IL-10表达的影响[J]. 中医研究, 2009, 22(9): 10-13. DOI:10.3969/j.issn.1001-6910.2009.09.005 |
| [12] |
宋建平, 李伟, 李瑞琴, 等. 《金匮要略》不同方药对肺纤维化大鼠模型早期阶段(1~14 d)的影响[J]. 中国中医基础医学杂志, 2009, 15(6): 432-434. |
| [13] |
杨美凤, 谢忠礼, 宋建平. 麦门冬汤对大鼠肺纤维化形成阶段肺病理损害及下丘脑多巴胺、去甲肾上腺素、五羟色胺的干预作用[J]. 中国医药导报, 2012, 9(12): 36-38. DOI:10.3969/j.issn.1673-7210.2012.12.014 |
| [14] |
杜光明.麦门冬汤对肺纤维化大鼠肺肠组织形态学、TNF-α等的影响[D].郑州: 河南中医学院, 2015.
|
| [15] |
赵晨宇, 祝勇, 周济谱, 等. 养阴益气合剂对博来霉素所致肺纤维化大鼠的影响[J]. 中国中医药信息杂志, 2015, 22(9): 63-67. DOI:10.3969/j.issn.1005-5304.2015.09.018 |
| [16] |
王力, 吴鑫, 卢新政, 等. 人参皂苷Rg1对培养大鼠骨髓间充质干细胞增殖影响的机制研究[J]. 中国药理学通报, 2007, 23(11): 1840-1844. |
| [17] |
李佳玮, 张密霞, 周涛, 等. 人参皂苷Rg1干预骨髓间充质干细胞转化为多潜能干细胞关键基因mRNA的表达[J]. 中国组织工程研究与临床康复, 2011, 15(32): 6032-6035. DOI:10.3969/j.issn.1673-8225.2011.32.032 |
| [18] |
邬伟, 杨景全, 刘宝华, 等. 人参皂苷Rg1对痴呆大鼠脑匀浆中BMSCs的神经性分化作用[J]. 中风与神经疾病杂志, 2011, 28(3): 204-207. |
| [19] |
郑国庆, 王小同, 邬伟, 等. 人参总皂苷体外诱导大鼠骨髓间充质干细胞分化为神经元样细胞[J]. 中华中医药学刊, 2008, 26(6): 1257-1259. |
| [20] |
Shea KH, Tsui YP, Ying SC, et al. Bone marrow-derived Schwann cells achieve fate commitment-a prerequisite for remyelination therapy[J]. Experimental Neurology, 2010, 224(2): 448-458. |
| [21] |
Kim JY, Oh CH, Huang X, et al. Improvement in sensory function via granulocyte-macrophage colony-stimulating factor in rat spinal cord injury models[J]. Journal of Neurosurgery Spine, 2013, 18(1): 69-75. |
| [22] |
Chen X, Li Y, Wang L, et al. Ischemic rat brain extracts induce human marrow stromal cell growth factor production[J]. Neuropathology, 2002, 22(4): 275-279. |
| [23] |
Ji WH, Choi D, Min YL, et al. Bone Marrow-Derived Mesenchymal Stem Cells Improve Diabetic Neuropathy by Direct Modulation of Both Angiogenesis and Myelination in Peripheral Nerves[J]. Cell Transplantation, 2016, 25(2): 313. DOI:10.3727/096368915X688209 |
| [24] |
Mezey E. The therapeutic potential of bone marrow-derived stromal cells[J]. Journal of cellular biochemistry, 2011, 112(10): 2683-2687. DOI:10.1002/jcb.23216 |
| [25] |
方健康, 周轶平, 李玛琳. 中药对骨髓间充质干细胞增殖、凋亡及分化的影响研究进展[J]. 中国中药杂志, 2014, 39(15): 2834-2837. |
| [26] |
宋殿荣, 王雅楠, 张崴, 等. 小半夏加茯苓汤含药血清对小鼠胚胎干细胞体外增殖及分化的影响[J]. 天津中医药, 2011, 28(6): 486-488. |
| [27] |
张文信, 刘金文, 曹学伟, 等. 金匮肾气丸含药血清对体外兔BMSCs增殖细胞周期及凋亡的影响[J]. 辽宁中医杂志, 2011, 38(8): 1511-1514. |
| [28] |
詹菲, 徐志伟, 黄进, 等. 左归丸对衰老大鼠骨髓间充质干细胞增殖的影响[J]. 中华中医药杂志, 2015, 30(7): 2518-2521. |
2. Guangxi University of Chinese Medicine, Nanning 530011, China
 2019, Vol. 36
2019, Vol. 36