文章信息
- 谭艳辉, 张宇, 龙娟, 李辉, 刘文杰, 刘志华, 吴卫华, 刘建新
- TAN Yanhui, ZHANG Yu, LONG Juan, LI Hui, LIU Wenjie, LIU Zhihua, WU Weihua, LIU Jianxin
- 侗药血马鞭水提物对吡啶诱导的急性非感染咽喉炎大鼠的保护作用研究
- Protective effects of the water extract of Callicarpa kwangtungensis Chun on acute non-infectious rat pharyngitis induced by pyridine
- 天津中医药, 2019, 36(2): 176-180
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(2): 176-180
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.02.21
-
文章历史
- 收稿日期: 2018-10-12
2. 侗医药研究湖南省重点实验室, 怀化 418000
咽喉炎是一种炎症免疫性疾病,曾被认为是教师的职业病。由于空气污染、气候环境等多方面因素的影响,咽喉炎的发病率现已高达30%~50%,成为临床上的一种常见病和多发病,且仍有上升趋势[1-2]。咽喉炎的病因复杂、病程较长、且较难彻底治愈严重影响了人们的日常工作和生活[3]。病理研究发现,咽喉炎的主要病理表现为黏膜充血,淋巴细胞、白细胞、浆细胞等炎症性细胞的浸润[4]。目前临床上用于治疗咽喉炎的药物比较欠缺且不能完全治愈,停药后容易出现复发[5]。抗菌药物被广泛地用于治疗感染性的咽喉炎,但针对非感染性的咽喉炎,抗菌药物则不能发挥其作用[6]。糖皮质激素类药物也被用于治疗非感染性咽喉炎,但长期使用则容易出现很多全身性的不良反应[7]。因此,寻找和发现针对非感染性咽喉炎新的安全有效的治疗药物是当前急需解决的难题。
侗药血马鞭即广东紫珠(Callicarpa kwangtungensis Chun)是马鞭草科紫珠属植物,收载入《中华人民共和国药典》2015版[8],主要产于中国湖南、湖北、江西、广西等省。前期实验研究发现,药材中主要含有黄酮、苯丙素糖苷、三萜、酚酸等化学成分[9]。据民间用药记录,侗药血马鞭的根、茎、叶、花、籽均可入药,有清热解毒、凉血止血、消炎生肌、抗肿瘤等诸多功效。现代药理研究证实,侗药血马鞭具有抗炎(总黄酮)、抑菌(乙醇提取物、挥发油)、镇痛(总黄酮)、止血(乙醇提取物)等作用[10],提示侗药血马鞭在炎症免疫性疾病中具有很好和广阔的应用前景。
1 材料与方法 1.1 实验药物侗药血马鞭水提取物浸膏由湖南怀化正好制药有限公司提供。制备工艺:取1倍份血马鞭药草茎叶切段(2~3 cm),加入8倍份水,加热至100 ℃煮沸后,文火保持煮沸状态2 h过滤保留滤液。滤渣加入3倍份水重复上述步骤,取第2次过滤滤渣加入2倍份水重复提取过滤。将3次过滤的滤液合并,100 ℃加热浓缩至约1倍份容量,冷却后置于4 ℃降低温度,随后置于低温真空冻干仪中过夜冻干成干燥棕色粉末浸膏;地塞米松,片剂,安徽金太阳生化药业有限公司,批号为1605102。
1.2 动物SPF级健康雄性SD大鼠,体质量200~250 g,购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2016-0002。
1.3 试剂伊文思蓝(EB),规格每瓶1 g,购自美国Sigma公司;吡啶,规格每瓶500 mL,购自天津市化学试剂六厂三分厂;戊巴比妥钠,规格每瓶100 g,购自美国GENEWIZ公司;甲酰胺,规格每瓶500 mL,购自于国药集团化学试剂有限公司。
1.4 仪器UV-4802紫外可见分光光度计,上海巴玖实业有限公司;AUY120分析天平,Shimadzu(岛津)制作所;RM2235病理切片机,Leica(莱卡)微系统有限公司;Axio Scope A1显微镜,ZEISS(蔡司)公司;Histostar包埋机,Thermo Shandon Limited(赛默飞世尔科技)有限公司。
1.5 方法 1.5.1 动物分组、给药及造模将SD大鼠按随机数字表法随机分为正常对照组(灌胃生理盐水,咽部擦拭生理盐水)、模型对照组(灌胃生理盐水;咽部擦拭10%吡啶)、吡啶+侗药血马鞭灌胃组(灌胃低、高剂量500、1 000 mg /kg,咽部擦拭10%吡啶)、吡啶+地塞米松组(灌胃地塞米松4 mg/kg,咽部擦拭10%吡啶)。大鼠预处理给药连续5 d,每天早晚各1次。最后1次给药1 h后,大鼠腹腔注射戊巴比妥钠(剂量60 mg/kg,浓度2%)麻醉。约5 min后,大鼠尾静脉注射EB(剂量30 mg/kg,浓度5 mg/mL)。10 min后,用止血钳和镊子打开大鼠口腔,将大鼠舌往外稍提出并拉往一边,采用棉签吸取130 μL 10%吡啶溶液,并将其深入大鼠咽部直到感受到阻力,再稍微往回拉,停留转动5 s,连续3次。造模1 h后,处死大鼠,拍照并取材。
1.5.2 EB-甲酰胺标准曲线的制作精密称取0.052 5 g EB固体粉末溶于7 mL甲酰胺溶剂中,涡旋混匀,取1 mL用等体积稀释法将其再依次稀释4个浓度梯度(5个浓度分别为7.5、3.25、1.812 5、0.906 25、0.453 125 μg/mL),紫外可见分光光度法(620 nm)分别测定5个不同浓度的EB-甲酰胺溶液的吸光度,并根据吸光度值和浓度绘制标准曲线。
1.5.3 咽部组织中EB渗透含量测定取各组大鼠咽部组织,并称质量。加入3.5 mL甲酰胺溶剂,55 ℃温育24 h,然后测量每个样品在620 nm处的吸光度值,根据EB-甲酰胺标准曲线计算出每个样本的EB量。
1.5.4 咽部组织病理检测每组随机取3只大鼠不行EB注射,使其咽部组织不被染料渗透,其余实验步骤同前。实验结束后获取大鼠咽部组织,用生理盐水将其洗净并吸干表面水分后置于4%甲醛溶液固定3 d,然后将组织采用乙醇梯度脱水、二甲苯透明、浸入软蜡除去二甲苯,随后进行包埋、切片。采用苏木精-伊红(HE)染色法染色,封片后镜下观察组织形态。
1.6 统计学分析采用Graphpad Prism 5.0软件包进行统学分析,实验数据均用均数±标准差(x±s)表示。多组间比较采用单因素方差分析,P < 0.05表示差异具有统计学意义。
2 结果 2.1 侗药血马鞭水提取物对吡啶诱导的急性咽喉炎大鼠咽喉部炎症反应的保护作用见图 1。正常对照组大鼠咽喉组织部位蓝色较浅,提示EB渗出较少、咽喉组织部位未有明显的炎症反应。10%吡啶溶液涂抹大鼠咽喉部位造模后,模型对照组大鼠的咽喉组织部位蓝色明显加深,提示EB大量渗出、咽喉组织存在明显的炎症反应。阳性药物地塞米松干预组大鼠咽喉组织部位蓝色深度明显弱于模型对照组大鼠,提示地塞米松可抑制吡啶所诱导的咽喉部组织炎症反应。与地塞米松组大鼠相似,侗药血马鞭水提取物高、低剂量组大鼠咽喉组织部蓝色也明显弱于模型对照组大鼠,且呈剂量依赖,提示侗药血马鞭水提取物对吡啶诱导的大鼠咽喉炎具有很好的保护作用。
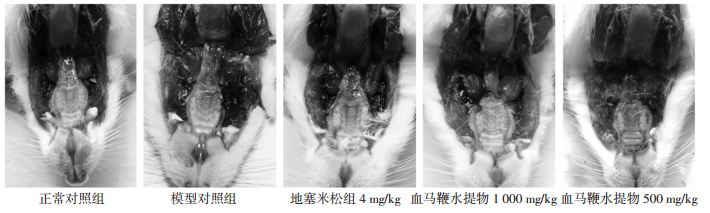
|
| 图片为相机拍摄所获得,拍摄时已尽量保持每只大鼠的拍摄光照环境和角度一致,每组只选取了一张具有代表性的图片。 图 1 侗药血马鞭水提物对吡啶诱导的大鼠咽部组织形态损伤的影响 Fig. 1 Effect of the water extract of Callicarpa kwangtungensis Chun on pyridine-induced morphological damage of rat |
以所测不同浓度EB-甲酰胺溶液的吸光度值为纵坐标,EB浓度为横坐标作图得到EB-甲酰胺标准曲线,见图 2。回归方程为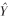
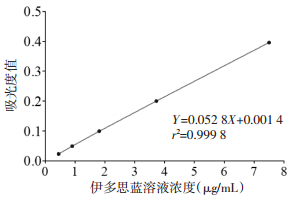
|
| 图 2 伊文思蓝溶液的标准曲线 Fig. 2 Standard curve for Evans blue |
|
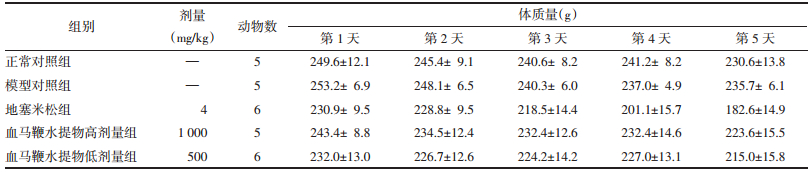
大鼠的体质量分别于实验过程中每天称质量获得。见表 2,除地塞米松组大鼠外,其余各组大鼠的体质量在实验过程中基本保持在稳定的水平,未出现明显的下降。但阳性药物地塞米松组大鼠自实验开始后,大鼠体质量呈现逐渐的下降,到实验最后一次称质量时组内大鼠体质量平均下降约50 g。
|
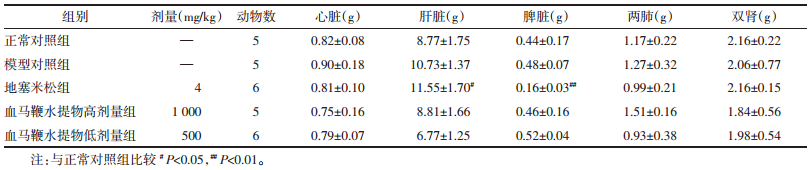
大鼠处死后,各脏器包括心脏、肝脏、肺脏、脾脏、肾脏被分离和称质量。结果发现,与正常对照组大鼠比较,地塞米松组大鼠肝脏质量明显增加(P < 0.05)而脾脏质量则显著的低于正常组大鼠(P < 0.01),见表 3。而其余各组大鼠各脏器质量与正常组无显著差异。结果提示,侗药血马鞭水提物的治疗安全性优于地塞米松。
|
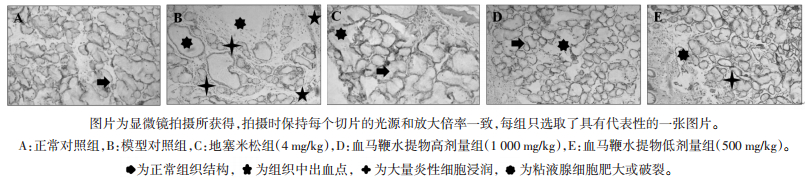
大鼠造模完成后,获取各组大鼠咽喉组织进行病理检测,见图 3。正常对照组大鼠咽喉组织黏液腺细胞排列紧凑、且未观察到明显的炎性细胞的浸润;而模型对照组大鼠的咽喉组织中则表现为中性粒细胞大量的浸润、黏液腺细胞排列分散不规则且部分肥大破裂,并伴随出血;地塞米松和侗药血马鞭水提物高剂量组大鼠咽喉组织仅出现轻微出血、镜下观察不到较大的出血点,细胞排列相比模型对照组大鼠有相当大的改善,仅出现个别的黏液腺细胞肥大的状况;侗药血马鞭水提物低剂量组大鼠咽喉组织情况仅比模型组稍有改善,但仍有黏液腺细胞破裂肥大、中性粒细胞增多的表现。提示侗药血马鞭水提取物和阳性药物地塞米松对吡啶所诱导的急性咽喉炎大鼠咽喉组织损伤有较好的保护作用。
|
| 图 3 侗药血马鞭水提物对吡啶诱导的大鼠咽部组织病理损伤的保护作用(×400) Fig. 3 Protective effect of the water extract of Callicarpa kwangtungensis Chun on against pyridine-induced histological changes in rat(×400) |
本研究初步证明了侗药血马鞭水提取物对吡啶诱导的急性非感染性咽喉炎大鼠模型具有较好的保护作用。
目前,实验性咽喉炎动物模型的种类不多,其中以氨水直接喷雾大鼠咽喉组织来复制的急性咽喉炎大鼠模型较为经典[11],但死亡率过高,因此使用非常受限。本实验采用10%的吡啶溶液来建立大鼠急性咽喉炎模型来评估侗药血马鞭水提取物的抗咽喉炎作用。该模型于2014年被G.L.Viswanatha等[12]报道,相比氨水急性咽喉炎模型,具有低死亡率、高成功率等优点。实验发现,该模型建立简单,且容易控制,造模成功率高。但本模型的建立与G.L.Viswanatha课题组所建立的动物模型还存在有一些差异,比如采用尾静脉注射EB溶液,而他们则需要建立静脉给药通道,因此本实验的操作大大的缩短了模型建立的时间和减少了对动物的损伤,更有利于药物的治疗评价。
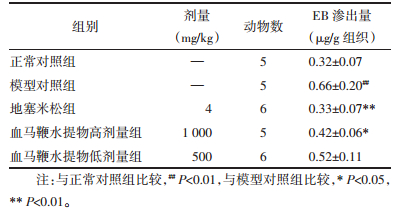
咽喉组织EB渗出量的增加是吡啶诱导建立大鼠咽喉炎模型成功与否的判断指标之一,也是药物干预治疗作用的主要药效评价指标[13]。实验结果发现,模型对照组大鼠咽喉组织EB渗出较正常对照组大鼠明显增加,EB渗出检测分析具有统计学意义,表明模型复制成功。侗药血马鞭水提取物干预组大鼠EB渗出较模型组比较有明显的减少,其中高剂量组具有统计学意义。提示,侗药血马鞭水提物对非感染性咽喉炎具有很好的保护作用。为了进一步评价侗药血马鞭水提物的抗咽喉炎作用和阐明其抗咽喉炎作用是否与减轻咽喉组织局部炎症反应的相关性,研究中对各组大鼠咽喉组织进行病理检测分析。与正常对照组大鼠相比,模型对照组的大鼠咽喉组织受损严重,咽喉组织中可观察到明显的出血点和大量的炎性细胞浸润,这些病理的改变与前期同类模型的报道一致[14],进一步表明模型建立成功。而采用侗药血马鞭药物干预组的大鼠咽喉组织病理损伤明显减轻、炎性细胞的浸润显著降低。这些结果提示,侗药血马鞭水提取物减轻咽喉炎病理损伤主要与其减少炎性细胞的浸润有关。同时实验也发现,阳性药物地塞米松组大鼠咽喉组织EB的渗出几乎和正常对照组大鼠相当,表明地塞米松具有强大的抗急性咽喉喉炎作用。而对大鼠体质量变化分析发现,实验过程中地塞米松组大鼠的体质量持续下降,到最后一次给药,体质量较其它组大鼠下降非常明显。对各组大鼠各主要脏器质量称质量发现,地塞米松组大鼠肝脏质量明显增加,而脾脏的质量则显著下降。事实上,地塞米松经常作为抗炎和免疫抑制药被广泛的应用于临床,但长期应用所给患者带来的不良反应也是令临床医生非常所担心的问题[15]。值得注意的是,本实验中的试验药物侗药血马鞭水提取物组大鼠并未发现地塞米松组大鼠所出现的不良反应,初步表明侗药血马鞭水提取物在用于治疗炎症免疫性疾病中的安全性要明显优于地塞米松。
| [1] |
王顺民. 中小学教师慢性咽炎发病率调查分析[J]. 卫生职业教育, 2010, 28(7): 122-124. DOI:10.3969/j.issn.1671-1246.2010.07.080 |
| [2] |
梁彦, 丁莎. 慢性咽炎试试整体点穴[J]. 中医健康养生, 2017, 3(2): 55-55. DOI:10.3969/j.issn.2095-9028.2017.02.029 |
| [3] |
Somro A, Akram M, Khan M I, et al. Pharyngitis and sore throat:A review[J]. African Journal of Biotechnology, 2011, 10(33): 6190-6197. |
| [4] |
梁璐, 朴晋华, 马建丽. 急性和慢性咽炎的发病机制与动物模型建立的研究现状[J]. 临床医药实践, 2012, 21(7): 540-542. DOI:10.3969/j.issn.1671-8631.2012.07.027 |
| [5] |
Di MF, Barucco M, Guerriero F. Diagnosis and treatment of acute pharyngitis/tonsillitis:a preliminary observational study in General Medicine[J]. European Review for Medical and Pharmacological Sciences, 2016, 20(23): 4950-4954. |
| [6] |
Kannan I, Edwin B, Prasanna V, et al. Aetiology and the use of antibiotics in the case of acute pharyngitis:A review[J]. International Journal of Pharmaceutical & Clinical Research, 2015, 7(4): 226-230. |
| [7] |
Korb K, Scherer M, Chenot J F. Steroids as adjuvant therapy for acute pharyngitis in ambulatory patients:a systematic review[J]. Annals of Family Medicine, 2010, 8(1): 58-63. |
| [8] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015.
|
| [9] |
陈冈, 付辉政, 戴冕, 等. 侗药血马鞭茎和叶乙醇水提取物的乙酸乙酯溶性部位化学成分研究(Ⅱ)[J]. 中国现代中药, 2017, 19(8): 1117-1119. |
| [10] |
聂韡, 朱培林, 黄丽莉, 等. 侗药血马鞭药材的研究进展[J]. 中国现代中药, 2011, 13(9): 37-39. DOI:10.3969/j.issn.1673-4890.2011.09.011 |
| [11] |
封银曼, 王停, 高志卿, 等. 急性咽炎动物模型研究[J]. 中国实验方剂学杂志, 2001, 7(3): 52. DOI:10.3969/j.issn.1005-9903.2001.03.022 |
| [12] |
Viswanatha GL, Thippeswamy AH, Rafiq M, et al. Novel experimental model of non-infectious pharyngitis in rats[J]. Journal of pharmacological and toxicological methods, 2014, 69(2): 189-195. DOI:10.1016/j.vascn.2013.12.001 |
| [13] |
Uemura J, Nagpal R, Zerbinati N, et al. Effect of VBC-1814/7J, a poly-phytocompound, on a non-infectious model of pharyngitis[J]. Experimental and therapeutic medicine, 2017, 13: 3075-3080. DOI:10.3892/etm.2017.4332 |
| [14] |
Viswanatha GL, Thippeswamy AH, Thippeswamy HC, et al. Ameliorative effect of Koflet formulations against pyridine-induced pharyngitis in rats[J]. Toxicology Reports, 2014(1): 293-299. |
| [15] |
Li Y, Zheng B, Tian H, et al. Yupingfeng Powder relieves the immune suppression induced by dexamethasone in mice[J]. Journal of ethnopharmacology, 2017(200): 117-123. |
2. Hunan Provincial Key Laboratory of Dong Medicine, Huaihua 418000, China
 2019, Vol. 36
2019, Vol. 36




