文章信息
- 黄凤玉
- HUANG Fengyu
- 滇黄精对急性肺损伤模型大鼠的炎症因子及体内氧自由基的影响
- Effect of Polygonatum kingianum on inflammatory factors and oxygen radical of acute lung injury model rat
- 天津中医药, 2019, 36(2): 181-184
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(2): 181-184
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.02.22
-
文章历史
- 收稿日期: 2018-11-08
急性肺损伤性肺炎(ALI)指各种内外应激源导致的弥漫性肺泡实质损伤和急性进行性呼吸胁迫症,常表现顽固性低氧血综合征[1-3]。它代表了肺损伤发展延续的整个过程,是全身炎症综合征(SIRS)体内失控的持续性自我放大和破坏过程,常伴随多种炎性因子和氧自由基的释放,会引起肺部微血管通透性增高、炎性细胞浸润,富含多种蛋白质的渗出液肺泡内蓄积时[4-5],肺部正常生理状态难以持续,多发生肺水肿和透明膜,长期迁延还会导致间质纤维化[6],发生肺实变,因此对急性损伤性肺炎的炎症因子、炎性细胞和氧自由基相关指标的检测[7-9]可以很好地反应机体的肺生理状态[10-11]。本研究选用气管内滴灌内毒素脂多糖(LPS)的急性肺损伤性大鼠模型,从炎症、氧化损伤和肺生理状态角度来观察滇黄精对急性肺损伤性肺炎大鼠的影响,报道如下。
1 资料与方法 1.1 实验材料50只健康的雄性SD大鼠,体质量185~215 g(维通利华有限公司,北京);滇黄精水提液(绿生药业有限公司,云南);LPS(Sigma,美国);吉姆萨染液(雷根生物,北京);酶联免疫吸附法(ELISA)试剂盒(康为世纪生物科技有限公司,北京);辣根过氧化物酶标二抗(Abcam,美国)髓过氧化物酶(MPO)和丙二醛(MDA)检测试剂盒(建成生物工程研究所,南京)。
1.2 方法随机分组50只SD雄性大鼠,每组10只,分别标注:正常对照组(NCG),模型组(NMG),滇黄精低剂量组(LLG)、中剂量组(MLG)、高剂量组(HLG)。ALI模型建立:10%水合氯醛4 mL/kg腹腔注射麻醉后,将大鼠50°仰卧保定并剥离气管,1 mL注射器缓缓滴入配好的LPS(5 mg/kg),并立即旋转,使LPS均匀分布[9, 12]。对正常对照组大鼠应气管内滴注等体积的生理盐水,股动脉取血进行血气分析,PaO2≤85%,PaCO2≥40%为造模成功。确定造模成功后4 h开始腹腔注射配好的滇黄精水提液,24 h后开始检测相关指标[12-13]。
1.3 观察指标血清中各炎症因子和氧化自由基相关指标检测:取大鼠左心室1 mL血液与标准品混合,加入转化生长因子(TGF)-α、白介素-6(IL-6)、白介素-10(IL-10)和白介素-1β(IL-1β)单抗包被的酶标板,室温放置2 h后用磷酸缓冲盐溶液(PBS)洗4次,加入抗抗体,室温孵育2 h,再用PBS洗4次,加入酶标抗体后30 min,PBS洗4次,加入A、B显色液后加终止液,酶标仪下检测相应比色值并计算各炎症因子的含量。按说明书采用硫代巴比妥钠酸法和亚硝酸盐法检测血清MDA、MPO含量和超氧化物歧化酶(SOD)、谷胱甘肽过氧化酶(GSH-Px)活性[12-14]。肺泡灌流液中炎性细胞计数:收集肺泡灌流液中炎性细胞时,用25%乌拉坦处死大鼠,分理出气管和肺后切开气管并插入塑料管,15 mL生理盐水反复冲洗,纱布过滤回收灌洗液,吉姆萨染色后计数各炎性细胞数量。肺生理指标检测:股动脉取血,离心分离血清后血气生化分析仪检测PaO2值。采血后用剪刀剪开大鼠胸腔,取出全部肺并用滤纸吸去表面残留液体,称质量计算肺系数(LI):[肺质量(mg)/大鼠体质量(g)×10];取新鲜左肺,称质量后60 ℃烘箱连续烘干48 h后称质量,计算W/D[肺湿质量(mg)/干质量(mg)×100%]、含水量[(W-D)/W×100%]。
1.4 统计学分析使用SPSS 21.0软件对数据进行统计分析,计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
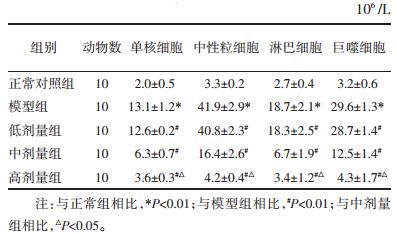
2 结果 2.1 滇黄精对急性肺损伤模型大鼠LI、W/D、肺含水量以及动脉氧分压的影响与正常组大鼠相比,模型组大鼠的LI、W/D、(W-D)/W明显升高,PaO2明显降低,差异具有统计学意义(P<0.01),说明造模成功。与ALI组相比,实验组大鼠的LI、W/D、(W-D)/W明显降低,PaO2明显升高,差异具统计学意义(P<0.01),而且高剂量组与中剂量组相比有明显差异(P<0.01),这种趋势有剂量依赖性,结果见表 1。
|
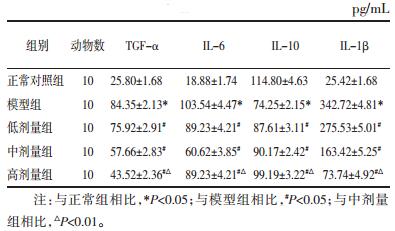
数据显示,模型组大鼠的肺泡灌流液中单核细胞、中性粒细胞、淋巴细胞和巨噬细胞细胞数量显著增加(P<0.01),而滇黄精使用的各实验组炎性细胞数量均下降(P<0.01),而且高剂量组与中剂量组相比有明显差异(P<0.05),这种趋势有剂量依赖性,见表 2。
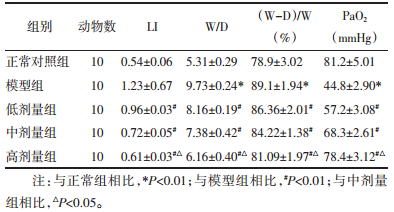
数据显示,模型组大鼠血清中TGF-α、IL-6、IL-1β比对照组高,IL-10水平低(P<0.05),而实验组大鼠的血清中TGF-α、IL-6、IL-1β水平比模型组低,IL-10水平高(P<0.05),高剂量组与中剂量组相比有明显差异(P<0.05),这种趋势有剂量依赖性。见表 3。
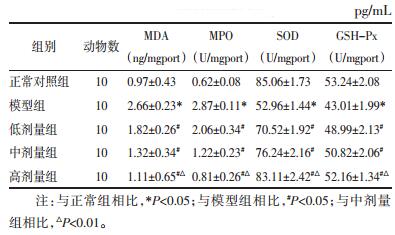
数据显示,模型组大鼠血清中MDA、MPO比对照组高,SOD、GSH-Px比对照组低(P<0.05);而实验组大鼠的血清中MDA、MPO水平比模型组低,SOD、GSH-Px水平高(P<0.05),高剂量组与中剂量组相比有明显差异(P<0.05),这种趋势有剂量依赖性。见表 4。
|
急性损伤性肺炎是一种致病因素引起全身炎性反应综合征集中于肺部表现的疾病[1, 3],多表现肺部或全身炎症反应的过度失控,参与其中的炎性细胞主要有中性粒细胞(也叫多核白细胞)、肺单核巨噬细胞、肺泡上皮细胞和血管内皮细胞等。应激原刺激后机体常产生大量炎性介质,如TNF-α、IL-1β、IL-6,而抗炎因子IL-10多表现为低表达[4-5]。这些炎症因子在肺局部的活化,启动了“细胞和细胞因子网络”系统,进而启动“瀑布样”炎症连锁反应,增强肺组织细胞通透性,使大量高蛋白液体进入肺部,改变肺部生理稳态,诱发急性肺水肿,多表现为LI、W/D、(W-D)/D和PaO2的改变。急性肺损伤发生时,多引起机体氧自由基的损伤,增强肺组织氧化应激水平,通过直接、间接作用导致肺组织损伤。MDA是自然状态下体内氧自由基过度氧化胞膜脂肪酸引起,它与体内氧自由基损伤水平呈正相关[7]。而机体过度氧化会降低SOD和GSH-Px的活性[15],两者均为抗过氧化物质,活性降低时,过氧化反应增强,体内氧化-抗氧化平衡向氧化方向偏移,使体内的氧化损伤不断恶化。LPS是一种革兰阴性菌的胞外成分,主要活性物质是脂多糖,近年来研究人员多采用LPS的注射建立感染后ALI模型,诱发多种炎性因子和氧自由基的释放。急性损伤性肺炎常用的造模方法有4种——雾化吸入法、气管滴入法、腹腔注射法和尾静脉注射法[9]。研究表明,经支气管低注导致的肺损伤模型病理指标最明显,最符合本研究对模型动物的实验要求,而且直接支气管注射的方法会减少对机体其他部位的毒副作用,还能有效降低死亡率[8-11],因此本研究采用气管滴注LPS的方法制作ALI模型。
黄精主要活性成分有多糖、氨基酸、黄酮、蒽醌类化合物等[12],黄精多糖可以抗病毒、降血糖血脂增强机体免疫力。黄精总皂苷可以抗氧化、改善机体血糖水平,有效调节机体的稳态,降低机体损伤时氧化水平,而滇黄精水提液可以很好地保持黄精各种活性成分的生理生化特性,不使其因为加工丧失或部分丧失活性,达到更加客观地评价滇黄精功效的作用。因此本研究选取不同浓度的滇黄精水提液,观察其在24 h内对ALI模型小鼠的炎性状态、氧化水平和肺生理的改善效果。结果发现,滇黄精注射的各实验组中,促炎因子IL-1β、IL-6、TGF-α明显高于模型组大鼠,作为抗炎因子的IL-10水平低于模型组(P<0.05),这说明滇黄精可以通过促进炎症因子、炎性反应进程来充分发挥炎症的保护作用,从而降低机体应激水平,维持机体稳态,而且高剂量组的这种趋势明显优于中剂量组(P<0.05),说明24 h内滇黄精对急性肺损伤大鼠模型的这种保护作用有剂量依赖倾向。肺生理指标和各分组内炎性细胞的数量差别也佐证了这点。造模成功大鼠注射滇黄精后肺泡灌流液中MDA和MPO水平下降(P<0.05),说明滇黄精的注入降低了大鼠体内的氧化损伤水平,抗过氧化物SOD和GSH-Px活性增强也说明实验鼠体内的过氧化反应降低(P<0.05),进一步阐明了滇黄精对LPS诱导急性肺损伤性大鼠模型的氧自由基影响。
综上所述,滇黄精可以有效改善LPS诱导的急性肺损伤性大鼠模型体内的炎症反应水平,避免炎性细胞在肺泡局灶的过度堆积,降低炎症反应对机体的氧自由基损伤,降低机体发生肺水肿的可能性,从而遏制了疾病的进一步发展。
| [1] |
Castillo RL, Loza RC, Romero DC. Pathophysiological approaches of acute respiratory distress syndrome: novel bases for study of lung injury[J]. 2015, 9, Suppl 2: 83-91.
|
| [2] |
Butt Y, Kurdowska A, Allen TC. Acute lung injury:a clinical and molecular review[J]. Archives of Pathology & Laboratory Medicine, 2016, 140(4): 345-350. |
| [3] |
温换芳, 苗杰. 甘草黄酮对脓毒症急性肺损伤大鼠的保护作用[J]. 安徽医药, 2016, 20(8): 1440-1442. DOI:10.3969/j.issn.1009-6469.2016.08.005 |
| [4] |
李琴, 樊佳, 陈斌, 等. 自噬对脂多糖致大鼠急性肺损伤模型的炎症调控[J]. 中华实用诊断与治疗杂志, 2017, 31(4): 328-331. |
| [5] |
Yu W, Yang Z, Ling W, et al. The Role of Autophagy in Kidney Inflammatory Injury via the NF-κB Route Induced by LPS[J]. International Journal of Medical Sciences, 2015, 12(8): 83-91. |
| [6] |
尹晓峰, 钱国强, 樊毫军, 等. 静脉注射全氟化碳预处理与后处理对急性肺损伤大鼠的影响[J]. 重庆医学, 2017, 46(8): 1020-1022. DOI:10.3969/j.issn.1671-8348.2017.08.005 |
| [7] |
吕娟, 白甫, 魏鹏飞. 姬松茸多糖对糖尿病大鼠氧自由基及炎症相关因子的影响[J]. 贵州医药, 2017, 41(2): 139-140. DOI:10.3969/j.issn.1000-744X.2017.02.010 |
| [8] |
李红日, 张琪, 孙春荣, 等. 小剂量氢化可的松与甲泼尼龙对急性肺损伤大鼠的保护作用比较[J]. 临床和实验医学杂志, 2017, 16(15): 1463-1466. DOI:10.3969/j.issn.1671-4695.2017.15.003 |
| [9] |
汤明杰, 叶永山, 曹春琪, 等. 内毒素诱导大鼠急性肺损伤模型的动态研究[J]. 现代生物医学进展, 2015, 15(1): 25-28. |
| [10] |
罗鹏, 周振兴. 血必净对大鼠急性肺损伤的保护作用[J]. 中国应用生理学杂志, 2017, 33(2): 132-135. |
| [11] |
樊菲菲, 高新星, 杨振村, 等. 地塞米松联合依达拉奉对百草枯中毒所致大鼠急性肺损伤模型的救治[J]. 临床急诊杂志, 2017(3): 194-197. |
| [12] |
陆建美, 闫鸿丽, 王艳芳, 等. 滇黄精及其活性成分群对α-糖苷酶活性抑制作用研究[J]. 中国现代中药, 2015, 17(3): 200-203. |
| [13] |
沈琪琦, 乔建瓯. 参附注射液对大鼠急性肺损伤保护作用的实验研究[J]. 中国中医急症, 2017, 26(6): 944-946. DOI:10.3969/j.issn.1004-745X.2017.06.002 |
| [14] |
王晴, 韩文杰, 张旗, 等. 玄参对内毒素诱导的急性肺损伤大鼠的保护作用[J]. 现代中药研究与实践, 2017, 31(1): 28-31. |
| [15] |
黄倩, 蔡艳春, 危晓莉, 等. 人工合成红景天苷对大鼠急性肺损伤的保护作用[J]. 生理学报, 2017, 91(3): 291-297. |
 2019, Vol. 36
2019, Vol. 36