文章信息
- 梁旭, 李雁, 李昕
- LIANG Xu, LI Yan, LI Xin
- 基于网络药理学原理的黄芪-金银花药对干预急性呼吸窘迫综合征的分子机制研究
- Molecular mechanism research of Stragalus Radix and Lonicerae Japonicae Flos drug pair for acute respiratory distress syndrome based on the principle of network pharmacology
- 天津中医药, 2019, 36(2): 188-194
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(2): 188-194
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.02.24
-
文章历史
- 收稿日期: 2019-01-05
2. 北京中医药大学东直门医院教育处, 北京 100700
急性呼吸窘迫综合征(ARDS)是由多种病因如感染、创伤等导致的以进行性呼吸困难、顽固性低血氧症和肺组织水肿为主要特征的临床常见急危重症[1]。ARDS的西医治疗目前以保护性机械通气、限制性液体管理等支持治疗和控制原发病为主。Meta分析研究表明[2],中西医结合治疗ARDS在降低病死率等方面优势明显,中药复方具有多靶点治疗疾病的特点,对ARDS的防治具有广阔的应用前景。
根据临床表现,ARDS可归属于中医暴喘、肺衰等病的范畴。中医学认为肺气虚损,毒瘀互阻,进而导致肺气衰败是ARDS的关键病机[3]。课题组在前期工作中采用国家级名老中医杜怀棠教授经验方益气化瘀解毒方对ARDS模型大鼠进行干预[4-6],可显著减轻大鼠肺组织损伤程度,提高肺系数及肺通透指数,并可明显下调炎症因子及关键炎症蛋白的表达,其具体的作用机制有待进一步阐明。
本研究基于网络药理学原理,应用整合药理学平台[7] (TCMIP,http://www.tcmip.cn/,中国中医科学院)对课题组前期有效方益气化瘀解毒方中的益气-解毒药对——黄芪-金银花进行研究,构建其干预ARDS作用机制的“中药-成分-靶标-通路”复杂网络,为该复方治疗ARDS的分子机制深入研究和进一步明确ARDS的发病机制提供科学依据。
1 数据来源与方法 1.1 黄芪-金银花化学成分收集TCMIP依据《中国药典》(2015年版),收录了400余味常用中药材信息[7]。在其中药信息设定界面对“黄芪”、“金银花”进行检索并收集其所有化学成分,建立黄芪-金银花化学成分信息数据库。
1.2 ARDS疾病候选靶标收集在整合药理学平台疾病靶标信息数据检索界面,以急性呼吸窘迫综合征的英文缩写“ARDS”作为关键词进行检索,可收集到疾病靶标数据库中目前已知的ARDS治疗靶点,作为“黄芪-金银花”药对的候选治疗靶标,靶标信息主要包括治疗“ARDS”药物的名称、疗效、临床应用、作用靶标的基因及蛋白质等相关信息。
1.3 靶标预测通过在中药靶标预测界面选取相似性分数≥0.8的所有药物靶标作为“黄芪-金银花”药对的潜在作用靶标,建立药物候选靶标信息数据库。TCMIP平台利用OpenBabel软件对中药成分进行二维结构相似性检索,并采用Tanimoto系数定义的相似度计量方法,通过与食品药品监督管理局(FDA)上市药物进行化学结构相似性比对[8-9]。
1.4 蛋白质-蛋白质相互作用信息(PPI)TCMIP整合了HAPPI、InAct、HPRD、Reactome、OPHID、MINT、PDZBase、DIP等数据库中蛋白质-蛋白质相互作用信息。通过该平台的PPI数据库,可获得“黄芪-金银花”药对作用的潜在靶标与ARDS疾病靶标之间的PPI。
1.5 网络构建与分析通过网络分析,计算“黄芪-金银花”药对潜在靶标与治疗ARDS的疾病靶标之间的PPI信息网络特征值,以节点连接度(degree)的2倍中位数为卡值,选取中药靶标-疾病靶标互作网络的核心节点;在此基础上,以节点连接度、节点紧密度和节点介度的中位数为卡值,选取同时满足3个卡值的节点为“黄芪-金银花”药对潜在靶标-ARDS疾病靶标相互作用网络的关键节点[10]。通过基因功能和通路的富集分析,挖掘分析“黄芪-金银花”药对治疗ARDS关键网络靶标及其对应的活性成分,并构建“中药-核心成分-关键靶标-主要通路”的网络通路图,进一步明确中药干预ARDS的分子作用机制。
1.6 关键靶标分析及通路富集TCMIP整合基因本体数据库GO(gene ontology,http://www.geneontology.org/)和KEGG通路数据库(Kyoto Encyclopedia of Genes and Genomes,http://www.kegg.jp)资源,可直接提取靶标基因或蛋白质的分子功能、细胞内定位及其所参与的生物学反应和通路,对“黄芪-金银花”药对干预ARDS的关键作用靶标进行基因功能和通路富集分析,并以P降序的方式将GO和KEGG计算分析的结果排列显示。
2 结果 2.1 “黄芪-金银花”药对化学成分靶标预测及分析通过TCMIP数据库共收集得到黄芪化合物成分29个,主要为黄芪皂苷类和黄芪多糖类;金银花化合物成分47个,主要为忍冬皂苷、金银花黄酮、金银花缩醛苷类。针对上述成分,共预测出黄芪的潜在作用靶标1 273个,金银花的潜在作用靶标537个,经相似性分数≥0.8筛选后,得到黄芪预测靶标185个,金银花预测靶标38个,两者共有的靶标21个,提示黄芪和金银花在共性靶标之间存在潜在的叠加作用。
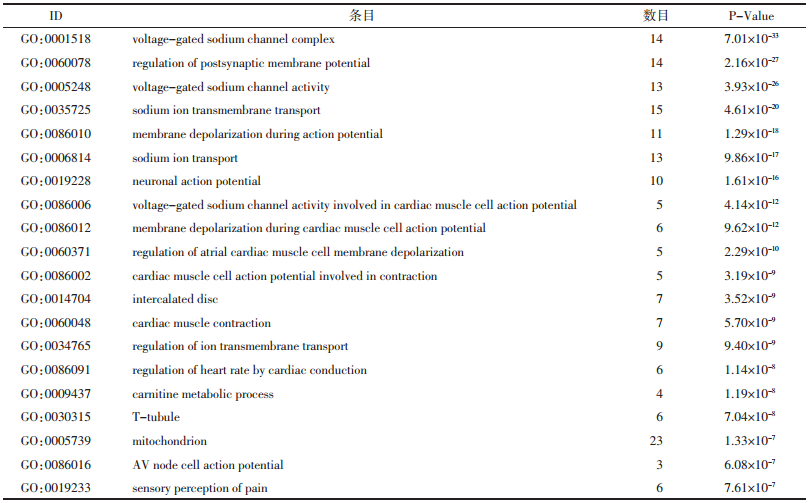
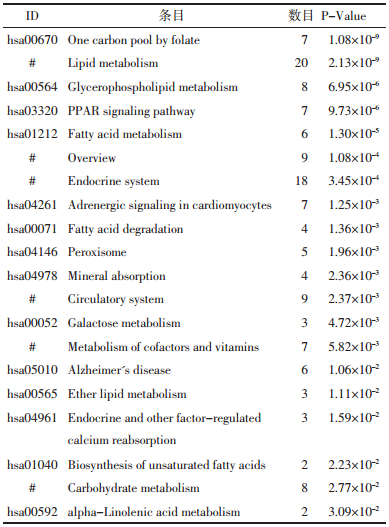
对“黄芪-金银花”药对候选靶标进行基因分析,取P排名前20得到候选靶标具有的基因功能信息见表 1,可见其功能涉及突触后膜电位的调节、电压门控钠离子通道的活动、离子跨膜转运的调节、肉碱代谢过程、线粒体功能调节、AV节点细胞动作电位、感官知觉及痛觉等。对“黄芪-金银花”候选靶标进行通路富集分析,取P排名前20得到候选靶标参与的通路信息见表 2,可见涉及通路主要有PPAR信号通路、过氧化物酶体、循环系统、半乳糖代谢、辅因子和维生素的代谢、内分泌系统、心肌细胞肾上腺素能信号转导、脂质代谢、不饱和脂肪酸的生物合成、α-亚麻酸代谢等。
|
|
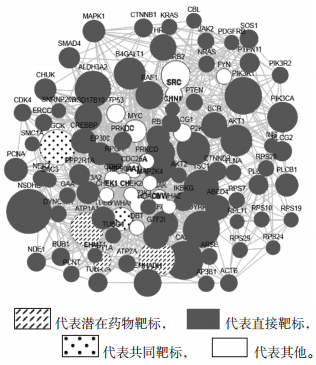
通过TCMIP的PPI相互作用数据库,构建“黄芪-金银花”药对的潜在靶标与疾病靶标相互作用网络。根据条件筛选出关键靶标659个,根据degree排序显示排名前100的靶点,得到黄芪-金银花治疗ARDS的候选靶标网络,见图 1,其中已知治疗ARDS的直接靶标(known disease target)78个,潜在药物靶标(putative drug target)3个,共同靶标(common target)2个。图中节点的大小与degree成正比关系,同时根据比较图中节点介度大小,发现TSC1、NSDHL、GRB2、MYC、MAP2K等关键靶标介度值明显大于其他靶标,在网络中发挥重要作用。
|
| 图 1 “黄芪-金银花”药对干预ARDS的候选靶标网络 Fig. 1 Network of Stragalus Radix and Lonicerae Japonicae Flos candidate targets for ARDS |
以上关键靶标中,部分已知靶标如:甾醇-4-α-羧酸盐3-脱氢脱羧酶(NSDHL)主要与3-β-羟基-δ5-甾体脱氢酶活性、小分子代谢过程、迷路层血管发育等相关;外周血质膜蛋白(CASK)功能主要涉及ATP结合、蛋白质丝氨酸/苏氨酸激酶活性、鸟苷酸激酶活性、细胞黏附、RNA聚合酶Ⅱ启动子转录的正调节、GMP代谢过程、突触传递、神经递质分泌的正调节等;双特异性酪氨酸磷酸化调节激酶1A(DYRK1A)功能主要与蛋白激酶活性、ATP结合、tau蛋白结合、mRNA剪接的负调节、有丝分裂细胞周期的正调节、蛋白质磷酸化、DNA损伤反应的负调节等相关;磷脂酰肌醇3-激酶调节亚基α(PIK3R1)功能主要涉及1-磷脂酰肌醇-3-激酶调节剂活性、蛋白磷酸酶结合、ErbB-3类受体结合、内质网应激、Fc-γ受体信号通路、转录的正向调节、血管内皮生长因子受体信号通路、外源性凋亡信号通路、凝血功能、肿瘤坏死因子产生的正调节、Fc-epsilon受体信号通路、白细胞迁移、成纤维细胞生长因子受体信号通路、T细胞受体信号通路;双特异性丝裂原活化蛋白激酶激酶1(MAP2K1)主要与MAP激酶活性、ATP结合、神经营养素TRK受体信号通路、基因表达的正调节、Toll样受体信号通路、调节应激激活的丝裂原活化蛋白激酶(MAPK)级联反应、ERK1和ERK2级联反应、Ras蛋白信号转导、小GTP酶介导的信号转导、先天免疫应答、血管内皮生长因子受体信号通路、Fc-epsilon受体信号通路、细胞迁移的正调节、RNA聚合酶Ⅱ启动子、上皮细胞增殖参与肺形态发生、对氧化应激的反应等功能相关;RAC-α丝氨酸/苏氨酸-蛋白激酶(AKT1)则与蛋白结合、磷脂酰肌醇-3,4,5-三磷酸结合、ATP结合、一氧化氮合酶调节剂活性、血管内皮细胞迁移的正调节、G蛋白偶联受体信号通路、凋亡过程的负调节、对流体剪切应力的响应、蛋白激酶B信号转导、炎症反应的正调节、TRK受体信号通路、Fc-epsilon受体信号通路、血管收缩、血小板活化、自噬的负调节、JNK级联的负调控、钠离子转运正调节、mRNA稳定性调控等生命活动过程相关。部分已知疾病靶标如:潜在药物靶标3个:钠/钾转运ATP酶亚基α-1(ATP1A1)功能主要与ATP结合、磷酸酶活性、ADP结合、钠钾离子结合相关;过氧化物酶体肉毒碱O-辛酰基转移酶(CROT)功能主要涉及脂肪酸β-氧化、细胞脂质代谢过程、辅酶A代谢过程、肉毒碱代谢等;肉碱O-棕榈酰转移酶1(CPT1A)主要与细胞脂质代谢、蛋白质同源寡聚化、脂肪酸β-氧化、上皮细胞分化、葡萄糖代谢过程、甘油三酯代谢过程等功能相关。共同靶标2个:葡萄糖激酶(GCK),功能主要涉及ATP结合及葡萄糖的结合;丝氨酸/苏氨酸蛋白激酶D1(YWHAE),功能主要与离子通道结合、蛋白质活性、MHCⅡ类蛋白质复合物结合、RNA结合、ATP结合、蛋白激酶C活性等相关。
急性呼吸窘迫综合征的发病机制较为复杂,其肺损伤过程涉及多个病理环节的不同分子作用过程。上述靶标涉及诸多生理病理分子机制,主要与ATP结合、细胞能量代谢、离子通道结合、信号因子的正负调节、炎症反应的调节、血管内皮生长因子调节、蛋白质相互作用及代谢、细胞生长和死亡等相关,这不仅说明了ARDS的发病机制复杂,同时说明黄芪-金银花药对干预ARDS的作用主要是通过对细胞物质及能量代谢、炎症反应、细胞生长及死亡的多靶点、网络状的综合调控而实现。
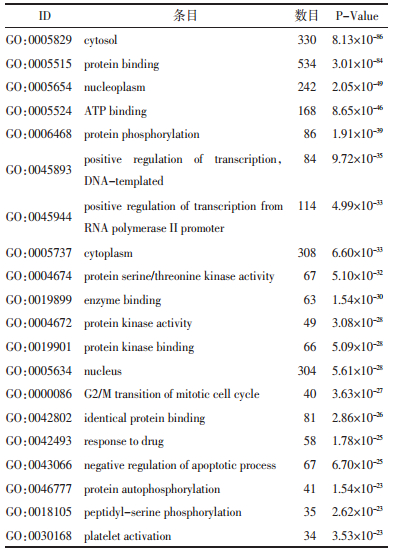
2.3 “黄芪-金银花”药对治疗ARDS关键靶标的GO基因功能分析“黄芪-金银花”药物靶标与疾病靶标基因功能主要涉及蛋白质结合、蛋白质磷酸化、凋亡过程的负调控、血小板活化蛋白激酶活性、转录的正向调节、DNA模板、有丝分裂细胞周期的G2/M转换、RNA聚合酶Ⅱ启动子转录调控的研究、药物反应、肽基丝氨酸磷酸化等,见表 3。
|
根据P排序仅显示排名前20的KEGG通路,见表 4。通路富集分析结果显示,“黄芪-金银花”药对治疗ARDS的主要作用通路有ErbB信号通路、细胞生长与死亡、FoxO信号转导通路、MAPK信号通路、甲状腺激素信号通路、磷脂酰肌醇3-激酶(PI3K)-蛋白激酶B(AKT)信号通路、内分泌系统、胰腺癌、感染性疾病、癌症、HTLV-I感染、细胞通讯、神经营养因子信号转导通路、Ras信号途径、慢性粒细胞白血病、细胞周期、非小细胞肺癌、Epstein Barr病毒感染等。

|
见图 2。通过TCMIP数据库分析可以看出,“黄芪-金银花”药对干预ARDS作用主要与33个化学成分相关联,其中黄芪成分19个,金银花成分14个。黄芪成分以黄芪皂苷和黄芪苷为主,如黄芪皂苷Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ等;金银花主要成分以金银花苷、金银花黄酮、忍冬次皂苷等为主。
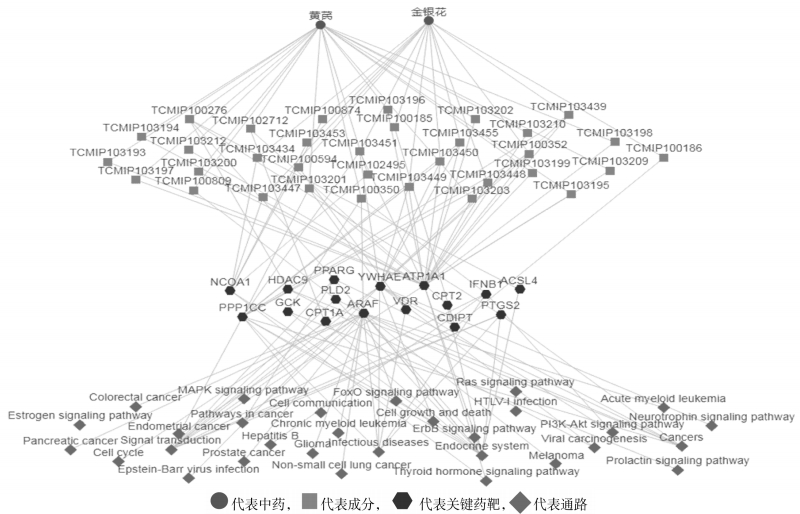
|
| 图 2 “黄芪-金银花”药对干预ARDS“中药-成分-靶标-通路”多维网络分析 Fig. 2 "Traditional Chinese medicine-compound-target-pathway" multidimensinal network analysis of Stragalus Radix and Lonicerae Japonicae Flos drug pair on ARDS |
其中,黄芪皂苷、金银花酚酸类成分均已通过实验证实具备减轻急性肺损伤(ALI)的药理作用。徐旭等[11]发现黄芪皂苷可延长电刺激大鼠颈总动脉血栓形成的时间、抑制血小板聚集,提高前列环素(PGI2)和一氧化氮(NO)水平,降低血栓素A2(TXA2)/前列环素比例,发挥抗血栓作用;刘永琦、李金田等[12]发现黄芪皂苷对肺纤维化大鼠肺泡Ⅱ型上皮细胞超微结构具有保护作用,调节Th1/Th2型细胞因子的平衡及TNF-α含量可能是其抗肺纤维化的机理之一;张吉等[13]发现黄芪甲苷可能通过抑制GRP78和CHOP蛋白表达调控内质网应激状态,从而改善急性肺损伤状态;赵建军等[14]发现黄芪甲苷能上调脂多糖(LPS)致ALI大鼠肺水通道蛋白5的表达,从而减轻LPS致ALI大鼠肺炎症损伤反应;宋亚玲等[15]对金银花的酚酸类化合物1~8进行了体外抗炎活性实验,发现化合物1~8对LPS刺激的巨噬细胞炎症因子均具有不同程度的抑制作用。
黄芪-金银花药对作用于ARDS的相关通路主要有ErbB信号通路、FoxO信号转导通路、Ras信号途径、MAPK信号通路、PI3K-AKT信号通路、神经营养因子信号转导通路、细胞生长与死亡、内分泌系统、HTLV-I感染、细胞通讯、非小细胞肺癌、甲状腺激素信号通路、感染性疾病、信号转导、慢性粒细胞白血病、胰腺癌、胶质瘤、黑色素瘤、细胞周期、结直肠癌、Epstein Barr病毒感染、雌激素信号转导通路等。
其中,ErbB受体酪氨酸激酶(RTK)家族[16]可调节多种生物反应,包括细胞增殖、分化、活动,RTK家族成员之一表皮生长因子受体(EGFR,也称为ErbB-1或HER1)[17]可诱导受体同源二聚体和异二聚体的形成以及内在激酶结构域的激活,导致细胞质尾部内特定酪氨酸残基(pY)的磷酸化,含有pY肽的信号效应子被募集到活化受体即可诱导各种信号传导途径。PI3K信号通路可被大多数ErbB直接或间接激活。
FoxO信号转导通路参与调节细胞凋亡、细胞周期控制、葡萄糖代谢、抗氧化应激等细胞生理过程中特定基因的表达。FoxO蛋白的中心调节机制与PI3K下游的Akt / PKB的磷酸化相关[18-19]。
丝裂原活化蛋白激酶(MAPK)信号通路[20]与细胞增殖、分化和迁移相关。MAPK信号传导通路具有复杂性和多样性,MAPK相关蛋白分子包括Jun氨基末端激酶(JK1/2/3)、p38蛋白、ERK5和细胞外信号相关激酶(ERK),可由特异性MAPKK激活;MAPK途径是所有ErbB受体下游的共同靶标,同时MAPK通路可通过G蛋白等分子与PI3K通路相联通[21]。
PI3K-Akt信号传导通路可被多种类型的细胞刺激或毒性损伤激活,主要与细胞转录、翻译、增殖、生长和存活等相关,PIP3可作为第二信使激活Akt,活化的Akt可以通过磷酸化参与细胞凋亡、蛋白质合成与代谢等细胞周期过程[22]。
通过对“黄芪-金银花”药对“中药-成分-靶标-通路”多维网络分析,发现该药对成分在干预ARDS中发挥了重要作用,预测结果中如减轻炎症反应、保护肺血管内皮细胞及抗细胞凋亡等分子机制与课题组前期实验结论具有较高重合性[4-6]。本研究为益气化瘀解毒方治疗ARDS进一步的机制研究提供了可能依据和新的思路,同时为中药复方中关键药对干预疾病的机制研究提供了研究模式参考。
3 结论网络药理学基于“疾病—基因—靶点—药物”相互作用网络,其注重整体性和动态性的特点,与中药复方注重多组分配伍、多靶点干预及系统调控的思想不谋而合[23]。本研究表明,“黄芪-金银花”药对可通过多靶点、多途径干预ARDS,为其进一步的药效物质基础分析和防治作用机制研究提供了依据。
本研究是基于网络药理学原理的综合数据分析,具体分子通路机制及物质基础将通过进一步的动物实验加以验证,望本研究能够为复方核心药对的研究及ARDS的临床治疗提供参考。
| [1] |
Ranieri VM, Rubenfeld GD, Thompson BT, et al. Acute respiratory distress syndrome:the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. |
| [2] |
万茂婷, 李雁, 梁旭, 等. 中西医结合治疗急性呼吸窘迫综合征临床疗效的Meta分析[J]. 环球中医药, 2018(2): 315-320. DOI:10.3969/j.issn.1674-1749.2018.02.049 |
| [3] |
方邦江, 孙丽华, 卜建宏, 等. 论"急性虚证"理论及其在急救临床的应用(上)[J]. 中国中医急症, 2017, 7(10): 1724-1726. DOI:10.3969/j.issn.1004-745X.2017.10.010 |
| [4] |
李雁, 王双, 李昕, 等. 益气化瘀解毒复方联合超低频电磁场处理水对内毒素诱发大鼠急性肺损伤的影响[J]. 中医杂志, 2016, 20(9): 783-788. |
| [5] |
黄瑞音, 李雁, 李昕, 等. 益气化瘀解毒方治疗内毒素致ARDS大鼠的炎症作用研究[J]. 环球中医药, 2017, 7(2): 141-145. DOI:10.3969/j.issn.1674-1749.2017.02.003 |
| [6] |
李昕, 李雁, 刘丽杰, 等. 益气化瘀解毒方对急性呼吸窘迫综合征大鼠NF-κB/p38MAPK通路的影响[J]. 环球中医药, 2017, 7(3): 275-279. DOI:10.3969/j.issn.1674-1749.2017.03.005 |
| [7] |
许海玉, 刘振明, 付岩, 等. 中药整合药理学计算平台的开发与应用[J]. 中国中药杂志, 2017, 62(18): 3633-3638. |
| [8] |
许海玉, 杨洪军. 整合药理学:中药现代研究新模式[J]. 中国中药杂志, 2014, 58(3): 357-362. |
| [9] |
Zhang Y, Guo Q, Li Q, et al. Main active constituent identification in Guanxinjing capsule, a traditional Chinese medicine, for the treatment of coronary heart disease complicated with depression[J]. Acta Pharmacologica Sinica, 2018, 39(6): 975-987. DOI:10.1038/aps.2017.117 |
| [10] |
Yu G, Zhang Y, Ren W, et al. Network pharmacology-based identification of key pharmacological pathways of Yin & Huang & Qing & Fei capsule acting on chronic bronchitis[J]. International Journal of COPD, 2017(12): 85-94. |
| [11] |
徐旭, 汤立达. 黄芪的心血管药理作用研究进展[J]. 中国新药杂志, 2003, 11(11): 899-901. DOI:10.3321/j.issn:1003-3734.2003.11.006 |
| [12] |
刘永琦, 李金田, 李娟, 等. 黄芪对肺纤维化大鼠血清细胞因子及肺超微结构的影响[J]. 中国免疫学杂志, 2008, 23(11): 980-983. |
| [13] |
张吉, 臧东钰. 黄芪甲苷对急性肺损伤大鼠内质网应激介导影响[J]. 中国民族民间医药, 2014, 19(15): 19-20. |
| [14] |
赵建军, 张建勇, 陈玲. 黄芪甲苷对急性肺损伤大鼠肺水通道蛋白5表达的影响[J]. 中国医院药学杂志, 2013, 32(5): 385-389. |
| [15] |
宋亚玲, 王红梅, 倪付勇, 等. 金银花中酚酸类成分及其抗炎活性研究[J]. 中草药, 2015, 45(4): 490-495. |
| [16] |
Lemmon MA, Schlessinger J. Cell signaling by receptor tyrosine kinases[J]. Cell, 2010, 141(7): 1117-1134. DOI:10.1016/j.cell.2010.06.011 |
| [17] |
Oda K, Matsuoka Y, Funahashi A, et al. A comprehensive pathway map of epidermal growth factor receptor signaling[J]. Mol Syst Biol, 2005(1): 2005-2010. |
| [18] |
Zhang X, Tang N, Hadden TJ, et al. Akt, FoxO and regulation of apoptosis[J]. Biochim Biophys Acta, 2011, 1813(11): 1978-1986. DOI:10.1016/j.bbamcr.2011.03.010 |
| [19] |
Hagenbuchner J, Ausserlechner M J. Mitochondria and FOXO3:breath or die[J]. Frontiers in Physiology, 2013(4): 147. |
| [20] |
Takami M, Terry V, Petruzzelli L. Signaling pathways involved in IL-8-dependent activation of adhesion through Mac-1[J]. J Immunol, 2002, 168(9): 4559-4566. DOI:10.4049/jimmunol.168.9.4559 |
| [21] |
Duronio V. The life of a cell:apoptosis regulation by the PI3K/PKB pathway[J]. Biochem J, 2008, 415(3): 333-344. DOI:10.1042/BJ20081056 |
| [22] |
Turner MD, Nedjai B, Hurst T, et al. Cytokines and chemokines:At the crossroads of cell signalling and inflammatory disease[J]. Biochim Biophys Acta, 2014, 1843(11): 2563-2582. DOI:10.1016/j.bbamcr.2014.05.014 |
| [23] |
张彦琼, 李梢. 网络药理学与中医药现代研究的若干进展[J]. 中国药理学与毒理学杂志, 2015, 29(6): 883-892. DOI:10.3867/j.issn.1000-3002.2015.06.002 |
2. Department of Education, Dongzhimen Hospital of Beijing University of Chinese Medicine, Beijing 100700, China
 2019, Vol. 36
2019, Vol. 36




