文章信息
- 王香青, 马振军, 包洪云, 王茹, 陈雪莲, 刘志勇, 孔方方
- WANG Xiangqing, MA Zhenjun, BAO Hongyun, WANG Ru, CHEN Xuelian, LIU Zhiyong, KONG Fangfang
- 槲皮素通过抑制β-catenin入核抑制人宫颈癌细胞增殖、迁移的实验研究
- Experimental research of quercetin inhibits proliferation and migration of human cervical cancer cells via inhibiting β-catenin
- 天津中医药, 2019, 36(2): 195-199
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(2): 195-199
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.02.25
-
文章历史
- 收稿日期: 2018-09-28
2. 天津医科大学肿瘤医院病理科, 天津 300060
在发展中国家的妇女中,宫颈癌仅次于乳腺癌,是第二常见的恶性肿瘤类型,其癌症病死率仅次于乳腺癌和卵巢癌。在2012年,全球约有527 600个新增宫颈癌病例,265 700个宫颈癌死亡病例[1]。槲皮素是一种广泛分布于植物中的抗氧化类黄酮。槲皮素在B环3位上的酚类羟基组具有清除自由基的作用。在小鼠实验中发现,槲皮素能够抑制化学诱导剂诱发的结肠癌发生[2]。本实验通过体外细胞学研究探讨了槲皮素对宫颈癌HeLa细胞增殖及迁移能力的影响及其对Wnt/β-catenin信号通路的作用,为槲皮素应用于宫颈癌的防治提供实验依据。
1 材料与方法 1.1 材料与试剂HeLa细胞株(中国医学科学院肿瘤细胞库);槲皮素(美国Sigma公司);DMEM (D-valine minimal essential medium)培养基、胎牛血清购自美国Gibco公司;CCK-8试剂盒购自日本DOJINDO公司;Transwell细胞迁移小室购自美国BD公司;小鼠抗人β-catenin单克隆抗体购自Santa cruz公司;羊抗小鼠IgG Alexa Flour488购自Invitrogen公司;TopFlash荧光素酶报告系统购自美国Addgene公司;荧光素酶胸苷激酶、Lipofectamine 2000购自美国Invitrogen公司;双荧光素酶检测试剂盒购自Promega公司。
1.2 细胞培养及槲皮素处理将HeLa细胞株放人含10%胎牛血清、DMEM培养液中,置于37 ℃、5%CO2的培养箱中培养。槲皮素处理组中细胞加入不同浓度的(10、40、100 μmol/L)的以二甲基亚砜(DMSO)为溶剂的槲皮素,对照组加入等量DMSO,培养24 h后进行后续实验。
1.3 CCK-8细胞增殖实验细胞增殖能力用细胞增殖-毒性检测试剂盒检测。将各组细胞胰酶消化后接种至96孔板中,接种密度为100个/孔,每种细胞每板种18个复孔,加入不同浓度槲皮素培养24 h后,每孔加5 mg/mL的CCK8溶液10 μL,37 ℃孵育3 h后,酶标仪检测595 nm处的光密度(OD)值,实验重复3次。
抑制率(%)=[1-(用药组OD值/空白对照组OD值)]×100%
1.4 细胞划痕实验细胞经0.05%胰酶消化液消化后,收集离心,用无血清DMEM培养基重悬,调整细胞浓度至5×105个/每孔接种于6孔板中。待细胞贴壁后,用10 μL枪头用力均匀地在培养皿中划痕,磷酸盐缓冲溶液(PBS)轻轻洗涤2次;为了排除细胞增殖对实验的干扰,划痕后改用无血清的培养液培养观察18 h,测量记录细胞运动的距离,并于倒置显微镜(100×)下拍照。
1.5 Transwell细胞迁移实验在8 μm微孔的Transwell小室下室中加入300 μL DMEM+20%FBS培养液,在上室孔中加入200 μL浓度为5×105/mL的细胞悬液,每种细胞做3个复孔,置于5%CO2培养箱于37 ℃培养8 h后,弃去上室液体,用湿棉签擦去膜上未穿过膜的细胞后固定、苏木精染色,观察计数显微镜(400×)下穿过膜的细胞数,每张膜中央部分和周围部分各随机取5个视野。
1.6 免疫荧光将各组细胞以5×104/mL提前铺于含有盖玻片的12孔板中,4%多聚甲醛4 ℃固定10 min,PBS冲洗,0.5% Triton室温处理10 min;PBS冲洗,3%BSA封闭室温1 h;PBS冲洗,加入小鼠抗人β-catenin单克隆抗体(1:50)4 ℃孵育过夜,PBS洗3次,加入羊抗小鼠IgG Alexa Flour488(1:200)避光室温1 h;PBS洗3次,加入4,6-二乙酰基-2-苯基吲哚酸盐,避光室温10 min进行细胞核染色;PBS洗2次,将盖玻片移至载玻片上,用抗荧光衰减封片剂封片,荧光显微镜观察、拍照。
1.7 TOP Flash荧光素酶报告系统转染前24 h,将对数生长期的细胞以2×104/孔的浓度接种于48孔板内进行培养。利用Lipofectamine 2 000转染试剂将TopFlash(100 ng)及海肾荧光素酶胸苷激酶(50 ng)共转染于细胞中。转染48 h后加入槲皮素处理24 h后,收集细胞利用Promega双荧光素酶检测试剂盒检测荧光素酶活性。通过与海肾荧光素酶活性相对比对结果进行标准化。
1.8 统计学处理结果应用SPSS 20.0统计学软件处理系统。数据采用均数±标准差(x±s)表示,组间的差异比较采用单因素方差分析,组间两两比较采用LSD-t检验。采用双尾检测法,以P<0.05为具有统计学意义。
2 结果 2.1 槲皮素抑制SRA 01/04细胞增殖组间OD值有统计学差异,表明槲皮素具有抑制宫颈癌HeLa细胞增殖的作用,见表 1。组间两两比较发现40 μmol/L及100 μmol/L槲皮素浓度处理组与空白对照之间组OD值也具有明显差异(40 μmol/L,P < 0.05;100 μmol/L,P < 0.05),且呈现浓度依赖性作用。
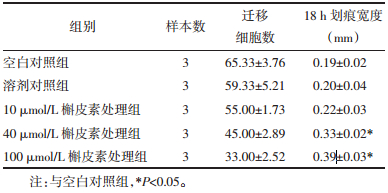
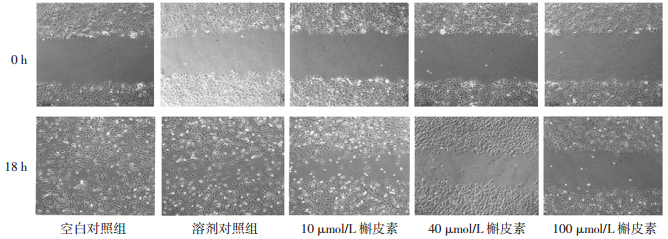
Transwell细胞迁移实验和细胞划痕实验被用来分别检测槲皮素对于HeLa细胞垂直及水平运动迁移能力的影响。Transwell细胞迁移实验结果显示:各组间细胞的迁移细胞相对数比较,差异具有统计学意义(P < 0.05),组间两两比较发现除了10 μmol/L组外,40 μmol/L、100 μmol/L槲皮素处理组细胞迁移数均显著低于对照组细胞(40 μmol/L,P < 0.05;100 μmol/L,P < 0.05),见图 1、表 2。表明槲皮素处理能够抑制HeLa细胞的垂直运动能力。细胞划痕实验表明各组间划痕后18 h槲皮素处理组的HeLa细胞无细胞区域宽度比较,差异具有统计学意义(P < 0.01),组间两两比较发现除了10 μmol/L组外,40 μmol/L、100 μmol/L槲皮素处理组细胞迁移数均显著低于对照组细胞(40 μmol/L,P < 0.05;100 μmol/L,P < 0.01),见图 2、表 2。表明槲皮素处理能够抑制HeLa细胞的水平运动能力。

|
| 图 1 对照组及各槲皮素处理组中的迁移细胞图 Fig. 1 Images of the migrated cells in control and quercetin-treated groups |
|
|
| 图 2 0 h 和 18 h 对照组及各槲皮素处理组细胞向划痕迁移图 Fig. 2 Images of the cellmigration toward wound gap in control and quercetin-treated groups at 0 h and 18 h |
β-catenin是Wnt/β-catenin信号通路中的关键蛋白。在通路失活状态下,β-catenin主要位于细胞膜的细胞连接处起着细胞骨架的作用,当Wnt配体与Frizzled受体结合引起Dsh磷酸化,导致由Axin、APC、GSK-3β组成的破坏复合物解体,GSK-3β无法降解β-catenin而使其聚集并进入细胞核激活TCF/LEF转录因子,引起通路活化,参与多种恶性肿瘤的发生和演进。β-catenin的亚细胞定位能够反应Wnt/β-catenin信号通路的活化状态。细胞免疫荧光结果发现β-catenin蛋白在对照组细胞中主要分布于细胞胞浆和细胞核内,而在40 μmol/L和100 μmol/L槲皮素处理组HeLa细胞中不但β-catenin大部分分布于胞浆中,细胞核内β-catenin蛋白明显减少,提示槲皮素能够抑制Wnt/β-catenin信号通路。见图 3。

|
| 图 3 对照组及槲皮素处理组中β-catenin的表达 Fig. 3 Expression ofβ-catenin in control and quercetin-treated groups |
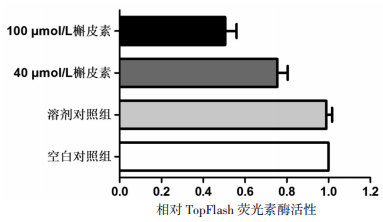
TOPFlash荧光报告系统,除了含有TCF/LEF结合位点,还包含有一段荧光素酶报告基因,可以将Wnt/β-catenin信号通路的微观变化通过荧光信号强度反映出来。结果发现与对照组相比,40 μmol/L和100 μmol/L槲皮素处理组细胞报告基因被显著抑制(P < 0.05),进一步验证了槲皮素具有抑制Wnt/β-catenin信号通路的作用。见图 4。
|
| 图 4 对照组及槲皮素处理组中相对TopFlash荧光素酶活性 |
槲皮素是具有多种生物学活性的天然黄酮类化合物。在许多中草药如三七、款冬花、槐米、合欢花、银杏等均含有槲皮素。近些年来对于槲皮素类药物的研究发现其具有抗氧化清除自由基、抗炎、舒张血管、增强免疫、抗抑郁、降血糖血脂等多种药理作用[3]。国内外的多项动物及体外细胞学研究表明槲皮素对于包括乳腺癌、前列腺癌、淋巴瘤、胃癌、结肠癌、肝癌、肺癌、胚胎癌等多种恶性肿瘤的发生、发展也具有抑制作用[4-6]。
Wnt信号通路参与促进多种肿瘤细胞的增殖和转移,且Wnt信号通路的异常活化常提示患者预后不良[7],而抑制该通路能够减弱肿瘤细胞干细胞样特性并阻断肿瘤细胞异常增殖[8]。目前关于槲皮素对Wnt/β-catenin信号通路的作用仅在胚胎癌、结肠癌和乳腺癌细胞中可见有限的研究[9-11],但其对于宫颈癌细胞中Wnt/β-catenin信号通路的作用还未见相关的文献报道。
国内外已有的研究表明槲皮素可抑制宫颈癌细胞的增殖和转移,其作用的机制可能有:槲皮素抑制抗凋亡蛋白激酶B(AKT)和Bcl-2的表达,使线粒体内细胞色素c水平升高,线粒体膜电位去极化并伴随着活性氧族的升高[12],槲皮素抑制JAK/STAT信号通路,抑制细胞增殖,诱发细胞凋亡[13];槲皮素可促进nm23的表达抑制乙酰肝素酶,抑制肿瘤转移[14-15]。本研究发现槲皮素能够抑制宫颈癌HeLa细胞的增殖、迁移能力,这与文献报道中的结果一致。
已有不少研究表明Wnt信号通路中的重要蛋白在宫颈癌组织中表达增加,而通路的抑制因子表达缺失或下调[16]。人宫颈鳞状上皮细胞中的HPV病毒的感染和转化也与Wnt信号通路的活化状态密切相关[17]。这些均表明Wnt/β-catenin信号通路在宫颈癌发生、发展过程中具有重要作用。本研究进一步发现槲皮素处理能够抑制HeLa细胞中β-catenin向细胞核内聚集且进一步抑制TCF/LEF的转录活化,进而抑制Wnt/β-catenin信号通路,提示槲皮素可能通过抑制Wnt/β-catenin信号通路发挥抑制宫颈癌细胞增殖及迁移的作用。
尽管槲皮素来源广泛,药用价值高,目前对于其在肿瘤防治方面的研究越来越多,但大部分的研究仍处于临床前期阶段,关于槲皮素抗癌的作用机制仍有待进一步深入,为槲皮素的临床应用提供更多的理论和实验依据。
| [1] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [2] |
Andreucci M, Faga T, Pisani A, et al. Quercetin protects against radiocontrast medium toxicity in human renal proximal tubular cells[J]. J Cell Physiol, 2018, 233(5): 4116-4125. DOI:10.1002/jcp.v233.5 |
| [3] |
Sharma A, Kashyap D, Sak K, et al. Therapeutic charm of quercetin and its derivatives:a review of research and patents[J]. Pharm Pat Anal, 2018, 7(1): 15-32. DOI:10.4155/ppa-2017-0030 |
| [4] |
Wilsher NE, Arroo RR, Matsoukas MT, et al. Cytochrome P450 CYP1 metabolism of hydroxylated flavones and flavonols:Selective bioactivation of luteolin in breast cancer cells[J]. Food Chem Toxicol, 2017, 110: 383-394. DOI:10.1016/j.fct.2017.10.051 |
| [5] |
Wang P, Henning SM, Magyar CE, et al. Green tea and quercetin sensitize PC-3 xenograft prostate tumors to docetaxel chemoth-erapy[J]. J Exp Clin Cancer Res, 2016, 35(1): 1-11. DOI:10.1186/s13046-015-0276-9 |
| [6] |
Lee WJ, Chen YR and Tseng TH. Quercetin induces FasL-related apoptosis, in part, through promotion of histone H3 acetylation in human leukemia HL-60 cells[J]. Oncol Rep, 2011, 25(2): 583-591. |
| [7] |
Li H, Jiao S, Li X, et al. Therapeutic effects of antibiotic drug tigecycline against cervical squamous cell carcinoma by inhibiting Wnt/beta-catenin signaling[J]. Biochem Biophys Res Commun, 2015, 467(1): 14-20. DOI:10.1016/j.bbrc.2015.09.140 |
| [8] |
Qi L, Sun B, Liu Z, et al. Dickkopf-1 inhibits epithelial-mesenchymal transition of colon cancer cells and contributes to colon cancer suppression[J]. Cancer Sci, 2012, 103(4): 828-835. DOI:10.1111/cas.2012.103.issue-4 |
| [9] |
Granato M, Rizzello C, Gilardini Montani MS, et al. Quercetin induces apoptosis and autophagy in primary effusion lymphoma cells by inhibiting PI3K/AKT/mTOR and STAT3 signaling pathways[J]. J Nutr Biochem, 2017(41): 124-136. |
| [10] |
Kim H, Seo EM, Sharma AR, et al. Regulation of Wnt signaling activity for growth suppression induced by quercetin in 4T1 murine mammary cancer cells[J]. Int J Oncol, 2013, 43(4): 1319-1325. DOI:10.3892/ijo.2013.2036 |
| [11] |
Ahmed HH, Aglan HA, Zaazaa AM, et al. Quercetin confers tumoricidal activity through multipathway mechanisms in a N-methylnitrosourea rat model of colon cancer[J]. Asian Pac J Cancer Prev, 2016, 17(11): 4991-4998. |
| [12] |
Bishayee K, Ghosh S, Mukherjee A, et al. Quercetin induces cytochrome-c release and ROS accumulation to promote apoptosis and arrest the cell cycle in G2/M, in cervical carcinoma:signal cascade and drug-DNA interaction[J]. Cell Prolif, 2013, 46(2): 153-163. DOI:10.1111/cpr.2013.46.issue-2 |
| [13] |
陈娇, 张蔚, 敖良飞, 等. 槲皮素对宫颈癌HeLa细胞STAT3的表达及其信号通路的影响[J]. 中华临床医师杂志(电子版), 2011, 5(19): 5656-5661. DOI:10.3877/cma.j.issn.1674-0785.2011.19.023 |
| [14] |
程静, 张蔚, 吕琼莹, 等. 槲皮素和乙酰肝素酶与宫颈癌细胞侵袭与迁移机制的研究[J]. 实妇产科杂志, 2014, 30(3): 212-214. |
| [15] |
陈眣冰, 崔元璐. 载槲皮素-粉防己碱纳米凝胶的制备、表征与体外评价[J]. 天津中医, 2017, 34(11): 770-774. DOI:10.11656/j.issn.1672-1519.2017.11.15 |
| [16] |
Bahrami A, Hasanzadeh M, ShahidSales S, et al. Clinical significance and prognosis value of Wnt signaling pathway in cervical cancer[J]. J Cell Biochem, 2017, 118: 328-3033. |
| [17] |
Wei H, Wang N, Zhang Y, et al. Wnt-11 overexpression promoting the invasion of cervical cancer cells[J]. Tumour Biol, 2016, 37(9): 11789-11798. DOI:10.1007/s13277-016-4953-x |
2. Department of Pathology, Tianjin Medical University Cancer Institute and Hospital, Tianjin 300060, China
 2019, Vol. 36
2019, Vol. 36