文章信息
- 刘玥玥, 刘博
- LIU Yueyue, LIU Bo
- 迷迭香酸通过Traf6/TAK1信号通路调控胃癌细胞的增殖及凋亡
- Regulation of rosmarinic acid on proliferation and apoptosis of human gastric cancer cell via Traf6/TAK1 signaling pathway
- 天津中医药, 2019, 36(2): 200-204
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(2): 200-204
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.02.26
-
文章历史
- 收稿日期: 2018-12-25
2. 恩施土家族苗族自治州中心医院乳腺外科, 恩施 445000
胃癌在当今社会人群中的发生率越来越高,并且其死亡率在所有恶性肿瘤中位于第2位[1-2],严重威胁着人类的生命健康。随着医疗技术水平的提升,针对胃癌治疗的措施也越来越多,然而市场上治疗胃癌的药物效果有限、且还会带来不同程度的毒副作用,于是新药的开发及其作用机制的深入探讨仍然是目前研究的热点[3]。
Traf6/TAK1信号通路的活化在肿瘤的发生发展过程中起着重要的作用[4],通路中关键衔接蛋白肿瘤坏死因子相关受体因子6(Traf6)可以传导胞外信号,在肿瘤细胞增殖、迁移过程中扮演重要角色[5]。因为中药来源广、价格低、副作用低等特点一直应用在抗肿瘤活性研究中,迷迭香酸为丹参、紫苏等中草药的活性组分,为天然多酚羟基化合物,在抗炎、抗氧化及抗肿瘤方面表现出较好的药理活性[6-8]。本研究采用HGC27细胞为研究对象,考察了迷迭香酸对HGC27细胞增殖、凋亡的作用效应及对Traf6/TAK1信号通路活化的影响。
1 材料及方法 1.1 材料 1.1.1 人胃癌细胞(HGC27)购自中国科学院生物研究所。
1.1.2 药物与试剂迷迭香酸(上海原叶生物公司,批号:20283-92-5);RPMI 1640培养基(杭州四季青生物材料研究所)、胰蛋白酶(美国Sigma公司);CCK-8试剂盒购自北京智杰方远科技有限公司;胎牛血清购自杭州四季青公司;AnnexinV/PI试剂盒购于BENDER公司;BCA蛋白浓度测定试剂盒(上海谷歌生物有限公司,批号P0012S-07);一抗稀释液(上海吉诺公司,批号:C154855);ECL显色液(Sigma公司);β-actin、Bax、Bcl-2、Traf6、TAK1以及p-TAK1兔抗人一抗均购自英国Abcam公司;二抗羊抗兔IgG购自武汉谷歌生物科技有限公司。
1.1.3 主要仪器单人超净工作台(北京六一仪器厂);CB15C02型细胞培养箱(北京六一仪器厂);Victor3 1420 Multilable Counter酶标仪(美国BD,FACS AriaIII);HD-3000凝胶成像仪(上海上天精密仪器有限公司);CytoFLEX流式细胞仪(贝克曼公司)。
1.2 HGC27细胞培养HGC27细胞培养基用RPMI 1640培养液(含10%FBS,100 U/mL青霉素,100 μg/mL链霉素),将细胞放置于37 ℃,饱和湿度,5%CO2恒温培养箱中培养,根据生长状况进行传代培养。
1.3 分组与干预方法将细胞接种于96孔板,分为正常对照组、25、50、100 μmol/L迷迭香酸干预组24~72 h,然后进行CCK8实验。将细胞接种于6孔板,分为正常对照组、25、50、100 μmol/L迷迭香酸干预组,药物作用细胞24 h后进行流式细胞实验和免疫印迹实验。
1.4 检测指标与方法 1.4.1 CCK8取对数生长期的HGC27细胞,消化、重悬、计数后,以1×104/mL的浓度接种于96孔板,每孔终体积200 μL,待细胞贴壁生长至70%左右时,以迷迭香酸终浓度为25、50、100 μmol/L的培养液处理细胞,并设置调零孔。每组设置5个复孔,分别培养24、48、72 h后,弃去旧培养基,每孔加入10 μL CCK8试剂,继续孵育1 h后,采用酶标仪测定450 nm处的吸光度值。
1.4.2 流式细胞取对数生长期的HGC27细胞,消化、重悬、计数后,以1×105/mL的浓度接种于6孔板,按实验要求加入迷迭香酸终浓度为25、50、100 μmol/L,作用24 h后收集细胞,先用预冷的磷酸盐缓冲液(PBS)清洗细胞2遍,然后分别加入Annexin-V FITC和PI处理细胞(按照试剂盒操作说明书进行),最后用流式细胞仪检测细胞凋亡情况。
1.4.3 Western Blot药物干预24 h后,离心收集细胞,加入RIPA细胞裂解液,冰上裂解30 min后,离心收集上清提取细胞蛋白。BCA法测定细胞总蛋白浓度。各孔取30 μg的蛋白上样,于12%聚丙烯酰胺凝胶电泳进行蛋白分离(浓缩胶70 V电压,30 min;分离胶120 A电压,120 min)。将分离后的蛋白电转移(275 mA电流90 min)至聚偏氟乙烯(PVDF)膜。加入5%脱脂奶粉封闭液于摇床上室温封闭1 h。用TBST洗膜3次,每次10 min,分别加入对应一抗抗体(体积稀释比例均为1:1 000),4 ℃反应过夜。次日先以TBST洗膜,3次,每次10 min。后加入HRP标记的二抗IgG(体积稀释比例为1:3 000),室温反应1 h。再用TBST洗膜3次,每次10 min。按ECL试剂盒说明进行显影。采用双色红外激光成像系统分析管理系统对蛋白条带灰度值进行分析。
1.5 统计分析采用SPSS 20.0软件进行统计分析,实验数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两组间比较采用LSD-t检验,P < 0.05为差异有统计学意义。
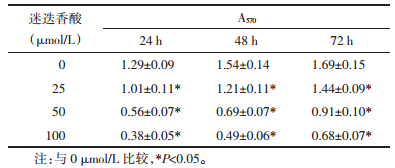
2 结果 2.1 迷迭香酸对HGC27细胞增殖的抑制作用迷迭香酸干预对HGC27细胞增殖有明显的抑制作用,组间比较差异有统计学意义(P < 0.05)。随着迷迭香酸干预时间的延长及浓度的升高,对HGC27细胞增殖抑制能力明显增强,表现出时间-剂量依赖性。结果见表 1。
|
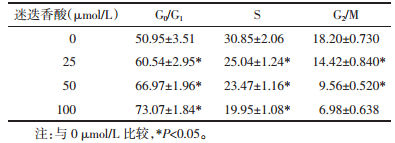
低、中、高剂量迷迭香酸干预HGC27细胞后,与对照组相比,G0/G1期细胞明显升高,S期、G2/M期细胞明显减少,差异有显著性(P < 0.05)。说明迷迭香酸干预可将HGC27细胞停留在G0/G1期,抑制了细胞的增殖分裂。结果见表 2。
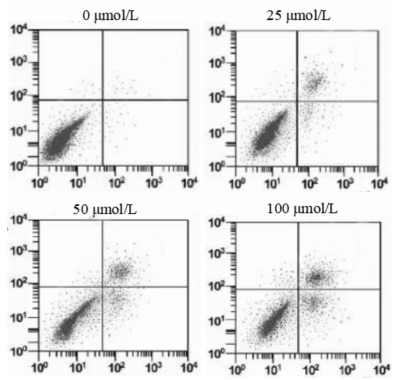
25、50、100 μmol/L迷迭香酸干预HGC27细胞后凋亡率分别为(11.94±1.16)%、(19.05±1.21)%及(26.08±1.74)%。与对照组(6.47%±1.08%)相比迷迭香酸组细胞凋亡率明显升高(P < 0.05);迷迭香酸诱导HGC27细胞凋亡表现出良好的剂量关系。结果见图 1。
|
| 图 1 迷迭香酸对HGC27细胞凋亡的影响 Fig. 1 Impacts of rosmarinic acid on apoptosis of HGC27 cells |
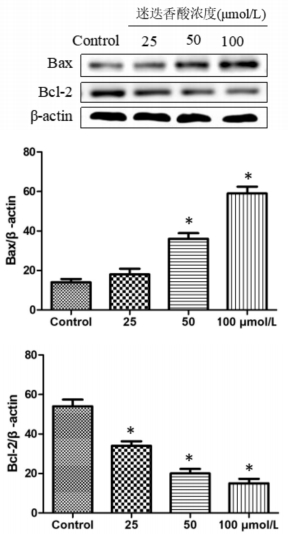
迷迭香酸可以明显诱导HGC27细胞中促凋亡蛋白Bax的表达,抑制抗凋亡蛋白Bcl-2表达,与对照组相比差异有统计学意义(P < 0.05),并且表现出浓度依赖性。结果见图 2。
|
| 图 2 迷迭香酸对HGC27细胞凋亡蛋白的影响 Fig. 2 Impacts of rosmarinic acid on apoptosis related proteins in HGC27 cells |
迷迭香酸对HGC27细胞中Traf6/TAK1信号通路相关蛋白表达的影响如图 3所示,提示迷迭香酸能显著抑制Traf6、p-TAK1蛋白表达,抑制Traf6/TAK1信号通路活化,从而诱导HGC27细胞凋亡。
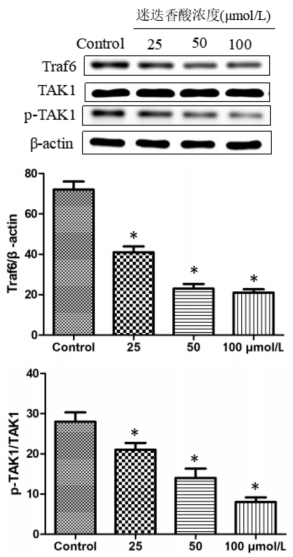
|
| 图 3 迷迭香酸对HGC27细胞Traf6/TAK1信号通路的影响 Fig. 3 Impacts of rosmarinic acid on Traf6/TAK1 pathway in HGC27 cells |
胃癌是全球第二大恶性肿瘤,病人死亡的主要因素是由远端转移、复发及癌细胞的不断增殖扩散导致,于是严格控制肿瘤细胞增殖、诱导其凋亡是治疗癌症发生与发展的关键环节[9]。中药活性成分在干预胃癌方面重于温阳益胃和健脾理气,引发的毒副作用低,对肿瘤组织周围的正常细胞伤害小,而且中药价格便宜、来源广泛、并且在降低或防止复发侵袭等方面表现出独特的优势[10-11]。迷迭香酸是来源于多种中草药的天然活性成分,特别是它抗肿瘤功效一直受到医疗界的重视。早期报道迷迭香酸可以抑制炎性因子及血管生成因子的释放,诱导肝癌细胞的凋亡,它可能的作用机制与降低NF-kB信号通路活化相关[12];还有关报道证实迷迭香酸可浓度依赖性的诱导白血病HL-60细胞凋亡,并且能够将细胞停留在G0/G1期[13]。现在有关迷迭香酸对胃癌细胞增殖凋亡的作用效应并不清楚,于是本文探讨了迷迭香酸对HGC27细胞增殖、凋亡的作用效应及对Traf6/TAK1信号通路的影响,实验数据提示迷迭香酸能够成时间-剂量依赖性的抑制HGC27细胞增殖。采用低、中、高浓度迷迭香酸处理24 h后流式细胞仪检测细胞凋亡情况及细胞周期,发现与对照组相比,该药物能够将细胞周期停留在G0 /G1期,并且细胞凋亡率明显增加。
细胞凋亡属于正常的生理现象,能够保持细胞内环境的稳态,在这过程中由多种基因参与。其中Bax及Bcl-2蛋白是重要的凋亡调节因子,前者为促凋亡蛋白,后者为抑凋亡蛋白,在癌细胞凋亡过程起着重要作用[14]。早期证实迷迭香酸能介导多种肿瘤细胞中Bax、Bcl-2基因的表达,进一步抑制细胞增殖[15]。本实验提示,不同剂量迷迭香酸干预HGC27细胞后,促凋亡蛋白Bax表达升高,抑凋亡蛋白Bcl-2表达降低。结果说明迷迭香酸了通过诱导Bax表达、抑制Bcl-2表达来增强HGC27细胞凋亡。
Traf6是细胞内的一种衔接蛋白,它可以介导细胞膜上多种受体信号通路的传导(TLR4为其中一种受体),进一步发挥生物学效应[16]。Traf6的活化可进一步激活TAK1介导的信号通路,诱导肿瘤细胞的不断增殖[17]。因此,对Traf6进行抑制,便可抑制肿瘤细胞增殖、抑制其凋亡。为了研究迷迭香酸对胃癌细胞中Trfa6/TAK1信号通路的作用,本文采用不同剂量药物干预HGC27细胞后检测发现Trfa6及TAK1磷酸化水平显著下降,结果提示迷迭香酸能通过抑制Trfa6/TAK1信号通路活化抑制胃癌细胞增殖,诱导其凋亡。本研究结果为迷迭香酸成为治疗胃癌的参考药物提供理论依据。
| [1] |
Karimi P, Islami F, Anandasabapathy S, et al. Gastric cancer:descriptive epidemiology, risk factors, screening, and prevention[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(5): 700-713. DOI:10.1158/1055-9965.EPI-13-1057 |
| [2] |
Ang TL, Fock KM. Clinical epidemiology of gastric cancer[J]. Singapore Med J, 2014, 55(12): 621-628. |
| [3] |
Wang K, Yuen ST, Xu J, et al. Whole-genome sequencing and comprehensive molecular profiling identify new driver mutations in gastric cancer[J]. Nat Genet, 2014, 46(6): 573-582. DOI:10.1038/ng.2983 |
| [4] |
Hui B, Zhang L, Zhou Q, et al. Pristimerin inhibits LPS-triggered neurotoxicity in BV-2 microglia cells through modulating IRAK1/TRAF6/TAK1-mediated NF-κB and AP-1 signaling pathways in vitro[J]. Neurotox Res, 2018, 33(2): 268-283. DOI:10.1007/s12640-017-9837-3 |
| [5] |
Ma L, Feng L, Ding X, et al. Effect of TLR4 on the growth of SiHa human cervical cancer cells via the MyD88-TRAF6-TAK1 and NF-κB-cyclin D1-STAT3 signaling pathways[J]. Oncol Lett, 2018, 15(3): 3965-3970. |
| [6] |
Kim GD, Park YS, Jin YH, et al. Production and applications of rosmarinic acid and structurally related compounds[J]. Appl Microbiol biotechnol, 2015, 99(5): 2083-2092. DOI:10.1007/s00253-015-6395-6 |
| [7] |
Xu Y, Han S, Lei K, et al. Anti-Warburg effect of rosmarinic acid via miR-155 in colorectal carcinoma cells[J]. Eur J Cancer Prev, 2016, 25(6): 481-489. DOI:10.1097/CEJ.0000000000000205 |
| [8] |
Hossan MS, Rahman S, Bashar A, et al. Rosmarinic acid:a review of its anticancer action[J]. World J Pharm Pharm Sci, 2014, 3(9): 57-70. |
| [9] |
Tao H, Chen YY, Sun ZW, et al. Silence of HDAC6 suppressed esophageal squamous cell carcinoma proliferation and migration by disrupting chaperone function of HSP90[J]. J Cell Biochem, 2018, 17(21): 31-42. |
| [10] |
Wong KY, Tan EY, et al. The use of traditional Chinese medicine among breast cancer patients:implications for the clinician[J]. Ann Acad Med Singapore, 2014, 43(2): 74-78. |
| [11] |
Li X, Yang G, Li X, et al. Traditional Chinese medicine in cancer care:a review of controlled clinical studies published in chinese[J]. PLoS One, 2013, 8(4): e60338. DOI:10.1371/journal.pone.0060338 |
| [12] |
Cao W, Hu C, Wu L, et al. Rosmarinic acid inhibits inflammation and angiogenesis of hepatocellular carcinoma by suppression of NF-kB signaling in H22 tumor-bearing mice[J]. J Pharmacol Sci, 2016, 132(2): 131-137. DOI:10.1016/j.jphs.2016.09.003 |
| [13] |
Saiko P, Steinmann MT, Schuster H, et al. Epigallocatechin gallate, ellagic acid, and rosmarinic acid perturb dNTP pools and inhibit de novo DNA synthesis and proliferation of human HL-60 promyelocytic leukemia cells:Synergism with arabinofuranosylcytosine[J]. Phytomedicine, 2015, 22(1): 213-222. DOI:10.1016/j.phymed.2014.11.017 |
| [14] |
Czabotar PE, Lessene G, Strasser A, et al. Control of apoptosis by the BCL-2 protein family:implications for physiology and therapy[J]. Nat Rev Mol Cell Biol, 2014, 15(1): 49-63. DOI:10.1038/nrm3722 |
| [15] |
Jiayu D, Wei J. GW27-e0561 rosmarinic acid inhibits high glucose-induced apoptosis in H9c2 cells by preventing the mitonchondrial injury and activating the phosphorylation of STAT3[J]. J Am Coll Cardiol, 2016, 68(16): 60-67. |
| [16] |
Lu Y, Jiang BC, Cao DL, et al. TRAF6 upregulation in spinal astrocytes maintains neuropathic pain by integrating TNF-κ and IL-1β signaling[J]. Pain, 2014, 155(12): 2618-29. DOI:10.1016/j.pain.2014.09.027 |
| [17] |
Wi SM, Moon G, Kim J, et al. TAK1-ECSIT-TRAF6 complex plays a key role in the TLR4 signal to activate NF-κB[J]. J Biol Chem, 2014, 289(51): 35205-35214. |
2. Breast Surgery, Central Hospital of Enshi Autonomous Prefecture, Enshi 445000, China
 2019, Vol. 36
2019, Vol. 36