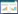文章信息
- 韩林, 高旸, 王旭慧, 张亚男, 王舒
- HAN Lin, GAO Yang, WANG Xuhui, ZHANG Yanan, WANG Shu
- “醒脑开窍”针刺法对脑缺血再灌注大鼠海马神经元KATP通道细胞电生理的调控研究
- Regulation of "Xingnao Kaiqiao" acupuncture therapy on cell-electrophysiology of KATP channel in hippocampal neurons of rats with cerebral ischemia reperfusion injury
- 天津中医药, 2019, 36(3): 269-274
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(3): 269-274
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.03.16
-
文章历史
- 收稿日期: 2019-01-25
2. 天津中医药大学第一附属医院针灸研究所, 天津 300193
脑缺血后一定时间内恢复血流,组织损伤和功能障碍反而加重,甚至导致不可逆转性损伤,被称为脑缺血再灌注损伤,脑缺血再灌注损伤是多种脑血管疾病的诱因,其发生机制目前尚未完全阐明[1]。针刺对抗脑缺血再灌注损伤疗效肯定。针刺基于传统经络学说,以多重作用、多靶点的方式发挥遍及全身的整体治疗效应。这些效应作为一种典型的生物信息传递包含各种细胞电生理及生物化学改变。研究发现,三磷酸腺苷敏感性钾通道(KATP)可能作为重要的作用靶点参与了脑缺血再灌注损伤的病理过程[2-3]。在脑组织低氧或缺血性损伤时,KATP通道开放可使神经元兴奋性降低,减少神经元的损伤和蜕变[4]。但针刺是否通过调节KATP通道对抗脑缺血再灌注损伤的作用机制目前尚不明确。本研究将采用膜片钳技术观测“醒脑开窍”针刺法对局灶性脑缺血再灌注损伤大鼠(MCAO/R)海马神经元KATP通道电生理特性的影响,从离子通道角度探讨针刺对抗脑缺血再灌注损伤的作用机制。
1 资料与方法 1.1 实验动物及分组雄性Wistar大鼠(SPF级)32只,体质量150~200 g,周龄4~6周。由北京维通利华实验动物技术有限公司提供,实验动物生产许可证编号:SCXK(京)2016-0011。实验动物按照随机数字表法分为空白组、假手术组、模型组、电针组,每组8只大鼠。实验动物于二级动物房喂养,室温(20~25 ℃),光照时间(07:00~19:00)自由摄食、饮水。所有实验过程均遵循中华人民共和国科技部《关于善待实验动物的指导性意见》。
1.2 主要试剂及溶液链霉蛋白酶XIV(批号:SLBJ2160V)、格列苯脲(批号:075K1376)、羟乙基磺酸钠(批号:MKBH0413V)均购自美国Sigma公司。主要溶液:1)高渗透蔗糖溶液(HSS)(mmol/L):Sucrose 234,KCl 2.5,Na2HPO4 1,CaCl2 0.1,HEPES 15,GLUCOSE 11,MgSO4 4(pH7.3 with NaOH)。2)羟乙基磺酸钠溶液(HSSB)(mmol/L):羟乙基磺酸钠132,KCl 2,CaCl2 0.1,MgCl2 4,HEPES 15,GLUCOSE 23(pH7.3 with NaOH)。3)Earle’s平衡的盐溶液(EBSS)(mmol/L):NaHCO3 26,CaCl2 1.8,MgSO4 0.8,KCl 5.35,NaCl 116,NaH2PO4 1,GLUCOSE 5.56,酚红0.003(pH7.3 with NaOH)。4)Hanks平衡盐溶液(HBSS)(mmol/L):KCl 5.37,KH2PO4 0.441,NaCl 137,Na2HPO4 0.34,HEPES 11,酚红0.003,MgCl2 4,GLUCOSE 5.56,CaCl2 1(pH7.3 with NaOH)。5)细胞浴液(mmol/L):KCl 140,HEPES 10,EGTA 2(pH7.3 with KOH)。6)微电极内液:KCl 140,CaCl2 1,MgCl2 0.5,HEPES 10(pH7.3 with KOH)。以上试剂均采用国产优质分析纯,以去离子水配制而成。
1.3 仪器设备膜片钳放大器(HEKA EPC-10德国),数据采集软件Patchmaster(HEKA,德国),数据分析软件Fitmaster(HEKA,德国),程控玻璃微电极拉制仪(P-97型,美国),振动切片机(World Precision Instruments MA752-04,美国),微电极操纵器(MP-285/R,美国),倒置显微镜(Nikon Ti-S,日本),韩氏神经穴位刺激仪HANS-200E购自南京济生医疗科技有限公司。
1.4 模型制作模型组、电针组每组各8只大鼠参照ZeaLonga线栓法并加以改进[5],制作大脑中动脉缺血再灌注模型。大鼠禁食12 h,腹腔注射10%水合氯醛麻醉(3 mL/kg)。颈部手术区域备皮、消毒,取颈部正中稍偏左切口1.5~2 cm,分离皮下筋膜,暴露左侧胸锁乳突肌和胸骨舌骨肌间的三角区,分离左侧颈总动脉和颈外动脉,结扎颈外动脉,于颈总动脉分叉处远心端和近心端分别用动脉夹夹闭,用1 mL注射器针头在近心端血管壁穿刺,将直径0.26 mm的尼龙线栓沿针孔缓慢插入(线栓尖端经细砂纸打磨圆顿、光滑),待线栓前段抵达分叉处,放开此处动脉夹,将线栓继续送入颈内动脉,直至微遇阻力为止,线栓进入颅内深度为18~20 mm,插线成功后结扎颈总动脉,放开另一个动脉夹,分层缝合。假手术组仅分离颈总动脉及颈外动脉,不插入尼龙线栓。按Zausinger六分法[6]对神经功能进行评分,评分为0~5分,评分越低,神经功能缺损越严重。排除评分为0、4、5分及死亡动物,选择评分为1、2、3分的大鼠进入下一阶段实验。
1.5 针刺选穴及干预方法电针组8只大鼠于造模成功后针刺内关、水沟、三阴交;空白组、假手术组、模型组大鼠同样抓取,但不给予针刺治疗。根据中国针灸学会实验针灸研究会制定的“动物针灸穴位图谱”,并参考大鼠的解剖结构和体表标志,水沟位于鼻尖下1 mm唇裂正中,内关位于前肢内侧,腕关节上约3 mm,尺、桡骨间隙中;三阴交位于后肢内踝尖直上1 cm。针具选用苏州医疗用品厂生产的“华佗牌”毫针,长40 mm,直径0.30 mm。电针仪选用韩氏神经穴位刺激仪HANS-200E(南京济生医疗科技有限公司,产品标准编号为YZB/苏0049-2008)。先直刺双侧内关穴1 mm至筋间,继在鼻中隔下部向上45°斜刺人中穴1 mm,其次直刺患侧三阴交穴3 mm,留针20 min;留针期间将患侧内关穴、三阴交穴针柄分别连接至韩氏神经穴位刺激仪,施以疏密波,频率2 Hz/15 Hz,电流1 mA。首次针刺在动物造模成功90 min后进行,每天针刺2次,每天10时、16时各针刺1次,共3 d。
1.6 海马神经元的急性分离治疗结束后次日,各组大鼠以水合氯醛腹腔麻醉(3 mL/kg)后快速断头取脑,在0~4 ℃通以100%O2的HSS中冰冻2 min后用震动切片机将脑组织切成400 μm厚度的薄片;用HSSB漂洗脑片3次,在33 ℃通有95%O2和5%CO2混合气体的Earle’s平衡盐溶液EBSS中孵育1.5 h;将脑片转移到HSSB中,于解剖显微镜视野下剥离海马组织CA1区,放入盛有链霉蛋白酶(Protease XIV 1.3 g/L)的Hanks平衡盐溶液的容器中,通入100%O2,在33 ℃酶溶液中酶解30 min;将组织在HSSB溶液中漂洗3次,用Pasteur吸管按口径由大到小的顺序吹打,使组织分散(吸管尖端口径分别为500、300、150 μm);静置后将中层液体滴入表面洁净的盖玻片上,待细胞贴壁后用正常浴液漂洗2次;加入2 mL细胞浴液,选取有明显突起、边界清楚、胞质均匀一致的锥体神经元进行记录[7]。
1.7 单通道膜片钳记录用P-97水平微电极拉制仪,采用两步拉制法将硬质厚壁玻璃电极毛坯拉制成封接电极。电极尖端直径0.5~1 μm。冲灌电极液以不超过电极长度的1/3为宜。充灌电极液后,电极入水电阻大约在5~8 MΩ之间。将记录浴槽置于倒置显微镜下,以(400×)的放大倍数观察细胞,选择胞膜清晰、胞体透亮、胞质均匀,贴附良好的锥体细胞作为实验对象。由膜片钳放大器在±60 mV范围内以20 mV为阶跃输出钳制电压,观察通道电流活动。采样时间为10 s,采样间隔为5 s。玻璃微电极内插氯化银电极与膜片钳放大器(HEKA EPC-10德国)相连,放大器探头反馈电阻为50 GΩ,低通滤波器滤波频率为3 kHz。单通道电流以Patchmaster数据采集系统(HEKA,德国)采集入计算机,测量结果用Fitmaster软件进行信号分析处理。采样频率为5 kHz,测量通道开关事件的时间分辨率为300 μs。
单通道事件的检测采用50%阈值法,电流幅度通过对电流幅度直方图进行Gaussian拟合获得;平均开放时间通过对对数平方根直方图采用Exponential log probabilitiy拟合获得;开放概率以NPo表示,NPo是指在某一指令电压条件下,钳制膜片上所有通道总的开放概率,NPo=t0/t其中N:膜片上通道的数目;Po:指令电压条件下,刺激时间内,正在开放的单个通道的开放概率;t0:每个sweep期间,单个通道的开放时间;t:指令电压下,刺激持续总的时间。主要检测指标:1)神经元形态观测。2)+60 mV钳制电压下KATP通道电流幅度,开放时间,开放概率。
1.8 统计学方法数据分析应用SPSS 21.0系统软件,正态分布计量资料统计描述采用均数±标准差(x±s)表示,治疗前后比较采用配对t检验,多组间比较采用单因素方差分析(One-Way ANOVA),组间两两比较采用最小显著差值法(LSD法),P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠神经功能评分比较与本组治疗前比较,电针组治疗后神经功能评分明显升高(P < 0.01);与空白组、假手术组比较,模型组治疗前、治疗后神经功能评分均明显降低(P < 0.01);与模型组比较,电针组治疗后神经功能评分明显升高(P < 0.01)。见表 1。
|
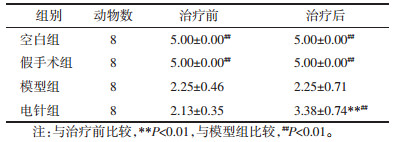
倒置显微镜下对各组海马组织急性分离所获得的神经元进行观测,并选择形态完整,活性良好的神经元进行膜片钳记录。健康的神经元:胞体具有统一的亮视野,形状为椎体或梭形,无暗斑,近端树突结构保留,顶端日晕结构完整;死亡的神经元胞体为统一的暗视野,胞体充满暗斑。不健康神经元胞体布有水泡,树突呈串珠样改变,胞膜模糊,胞体肿胀,胞浆有明显的黑色颗粒。(图 1,A-D)。
|
| (A, B)大鼠海马组织CA1区健康椎体神经元(400×); (C)死亡神经元(400×); (D)不健康神经元(400×) 图 1 各组大鼠神经元形态学观察 Fig. 1 Morphological observation of neurons in each group |
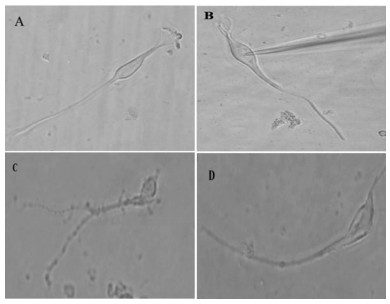
在对称性高钾浴液中(细胞浴液与电极内液K+浓度均为140 mmol/L),所记录的KATP通道开放多呈簇状和猝发样,两次开放之间常为较长时间的关闭状态。KATP通道电流的幅度随超极化或去极化程度加大而增大(图 2A),在同一钳制电位下,通道电流幅度基本相同,呈波宽不等的矩形方波。细胞浴液内加入KATP通道特异性阻断剂格列苯脲(Glybenclamide 0.1mmol/L)可基本阻断KATP通道的开放(图 2B)。由电流-电压关系曲线(Ⅰ-Ⅴ曲线)的斜率得出所记录的单通道电导为80.1±7.6 pS(膜片数n=8)(图 2C)。
|
| 电流曲线左侧为钳制电压, 曲线右侧-C代表通道关闭状态; 电流曲线向下和向上的偏转, 分别代表内向和外向的电流。A采用膜片钳内膜向外模式记录的正常大鼠海马锥体细胞KATP通道电流曲线。B细胞浴液中加入KATP通道特异性阻滞剂格列苯脲(0.1 mmol/L)后所记录的电流曲线。C为KATP通道Ⅰ-Ⅴ图。 图 2 KATP通道电生理特征 Fig. 2 Electrophysiological characteristics of KATP channels |
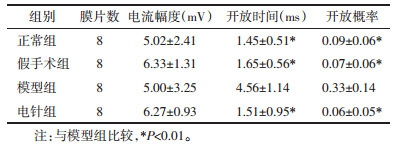
由于+60 mV钳制电压下所记录的电流曲线基线平稳,噪音相对较少,通道开放稳定,故实验对+60mV钳制电压下所记录到的电流曲线进行拟合分析,各组随机选取8个封接成功的膜片进行数据分析。与正常组比较,假手术组海马CA1区神经元KATP通道电流幅度、开放时间、开放概率均无统计学差异(均P > 0.05);与正常组、假手术组比较,模型组开放时间、开放概率均明显增大(P < 0.01),电流幅度无统计学差异(P > 0.05);与模型组比较,电针组开放时间、开放概率明显减小(P < 0.01),电流幅度无统计学差异(P > 0.05)。见表 2。
|
“醒脑开窍”针刺法是石学敏院士创立的治疗中风病行之有效的方法。多年来“醒脑开窍”针刺法广泛应用于缺血性脑卒中的临床治疗,效果显著。内关、水沟、三阴交为“醒脑开窍”针刺法主穴。内关为八脉交会穴,通阴维脉,为手厥阴心包经之络穴,有宁心安神、疏通气血之功;水沟为督脉与手、足阳明经之会穴,督脉起于胞中,上行入脑达巅,故针刺水沟可调督脉、开窍启闭以醒脑安神;三阴交穴为肝、脾、肾三阴经的交会穴,能激发三阴气血,达到养血安神之功。近年来,“醒脑开窍”针刺法干预脑缺血的实验研究从细胞、亚细胞水平逐步深入到分子水平,其防治脑损伤的作用机制主要体现在改善神经缺损、提高细胞缺血后抗氧化能力、抑制缺血-再灌注损伤、改善脑供血等方面[8]。
ATP敏感性钾通道是电压非依赖性配体门控通道,由内向整流钾通道和硫脲类受体(SUR)组成,是一组直接将细胞能量代谢和电活动相耦联的重要通道,该通道广泛分布于大脑各类神经元中,参与多种细胞功能调控。KATP通道开放使得K+外流,细胞膜超极化,细胞兴奋性降低,这种超极化可以使细胞膜电位更接近于K+平衡电位。在脑缺血再灌注损伤中,KATP通道的开放可以稳定膜电位,避免神经元受到去极化和兴奋性毒性造成的损伤[9]。KATP通道产生的内向整流钾电流可以被细胞内ATP所抑制,当细胞内ATP/ADP比率升高,可使KATP通道关闭,引起细胞的去极化,而当细胞内ATP/ADP比率降低,可使KATP通道开放,引起细胞的超极化[10]。在生理条件下,由于脑组织细胞内ATP含量处于高水平,神经元KATP通道处于关闭状态,而在缺氧缺血、缺血预适应或代谢抑制的病理条件下由于细胞内ATP/ADP比率降低,KATP通道则开放,通过使神经元膜电位超极化、降低神经元兴奋性等途径减少神经元损伤和退变[11]。
针刺抗脑组织缺氧缺血损伤作用已得到确证,它的作用可能与调节KATP通道开放相关。我们课题组之前的研究发现针刺可能通过KATP通道调节PI3K/Akt信号通路,从而减少脑缺血再灌注后细胞凋亡的发生[12]。Jiang等[13]以电针预处理新生缺氧缺血大鼠,发现电针可促进KATP通道开放,抑制电压依赖性钙通道开放,减轻Ca2+超载和减少兴奋性神经递质的释放,降低核转录因子c-fos和c-jun蛋白的表达,抑制神经细胞凋亡发生。许静等[14]以电针百会、大椎穴干预MCAO大鼠,结果发现针刺能使线粒体mito-KATP通道开放,减少线粒体内钙释放、维持缺血缺氧后线粒体的稳定性;减少细胞凋亡的发生,从而保护神经元。
目前从细胞电生理角度探讨针刺对抗脑缺血作用机制的研究非常少见,这与神经元个体微小,很难在离体环境中存活有关。膜片钳技术是在电压钳的基础上发展而来的一种记录细胞膜离子通道电生理活动的技术。发展至今,已成为现代细胞电生理研究的先进方法,为解决生物信息的跨膜信号转导问题提供了先进的研究手段。膜片钳技术可直接观测到细胞膜离子通道的电学改变用以解释针刺的细胞作用机制[15]。本项研究借助单细胞膜片钳技术直接观测“醒脑开窍”针刺法对MCAO/R大鼠海马神经元KATP通道电生理特性的影响,结果发现:脑缺血再灌注后大鼠神经功能评分明显下降,说明大鼠神经功能明显受到损伤,而海马椎体神经元KATP通道开放时间明显延长、开放概率明显增大,说明脑缺血再灌注损伤后海马组织KATP通道开放活动明显增加,脑组织通过调节KATP通道开放维持细胞能量代谢,降低神经元兴奋性而发挥自我保护效应,这一发现与之前文献报道相一致[16-17]。而电针“醒脑开窍”针刺法主穴后大鼠神经功能评分明显升高,说明神经功能得到改善,而海马神经元KATP通道开放时间、开放概率明显降低,说明针刺有效的对抗了脑缺血再灌注损伤,起到维持神经元正常能量代谢的作用,使海马神经元KATP通道开放活动趋于正常水平。另外,我们发现模型组、电针组海马神经元KATP通道电流幅度较空白组、假手术组均无明显差异,说明脑缺血再灌注损伤及针刺干预均未对KATP通道电流幅度产生影响。目前,本研究仅涉及造模后针刺的后处理效应,对于针刺的预处理是否可在脑缺血再灌注的病理过程中进一步激活KATP通道开放,以及随着脑缺血再灌注病理损伤的出现,KATP通道开放的动态变化等问题将成为下一步研究关注的重点。
| [1] |
李亚巍, 陈丽红, 韩丽琴, 等. 羧甲基化灵芝多糖预处理对大鼠脑缺血再灌注损伤的影响及其机制[J]. 山东医药, 2018, 58(4): 12-16. DOI:10.3969/j.issn.1002-266X.2018.04.004 |
| [2] |
Dong YF, Wang LX, Huang X, et al. Kir6.1 knockdown aggravates cerebral ischemia/reperfusion-induced neural injury in mice[J]. CNS Neurosci Ther, 2013, 19(8): 617-624. DOI:10.1111/cns.2013.19.issue-8 |
| [3] |
Shu Y, Li Z, Han B. Penehyclidine hydrochloride postconditioning ameliorates cerebral ischemia-reperfusion injury:critical role of mitochondrial ATP sensitive potassium channel[J]. J Biol Regul Homeost Agents, 2016, 30(1): 41-53. |
| [4] |
Sun HS, Feng ZP. Neuroprotective role of ATP-sensitive potassium channels in cerebral ischemia[J]. Acta Pharmacol Sina, 2013, 34(1): 24-32. |
| [5] |
Longa EZ, Weinstein PR, Carlson S, et al. Reversible middlecerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. |
| [6] |
张俊清, 孟智宏, 樊小农. 大鼠神经行为缺损评分与脑梗死率相关性研究分析[J]. 辽宁中医杂志, 2012, 39(11): 2140-2142. |
| [7] |
Li XM, Li JG, Yang JM, et al. An improved method for acute isolation of neurons from the hippocampus of adult rats suitable for patch-clamping study[J]. Sheng Li Xue Bao, 2004, 56(1): 112-117. |
| [8] |
刘春霞, 李薇薇. "醒脑开窍"针刺法治疗缺血性脑卒中实验研究进展[J]. 中华针灸电子杂志, 2015, 4(2): 10-13. |
| [9] |
Zhang Y, Pan SP, Zheng XL, et al. Cytomembrane ATP-sensitive K+ channels in neurovascular unit targets of ischemic stroke in the recovery period[J]. Exp Ther Med, 2016, 12(2): 1055-1059. DOI:10.3892/etm.2016.3373 |
| [10] |
Seino S, Miki T. Physiological and pathophysiological roles of ATPsensitive K+ channels[J]. Prog Biophys Mol Biol, 2003, 81(2): 133-176. DOI:10.1016/S0079-6107(02)00053-6 |
| [11] |
Sun X L, Hu G. ATP-sensitive potassium channels:A promising target for protecting neurovascular unit function in stroke[J]. Clin Exp Pharmacol Physiol, 2010, 37(2): 243-252. DOI:10.1111/cep.2010.37.issue-2 |
| [12] |
韩林, 高旸, 王旭慧, 等. 醒脑开窍针刺法对脑缺血再灌注损伤大鼠海马组织p-Akt(Ser 473)表达及细胞凋亡的影响[J]. 天津中医药, 2018, 35(8): 608-612. |
| [13] |
Jiang KW, Zhao ZY, Shui QX, et al. Electro-acupuncture preconditioning abrogates theelevation of c-Fos and c-Jun expression in neonatal hypoxic-ischemic rat brains induced byglibenclamide, an ATP-sensitive potassium channel blocker[J]. Brain Res, 2004, 998(1): 13-19. |
| [14] |
许静, 王光义.针刺对大鼠脑缺血再灌注损伤皮层线粒体ATP敏感性钾通道及凋亡相关基因表达的影响[A].中国针灸学会.中国针灸学会2009学术年会论文集(上集)[C].北京: 中国针灸学会, 2009. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGZS200909002168.htm
|
| [15] |
Zhang D. Patch clamp:a powerful technique for studying the mechanism of acupuncture[J]. Evid Based Complement Alternat Med, 2012, 2012(17): 1-6. |
| [16] |
Yuan F, Fu H, Sun K, et al. Effect of dexmedetomidine on cerebral ischemia-reperfusion rats by activating mitochondrial ATP-sensitive potassium channel[J]. Metab Brain Dis, 2017, 32(2): 539-546. |
| [17] |
Ran YH, Wang H. Iptakalim, an ATP sensitive potassium channel opener, confers neuroprotection against cerebral ischemia/reperfusion injury in rats by protecting neurovascular unit cells[J]. J Zhejiang Univ Sci B, 2011, 12(10): 835-845. DOI:10.1631/jzus.B1100067 |
2. Acupuncture Research Institute, First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2019, Vol. 36
2019, Vol. 36