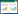文章信息
- 路岩莉, 房艳艳, 李新民, 孙丹, 晋黎, 韩耀巍
- LU Yanli, FANG Yanyan, LI Xinmin, SUN Dan, JIN Li, HAN Yaowei
- 中药复方熄风胶囊对氯化锂-匹罗卡品致痫大鼠海马电压门控性Ⅰ型钠通道α亚基蛋白表达的影响
- Effects of Xifeng Capsule on the expression of voltage-gated type Ⅰ sodium channel α subunit protein (Nav1.1) in hippocampus of epileptic rats induced by lithium chloride and pilocarpine
- 天津中医药, 2019, 36(3): 275-278
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(3): 275-278
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.03.17
-
文章历史
- 收稿日期: 2018-12-15
2. 山东省临沂市中医医院儿科, 临沂 276002
药物难治性癫痫是目前儿科神经领域的研究热点,其中抗癫痫药物(AEDs)作用靶点发生结构或功能改变是导致药物难治的原因之一。目前研究较多的作用靶点是电压门控性钠离子通道,主要在可兴奋性细胞中表达,其结构和功能异常可引起神经元的膜兴奋性改变,参与癫痫的发病机制,尤其是Ⅰ型电压门控性钠通道(Na1.1)最为重要。实验将从氯化锂—匹罗卡品致痫大鼠海马Na1.1的表达入手,观察中药复方制剂熄风胶囊对其影响。
1 材料 1.1 动物SPF级健康雄性SD大鼠45只,体质量(45±10)g,由中国人民解放军军事医学科学院实验动物中心提供,适应性喂养3 d后开始实验。
1.2 药品氯化锂(批号为115K1308,每瓶100 g,美国Sigma公司)、盐酸匹罗卡品(批号为066k1730,5 g/瓶,美国Sigma公司)、熄风胶囊[院内制剂,药物组成:紫河车、石菖蒲、天麻、川芎、全蝎、白僵蚕、蜈蚣、白矾、郁金等,批号为津药制字(2001)Z第0252号,每粒0.33 g,天津中医药大学第一附属医院杏林药厂]等。
2 实验动物的分组及处理 2.1 造模将45只大鼠随机分成两组,空白组6只,其余39只用于模型的建立。腹腔注射氯化锂(127 mg/kg),18 h后腹腔注射硫酸阿托品(1 mg/kg)以减少外周胆碱能作用,30 min后腹腔注射匹罗卡品(浓度1%,首次20 mg/kg,30 min后10 mg/kg),大鼠出现癫痫持续状态(SE)1 h后,再给予腹腔注射地西泮(10 mg/kg)解除抽搐,如痫性发作不能缓解,可重复注射地西泮1~2次,直到痫性发作被解除。
惊厥评分采用Racine评分法[1]。0级:无反应;Ⅰ级:耳、面部抽搐;Ⅱ级:肌阵挛,但无直立位;Ⅲ级:肌阵挛,伴直立位;Ⅳ级:全身强直-阵挛发作;Ⅴ级:全身强直-阵挛发作,并失去体位控制。痫性发作达到Ⅳ及以上,解除发作后状态良好的大鼠为合格致痫大鼠模型。
2.2 分组35只造模成功的大鼠随机选择24只,按每组6只随机分成4组:模型对照组(模型组)、熄风胶囊低剂量治疗组(熄低组)、熄风胶囊中剂量治疗组(熄中组)、熄风胶囊高剂量治疗组(熄高组)。
2.3 处理熄低组、熄中组和熄高组大鼠,分别每天上午灌胃熄风胶囊0.33、0.66和0.99 g浓缩剂,每次2 mL,模型组和空白组大鼠,分别每天上午灌胃生理盐水1次,每次2 mL。共持续60 d。
3 免疫组化实验 3.1 标本制备致痫大鼠10%水合氯醛麻醉,心脏内快速推注250 mL生理盐水灌洗液至肝脏变为土黄色,待右心流出清亮液体时,4% 250 mL冷多聚甲醛磷酸缓冲液灌注至大鼠全身肌肉逐渐僵硬、强直,即断头、取脑,置于冰盘上4%戊二醛固定液中剥离脑组织,将含有双侧海马的脑组织固定于4%多聚甲醛缓冲液中。
3.2 标本检测石蜡切片脱蜡至水。蒸馏水冲洗,磷酸盐缓冲液(PBS)浸泡5 min。切片放入92~98 ℃的500 mL 0.01 mol/L柠檬酸-柠檬酸钠溶液中反应15 min后,自然冷却到50 ℃以下,用1×PBST洗掉其表面的修复液。3%H2O2室温孵育10 min,PBS冲洗,2 min×3次。10%牛血清的封闭液封闭,室温孵育1 h。倾去血清,滴加1:200的稀释抗体,4 ℃过夜。PBS冲洗,2 min×3次。1:1 000稀释二抗,37 ℃孵育30 min。PBS冲洗,2 min×3次。二氨基联苯胺法(DAB)显色。蒸馏水冲洗,复染,脱水透明,中性树胶封片,晾干后用显微镜观察,照相。
3.3 统计分析采用Image-Pro Plus6.0软件对图像进行分析,计算平均阳性光密度。采用SPSS 22.0软件对实验数据进行统计学处理。计量资料采用均数±标准差(x±s)进行描述,多组比较采用单因素方差分析(one-way ANOVA),组间两两比较用SNK-q检验;设置双侧检验水准α=0.05,P < 0.05为差异有统计学意义。
4 实验结果 4.1 对大鼠自发性发作(SRS)的影响采用氯化锂-匹罗卡品癫痫动物模型,造模成功率为93%。在造模及随后为期60 d的灌胃过程中,发现致痫大鼠均出现了癫痫慢性期的行为学改变,即SE后15 d到两个月内出现反复SRS,最初多为局部性发作如前肢阵挛或面部抽搐,很快发展至全身强直性惊厥发作,持续时间一般不超过1 min,SRS均可自行终止。
空白组未见抽搐发作,其余各组均有SRS发作,与模型组比较,各熄风胶囊治疗组SRS发作次数均低于模型组(P < 0.05),且有随剂量增大效果越好趋势,但组间比较没有统计学意义。见表 1。
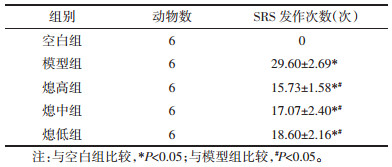
光镜(×200)下观察,发现Nav1.1的免疫反应物呈现棕褐色颗粒状或者点状免疫标记。所有大鼠海马CA1、CA3及齿状回区分子层及颗粒层均可见深染的颗粒状免疫反应物,呈点片状分布。致痫大鼠的神经元和Nav1.1的表达变化主要发生在CA3区,CA1区和DG区神经元结构受累较少。
海马CA3区免疫组化结果见图 1。空白组:显示神经元分布均匀且较密集,核呈圆形,可见小核仁。Nav1.1免疫反应物广泛分布于细胞的胞核和胞浆。模型组可见棕褐色区域减少,且变淡,说明多灶状神经元明显减少,且分布不均匀,以CA3区为重,证实该区域神经元退变、坏死,Nav1.1在神经元退变、坏死部位染色变浅,甚至消失;在变性、坏死的神经元周围的正常组织中染色增强。熄低组可见棕褐色区域明显减少、变淡,证实大量神经元退变、消失,残存神经元呈退行性改变;熄中组可见棕褐色区域部分减少、轻度变淡,证实神经元部分退变、消失,数量不多;熄高组棕褐色区域稍变少,未见明显变淡,证实少量神经元退变、消失。中药各治疗组在变性、坏死的神经元周围的正常组织中染色增强不明显。
|
| 图 1 Ⅰ型钠通道α亚基(Nav1.1)蛋白在海马各个区域的表达情况(×200) Fig. 1 Expression of voltage-gated type Ⅰ sodium channel α subunit protein (Nav1.1) in hippocampus of epileptic rats(×200) |
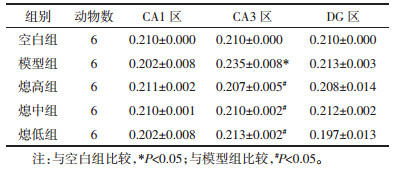
对于Nav1.1的表达情况,见表 2。CA1区与DG区Nav1.1蛋白的表达变化不明显。CA3区,与空白组比较,模型组的Nav1.1蛋白的表达水平上调(P < 0.05);与模型组比较,各治疗组的Nav1.1蛋白的表达水平均下调(P < 0.05),各组相比较,随熄风胶囊剂量升高有减少趋势,但差异没有统计学意义(P>0.05)。
|
哺乳动物钠离子通道是由1个α大亚基(260KD)和2个辅助β亚基(32-37KD)构成的复合体,其中α亚基是钠通道的功能性亚单位,分为9个亚型,即Nav1.1-Nav1.9,其中Nav1.1、Nav1.2、Nav1.3和Nav1.6表达于中枢神经系统。编码Na1.1的基因SCN1A与癫痫的关系密切[2]。电压门控性钠通道是细胞动作电位产生的结构基础,其开放引起的去极化内向电流是兴奋性细胞产生动作电位的关键[3],结构和功能异常引起的活性改变是癫痫的病理基础[4],因此调节钠通道功能成为许多抗癫痫药物的作用机制。
马融教授提出癫痫病机为肾精亏虚,痰瘀阻络,治宜益肾填精、豁痰熄风,因此研制了熄风胶囊。前期研究证实熄风胶囊能够降低致痫大鼠的SRS,有效抑制多药耐药相关蛋白1(MRP1)的过度表达[5],干预海马颗粒细胞层及内分子层P38和GAP的表达,从而起到减轻海马损伤的作用[6]。
Nav1.1在海马CA1区、CA3区和DG区广泛分布,实验结果发现致痫大鼠海马CA1区和DG区神经元结构基本正常,且Nav1.1变化不明显,在CA3区,模型组致痫大鼠神经元变性、坏死明显,Nav1.1在神经元变性、坏死部位染色变浅,甚至消失,在变性、坏死神经元周围的正常组织中染色增强的表达特点,证实致痫大鼠神经元变性坏死,Nav1.1随之丢失,导致周围正常锥体神经元上的Nav1.1反应性增加,从而表现为Nav1.1的上调,这种表达的上调可能直接参与了癫痫样放电的发生[7-8]。
神经元和Nav1.1的表达变化主要发生在CA3区,CA1区和DG区神经元结构受累较少,说明CA3区为主要损伤部位,这与前期研究一致[6]。其中,模型组可见CA3区神经元退变、坏死,Nav1.1在神经元退变、坏死部位染色变浅,甚至消失;而在熄风胶囊治疗组中,随剂量增大,退变、消失的神经元减少,提示熄风胶囊对致痫大鼠海马具有神经保护作用,且与剂量成正相关,这与前期研究一致[6],同时棕褐色区域减少程度减低,提示熄风胶囊可以减少Nav1.1蛋白的丢失,这种表现与剂量成正相关。模型组中在变性、坏死的神经元周围的正常组织中染色增强,而在中药各治疗组在变性、坏死的神经元周围的正常组织中染色增强不明显,而且从定量分析来看,模型组Nav1.1的表达量增多,而各熄风胶囊治疗组去增加不明显,提示熄风胶囊可以减少神经元坏死区域周围正常组织Nav1.1的表达上调。
本实验结果表明熄风胶囊对致痫大鼠海马Nav1.1蛋白的表达有减少神经元坏死区丢失和周围正常组织上调的作用,结合光电镜结果提示各治疗组大鼠海马神经元的丢失情况均有不同程度的改善,因此本实验证实熄风胶囊可能通过保护海马神经元,调节IE大鼠海马神经元Nav1.1的表达,推测其可通过对钠通道的抑制作用以降低神经元细胞膜兴奋性而发挥抗癫痫作用。
| [1] |
Racine RJ. Modification of seizure activity by electrical stimulation.Ⅱ.Motor Seizure[J]. Electroenceph Clin Neurophysiol, 1972, 32(3): 281-294. DOI:10.1016/0013-4694(72)90177-0 |
| [2] |
Vohora D, Saraogi P, Yazdani MA, et al. Recent advances in adjunctive therapy for epilepsy:focus on sodium channel blockers as third-generation antiepileptic drugs[J]. Drugs Today (Barc), 2010, 46(4): 265-277. DOI:10.1358/dot.2010.46.4.1445795 |
| [3] |
Mccusker EC, Bagneris C, Naylor CE, et al. Structure of a bacterial voltage-gated sodium channel pore reveals mechanisms of opening and closing[J]. Nat Commun, 2012, 3(4): 1102. |
| [4] |
Abdelsayed M, Sokolov S. Voltage-gated sodium channels:pharmaceutical targets via anticonvulsants to treat epileptic syndromes[J]. Channels, 2013, 7(7): 146-152. |
| [5] |
李新民, 陈会, 任艳艳. 熄风胶囊对氯化锂-匹罗卡品诱导的癫痫大鼠大脑皮质和海马多药耐药相关蛋白1表达的影响[J]. 中西医结合学报, 2012, 10(8): 911-917. |
| [6] |
路岩莉, 李珍, 马莉婷. 熄风胶囊干预治疗对氯化锂-匹罗卡品癫痫大鼠海马突触损伤的影响[J]. 天津中医药, 2014, 31(7): 430-435. |
| [7] |
Bauer S, Willems LM, Paule E, et al. The efficacy of lacosamide as monotherapy and adjunctive therapy in focal epilepsy and its use in status epilepticus: clinical trial evidence and experience[J]. 2017, 10(2): 103-126.
|
| [8] |
刘静馨.癫痫患者诱导多能干细胞来源的神经元中Nav1.1突变效应及其致病机理研究[D].合肥: 中国科学技术大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10358-1016103261.htm
|
2. Paediatrics, Chinese Medicine Hospita in Linyi, Linyi 276002, China
 2019, Vol. 36
2019, Vol. 36