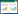文章信息
- 高建辉, 马艳, 余云飞, 刘俊昌
- GAO Jianhui, MA Yan, YU Yunfei, LIU Junchang
- 摩腹手法对睡眠剥夺大鼠脑内神经递质及Orexin-A的影响
- Effect of abdominal massage therapy on cerebral neurotransmitter and Orexin-A in sleep deprivation rats
- 天津中医药, 2019, 36(3): 279-282
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(3): 279-282
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.03.18
-
文章历史
- 收稿日期: 2018-10-30
2. 新疆医科大学, 乌鲁木齐 830000
失眠目前已成为严重影响人们身心健康和日常生活的常见疾病之一,其患病率在全球范围内正逐年升高,并日趋普遍化、年轻化[1-2]。最新的研究认为,睡眠和觉醒的产生与维持主要依赖于脑内的睡眠和觉醒中枢及其相应的神经递质,包括:去甲肾上腺素(NE)、5-羟色胺(5-HT)、多巴胺(DA)、γ-氨基丁酸(GABA)等[3]。此外,下丘脑的食欲素(Orexin)系统也被认为与睡眠和觉醒密切相关并发挥重要作用[4]。摩腹手法作为中医的推拿疗法,在临床上治疗原发性失眠疗效确切,具有安全性高、无毒副作用及依赖性等优势。本研究通过观察摩腹手法对睡眠剥夺大鼠脑内睡眠和觉醒中枢相应神经递质及Orexin-A水平的影响,探讨摩腹手法调节睡眠和觉醒的机制,为腹部推拿治疗失眠提供科学的实验证据。
1 材料 1.1 动物及分组选取Wistar大鼠共30只,雌雄各半(新疆医科大学动物实验中心提供),5~6月龄,体质量(300±50)g,喂养环境保持安静,温度控制在18~22 ℃,通风良好,自然光线。适应性喂养3 d,称质量编号后采用分层随机分组分为正常对照组、模型对照组和摩腹手法组,每组10只,雌雄各半。
1.2 主要试剂戊巴比妥钠(国药集团化学试剂有限公司),GABA检测试剂盒(ELISA)、DA检测试剂盒(ELISA)、NE检测试剂盒(ELISA)、5-HT检测试剂盒(ELISA)、Orexin-A检测试剂盒(ELISA)(北京中杉金桥生物技术有限公司)。
2 实验方法 2.1 实验造模针对模型对照组和摩腹手法组的大鼠进行睡眠剥夺造模。采用改良多平台水环境法[5]:自制90 cm×70 cm×50 cm的水槽作为鼠箱,其内设10个直径6 cm、高8 cm的圆形平台,两两间隔15 cm。向水槽内注水并使水面保持在平台面下方约1 cm处,水温保持约20 ℃。箱内单次放入大鼠5只,确保大鼠可在平台间自由活动。
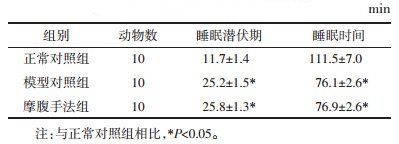
造模成功的判定:采用戊巴比妥钠睡眠实验判定[6]。造模完成后,3组大鼠均腹腔注射戊巴比妥钠(剂量为预实验测得引起100%大鼠睡眠的最小阈剂量),将大鼠腹部向上置于实验台上,记录大鼠的睡眠潜伏时间和睡眠时间。以翻正反射消失满1 min为发生睡眠,以翻正反射恢复为觉醒。对正常对照组和造模两组大鼠的睡眠潜伏时间、睡眠时间及睡眠率进行统计分析,若有统计学意义(P < 0.05),则提示造模成功。
2.2 干预方法将大鼠束缚于实验台上,取仰卧位。摩腹手法具体操作:根据“逆摩为补,顺摩为泻”的原则,操作者位于大鼠左侧,右手拇指末节指腹罗纹面着实于关元穴,其余四指并拢自然伸开或弯曲,通过肩关节在外前方向的小幅度环转,带动拇指在大鼠腹部做逆时针方向环形平移摩擦;移动范围:上起鸠尾穴,下止关元穴,左右至双侧带脉穴;周而复始,5~7次/min,操作5 min后,改变环转方向为顺时针,按照上述方法再操作5 min。操作时发力应平稳着实,速度适中,每日治疗1次,连续治疗14 d。模型对照组:每日束缚于实验台10 min,不予治疗,只进行实验检测。每日束缚1次,连续捆绑14 d。正常对照组:同模型对照组。
2.3 取材及标本处理3组大鼠干预完成后,将麻醉完全的大鼠断头取脑,根据第6版Sprague-Dawley大鼠脑图谱,分离出双侧下丘脑和脑干组织,称质量后,分别将大鼠下丘脑及脑干组织匀浆、离心,取上清液。
2.4 检测指标采用酶联免疫吸附法(ELISA)分别测定下丘脑样品内GABA、Orexin-A和脑干样品内DA、NE、5-HT的水平,按相应试剂盒的说明操作。记录所得的各组样品的OD值,在配套软件中,绘制标准品线性回归曲线,计算相应数据。
2.5 统计学处理统计分析采用SPSS 21.0统计软件,所得计量资料进行正态性与方差齐性检验,组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;检验水准α=0.05,以P < 0.05为差异有统计学意义。
3 结果 3.1 造模情况造模完成后各组大鼠戊巴比妥钠睡眠实验情况见表 1,造模的两组大鼠在睡眠潜伏期和总睡眠时间方面与正常对照组相比均存在统计学差异(P < 0.05),提示造模成功。
|
干预完成后,正常对照组大鼠精神最为良好,活动迅速,反应灵敏,毛发柔顺光泽,体质量有显著增加;模型对照组大鼠精神明显萎靡,毛发杂乱或竖直变硬且暗黄无光,或易受惊扰,消瘦;摩腹手法组大鼠精神、情绪及反应情况均不如正常对照组,与模型对照组相比较平静,偶见眯眼,体质量降低也相对较少。
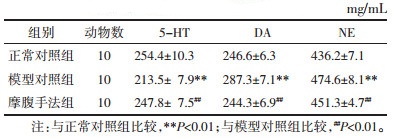
3.3 大鼠脑内神经递质的水平与正常对照组相比,模型对照组大鼠脑内5-HT水平有明显降低(P < 0.01),DA和NE水平明显升高(P < 0.01),差异均具有统计学意义,提示动物模型造模成功。与模型对照组相比,摩腹手法组大鼠脑内5-HT水平有显著回升(P < 0.01),DA和NE水平明显回落(P < 0.01,P < 0.01),差异均具有统计学意义,提示摩腹手法可通过调节大鼠脑内DA、NE和5-HT这3种单胺类神经递质的水平,起到调节动物睡眠和觉醒状态的作用。见表 2。
|
与正常对照组相比,模型对照组大鼠下丘脑Orexin-A水平有明显升高(P < 0.01),GABA水平明显降低(P < 0.01),差异均具有统计学意义,提示动物模型造模成功。与模型对照组相比,摩腹手法组大鼠下丘脑Orexin-A水平有显著回落(P < 0.05),但GABA水平无统计学差异(P > 0.05),提示摩腹手法可明显降低大鼠下丘脑Orexin-A的水平,而对GABA水平并无明显影响。见表 3。
睡眠和觉醒的产生与维持主要依赖于脑内的睡眠和觉醒系统[7]。下丘脑腹外侧视前区(VLPO)和内侧视前区的抑制性GABA能神经元是脑内主要的睡眠中枢,其释放的抑制性递质GABA可在睡眠期抑制觉醒脑区的活动,促进和维持睡眠。蓝斑(LC)NE能、中缝背核(DR)5-HT能、黑质DA能等单胺能神经元,是脑内觉醒调节中枢的主要结构,其纤维末梢释放相应的觉醒递质,可直接调控对应脑区的活动[8-9],从而兴奋皮质和维持觉醒状态。有研究表明VLPO睡眠中枢与单胺能觉醒中枢之间存在双向的纤维联系,并且是相互抑制的关系,这种关系是构成人体睡眠和觉醒状态稳定的基础。因此,上述神经递质水平的变化对机体睡眠和觉醒状态的调节有着重要意义。这些结论在本实验中即得到体现:模型对照组大鼠脑内的GABA、DA、NE和5-HT的水平与正常对照组相比均产生了显著变化,并且,除了GABA水平外,摩腹手法组大鼠脑内的DA、NE和5-HT的水平与模型对照组相比也都呈现出差异。据此推测:摩腹手法可能是对觉醒中枢的DA、NE和5-HT这3种单胺类神经递质的影响比较明显,并以此降低了觉醒中枢对大脑皮质的兴奋作用;而对睡眠中枢及GABA的影响却并不显著。
此外,下丘脑后外侧区的Orexin能系统被认为是机体的“觉醒开关”[10],它与上述睡眠和觉醒调节系统都分别存在双向的神经元投射关系,并通过Orexin(A和B)的分泌影响其活动,是上述睡眠和觉醒调节系统的最终调控系统。研究发现Orexin神经元可通过多种途径影响GABA、DA、NE和5-HT的水平[11-17]。本实验中,模型对照组大鼠脑内Orexin-A水平较正常对照组有明显升高,而摩腹手法组大鼠下丘脑Orexin-A水平较模型对照组有显著回落。可见,无论是睡眠剥夺造模还是摩腹手法干预,都对大鼠下丘脑Orexin-A的水平造成了明显影响,而下丘脑Orexin-A水平的变化也明显反映了大鼠睡眠与觉醒的状态,这也从侧面印证了上述研究结论。但是,有关下丘脑Orexin-A对GABA、DA、NE和5-HT等神经递质的影响在本实验中未能涉及,希望可以在今后得到进一步研究。
中医学认为失眠属于“不寐”的范畴,而推拿疗法中的腹部推拿疗法,能够很好的针对“不寐”的病因病机,对机体直接产生作用。《难经》曰:“人之安卧,神归心,魄归肺,魂归肝,意归脾,志归肾,五脏各安其位而寝。”《灵枢·淫邪发梦》指出:“正邪从外袭内,而未有定舍,反淫于脏……使人卧不得安而喜梦。”可见,失眠与腹部五脏功能的稳定有着密切关系。而本实验中使用的摩腹手法可直接作用于腹部,手法作用范围涵盖了腹部的脾、胃、肝、肾经以及任脉、冲脉和带脉,依据中医经络脏腑学说,通过对腹部相应经络腧穴进行推按与摩运,能起到贯通身体上下气机,调节五脏六腑机能的作用。手法作用于任脉、冲脉和带脉,可起到一定的调冲任以调周身气血,强带脉以强诸经沟通的作用,手法作用于脾、胃、肝、肾经以及腹内肝、胃、脾、小肠等脏腑,亦可在一定程度上起到柔肝、和胃、实脾的作用[18],最终来改善“不寐”的症状。
| [1] |
Daniel J, Buysse MD. Sleep disorders and psychiatry (Review of psychiatry)[M]. Washington DC: American Dsychiatric Association, 2005: 185.
|
| [2] |
Stanley N. The physiology of sleep and the impact of ageing[J]. European Urology Supplements, 2005, 3(6): 17-23. DOI:10.1016/S1569-9056(05)80003-X |
| [3] |
Saper CB, Cano G, Scammell TE. Homeostatic, circadian, and emotional regulation of sleep[J]. Journal of Comparative Neurology, 2005, 493(1): 92. DOI:10.1002/(ISSN)1096-9861 |
| [4] |
Sutcliffe JG, De LL. The hypocretins:setting the arousal threshold[J]. Nature Reiview Neuroscience, 2002, 3(5): 339-349. DOI:10.1038/nrn808 |
| [5] |
马妮, 史明, 马安东, 等. 睡眠剥夺通过影响大鼠下丘脑组蛋白乙酰化调控神经元Orexin A的表达[J]. 神经解剖学杂志, 2016, 32(3): 333-338. |
| [6] |
Cagetti E, Liang J, Spigelman I, et al. Withdrawal from chronic intermittent ethanol treatment changes subunit composition, reduces synaptic function, and decreases behavioral responses to positive allosteric modulators of GABAA receptors[J]. Molecular Pharmacology, 2003, 63(1): 53-64. |
| [7] |
Saper CB, Cano G, Scammell TE. Homeostatic, circadian, and emotional regulation of sleep[J]. Journal of Comparative Neurology, 2005, 493(1): 92. DOI:10.1002/(ISSN)1096-9861 |
| [8] |
Carter ME, Lecea LD, Adamantidis A. Functional wiring of hypocretin and LC-NE neurons:implications for arousal[J]. Frontiers in Behavioral Neuroscience, 2013, 7(2): 43. |
| [9] |
Hu B, Yang N, Qiao QC, et al. Roles of the orexin system in central motor control[J]. Neuroscience & Biobehavioral Reviews, 2015(49): 43-54. |
| [10] |
Sutcliffe JG, De LL. The hypocretins:setting the arousal threshold[J]. Nature Reiview Neuroscience, 2002, 3(5): 339-349. DOI:10.1038/nrn808 |
| [11] |
Sakurai T. Hypocretin/orexin excites hypocretin neurons via a local glutamate neuron-A potential mechanism for orchestrating the hypothalamic arousal system[J]. Neuron, 2002, 36(6): 1169-1181. DOI:10.1016/S0896-6273(02)01132-7 |
| [12] |
España RA, Scammell TE. Sleep neurobiology for the clinician[J]. Sleep, 2004, 27(4): 811-820. |
| [13] |
Bayer L, Eggermann E, Serafin M, et al. Orexins (hypocretins) directly excite tuberomammillary neurons[J]. European Journal of Neuroscience, 2001, 14(9): 1571-1575. DOI:10.1046/j.0953-816x.2001.01777.x |
| [14] |
Bourgin P, Huitrón-Résendiz S, Spier AD, et al. Hypocretin-1 modulates rapid eye movement sleep through activation of locus coeruleus neurons[J]. Journal of Neuroscience the Official Journal of the Society for Neuroscience, 2000, 20(20): 7760-7765. DOI:10.1523/JNEUROSCI.20-20-07760.2000 |
| [15] |
Brown RE, Sergeeva O, Eriksson KS, et al. Orexin A excites serotonergic neurons in the dorsal raphe nucleus of the rat[J]. Neuropharmacology, 2001, 40(3): 457. DOI:10.1016/S0028-3908(00)00178-7 |
| [16] |
Sakurai T, Nagata R, Yamanaka A, et al. Input of orexin/hypocretin neurons revealed by a genetically encoded tracer in mice[J]. Neuron, 2005, 46(2): 297-308. DOI:10.1016/j.neuron.2005.03.010 |
| [17] |
Alam MN, Kumar S, Bashir T, et al. GABA-mediated control of hypocretin-but not melanin-concentrating hormone-immunoreactive neurones during sleep in rats[J]. Journal of Physiology, 2005, 563(Pt 2): 569. |
| [18] |
樊炜骏, 田少飞, 杨莹, 等. 津沽脏腑推拿治疗原发性失眠临床观察[J]. 辽宁中医药大学学报, 2016, 18(11): 50-52. |
2. Xinjiang Medical University, Urumqi 830000, China
 2019, Vol. 36
2019, Vol. 36