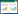文章信息
- 柴丽娟, 徐耀, 黄菊阳, 李芮琳, 郭虹, 王少峡, 胡利民
- CHAI Lijuan, XU Yao, HUANG Juyang, LI Ruilin, GUO Hong, WANG Shaoxia, HU Limin
- 醒脑静注射液组分促进缺氧复氧胶质细胞清除胞外谷氨酸提高缺氧神经元活力的研究
- Xingnaojing injection components promote glutamate clearance in hypoxia/reoxygenation astrocytes and improve cell viability in hypoxia neurons
- 天津中医药, 2019, 36(3): 283-287
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(3): 283-287
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.03.19
-
文章历史
- 收稿日期: 2018-11-15
2. 天津市中药药理学重点实验室, 天津 301617;
3. 天津中医药大学中医药研究院, 天津 301617
醒脑静注射液(XNJI)由麝香、冰片、郁金、栀子4味药经加工提取制备而成,由安宫牛黄丸精制而来,注射液中含有β-榄香烯、麝香酮、吉马酮、莪术烯酮、莪术二酮、樟脑、龙脑、冰片等多种成分,主用于气血逆乱,脑脉瘀阻所致中风昏迷,偏瘫口㖞等。临床上XNJI可以改善缺血区供氧供血,增强脑细胞活力和耐缺氧能力[1-2]。减轻大面积脑梗死后继发的脑水肿[3],降低脑梗死患者的炎症因子表达[4],改善患者的记忆功能与生活能力[5]。体外研究发现醒脑静提高氧糖剥夺损伤后血管内皮细胞存活,降低内皮细胞的炎症反应等[6]。虽然有很多XNJI在临床和动物脑中风中的研究,但在体外对其组分治疗中风研究机制还有待补充。
胶质细胞在脑组织损伤或缺血时发生激活,表现为细胞体积变大、数量增多和GFAP表达增加等一系列形态和功能的变化[7]。谷氨酸是中枢神经系统内重要的兴奋性神经递质,负责神经系统发育及维持突触可塑性。在脑中风等病理状态下,胞外谷氨酸浓度异常升高,可导致神经元内Ca2+超载,溃变,死亡,产生谷氨酸兴奋毒性[8]。因此迅速有效地将突触间隙的高浓度谷氨酸清除有利于维持正常的突触传递功能。星形胶质细胞与神经元相比较,具有更大的谷氨酸摄取能力[9]。生理状态下胶质细胞对神经元起到支撑、保护的作用;脑缺血过程中,胶质细胞也可以保护神经元,提高神经元的存活率[10]。综上,研究以XNJI的8种成分为研究对象,探讨其对Hypo /Reox后胶质细胞胞外高浓度谷氨酸的清除能力。因胶质细胞对神经元具有支持保护作用[10],研究同时利用各组分处理的胶质细胞条件培养液培养Hypo/Reox后神经元细胞,研究其对神经元活力的影响,以期为XNJI治疗脑中风提供实验室依据。
1 材料与方法 1.1 实验动物及试剂Wistar乳鼠购自北京维通利华;DMEM/F12培养基、青霉素/链霉素、0.125%胰蛋白酶(Gibco,美国);Anti-GFAP(CST,Danvers,MA);谷氨酰胺、dBcAMP、Glutamate Assay Kit(Sigma,美国);FBS(BI,以色列);Cell Counting Kit-8(日本同仁化学研究所,日本);BCA蛋白浓度测定(索来宝,中国);PC12神经元细胞株(由中国医学科学院药物研究所陈乃宏课题组惠赠)。
1.2 原代星形胶质细胞培养和纯化取1~2 d Wistar大鼠乳鼠脑组织,无菌条件下置于冷HBSS中。用眼科镊小心去除脑膜及大血管,剥离皮质于预冷的DMEM/F12培养基中,剪成1 mm3大小乳糜状,0.25%胰酶37 ℃震荡消化10 min后,用含10% FBS的DMEM/F12稀释终止消化。轻吹混匀后4 ℃、1 000 r/min离心10 min,弃去上清,用DMEM/F12重悬细胞,75 μm筛网过滤,收集滤液;4 ℃,1 000 r/min离心10 min收集沉淀,用DMEM/F12全培基(20% FBS,1%谷氨酰胺,1%双抗)重悬细胞,调细胞密度至5×105个/mL种植于75 cm2的培养瓶中。37℃,5% CO2培养箱差速贴壁1 h,而后将细胞悬液转移至新的75 cm2培养瓶中继续培养。细胞每3天半量换液1次。待细胞生长至融合时纯化。纯化时首先将细胞放于气浴摇床,260 r/min、37 ℃,振摇2 h弃去培养液以去除小胶质细胞。而后加入新培养液260 r/min,37 ℃振摇18 h去除少突胶质细胞,18 h后细胞进行传代备用。用胶质纤维酸性蛋白(GFAP)免疫荧光鉴定体外培养大鼠星形胶质细胞。实验选用稳定的第2代到第4代细胞。
1.3 胶质细胞缺氧复氧模型的建立将胶质细胞以2.2×104个/cm2种入96孔板中,组别分为3组,覆盖约有70%~80%时,用无血清培养基半量置换培养液2次进行同步化处理,2次置换间隔超过4 h。而后细胞进行缺氧模型的建立:
1)对照组(Control):细胞同步化1 d后,细胞培养液置换为含5% FBS的DMEM/F12全培养基,培养48 h,而后用磷酸盐缓冲液(PBS)轻洗细胞2次后,用5% FBS的DMEM/F12培养基于5% CO2、37 ℃饱和湿度培养箱中继续孵育2 h,3 h或4 h,而后置换为新的含5%的DMEM/F12全培养液,5% CO2、37 ℃饱和湿度培养箱中继续培养2 h,3 h或4 h。
2)缺氧复氧组(Hypo/Reox组):细胞同步化1 d后,细胞用含0.062 5 mmol/L dBcAMP的5% FBS的DMEM/F12培养基进行活化48 h。48 h后用预先通10 min 95% N2+5% CO2的HBSS液洗涤细胞2次,而后将细胞浸泡于该HBSS中,放入缺氧小室,缺氧小室中充满95% N2+5% CO2的气体后密封缺氧小室,放入37 ℃孵箱中培养2 h,3 h或4 h。缺氧结束后打开缺氧小室,取出培养板,弃去HBSS,置换成含0.062 5 mmol/L dBcAMP的5%血清的DMEM/F12全培养液,5% CO2、37 ℃饱和湿度培养箱中继续培养2 h,3 h或4 h,进行复氧。
3)配制CCK-8工作液(10%CCK-8原液与90%含5%FBS的DMEM/F12):将上述缺氧复氧结束的细胞更换为CCK-8工作液,37 ℃避光孵育30 min后,酶标仪560 nm测定吸光度,判定细胞活力。
1.4 细胞外谷氨酸清除模型的建立正常培养胶质细胞于12孔板,覆盖约有80%~90%时,将培养液置换为含100 μmol/L高浓度谷氨酸的培养液,分别于10 min、20 min、30 min、1 h、1.5 h、3 h取培养上清液50 μL,检测培养液中谷氨酸的含量。3 h后弃去培养液,PBS洗涤细胞后裂解液(0.25 mmol/L NaOH;0.1% Triton X-100)裂解细胞,用BCA法测定蛋白质含量,对谷氨酸测定浓度进行校正。
按照实验1.3部分对胶质细胞进行缺氧4 h复氧3 h处理,复氧时在细胞培养液中加入谷氨酸(终浓度为100 μmol/L)。复氧3 h结束时,取胶质细胞培养上清液50 μL,检测谷氨酸浓度,作为胶质细胞对胞外高浓度谷氨酸清除的实验数据。同样BCA法测定蛋白含量进行校正。
谷氨酸的含量采用sigma试剂盒进行测定:准备100 μL/孔反应混合液(glutamate assay buffer 90 μL,glutamate Developer 8 μL,glutamate enzyme mix 2 μL),加入到50 μL样品中,水平振动混匀后37 ℃避光孵育30 min,450 nm酶标仪检测。
1.5 XNJI对胶质细胞谷氨酸清除预加药分组及谷氨酸浓度测定将胶质细胞以2.2×104个/cm2种入12孔板中,胶质细胞生长至70%~80%时,细胞同步化处理1 d,Hypo/Reox组用含0.062 5 mmol/L dBcAMP的5% FBS的DMEM/F12培养基进行培养,药物处理组在Hypo/Reox组基础上加入XNJI不同的有效组分,药物配制分组如下:1)Hypo/Reox组。2)β-榄香烯10-5 mol/L组。3)麝香酮10-5 mol/L组。4)吉马酮10-5 mol/L组。5)莪术烯酮10-5 mol/L组。6)莪术二酮10-5 mol/L组。7)樟脑10-5 mol/L组。8)龙脑10-5 mol/L组。9)冰片10-5 mol/L组。对照组,与1.3处理相同。加入药物2 d后细胞进行缺氧4 h,4 h后将HBSS置换为含100 μmol/L高浓度谷氨酸的含药的DMEM/F12培养基,继续培养3 h。收集上述部分细胞培养上清液,取50 μL用于检测胶质细胞对细胞外高浓度谷氨酸清除能力的实验数据。
1.6 醒脑静处理胶质细胞条件培养液对体外Hypo/Reox后神经元活力的影响PC12细胞培养于DMEM(高糖)+5%胎牛血清+5%马血清+1%双抗培养液中,每2~3天用0.05%胰酶消化传代,5% CO2、37 ℃饱和湿度培养。取对数生长期的PC12细胞以6×104个/mL的密度种在96孔板中(100 μL/孔),24 h后,缺氧组神经元细胞换为无糖DMEM培养基(不含血清),置于缺氧小室中缺氧6 h,对照组细胞换为完全培养基(高糖DMEM加血清),放于培养箱中继续培养。6 h后缺氧组细胞置换为从1.4收取的胶质细胞条件培养液,对照组置换为来源于正常培养的胶质细胞条件培养液,在细胞培养箱中继续培养至24 h。24 h后加入CCK8,450 nm读取吸光度,进行PC12细胞活力测定。
1.7 统计学方法数据采用SPSS 18.0软件统计,计量资料用均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 胶质细胞培养鉴定显微镜下观察传代的星型胶质细胞折光性强,形状不规则,主要为多角形。有多个粗短枝状初级胞突,胞体大而扁平、胞质丰富,6~7 d后细胞融合成单层,符合神经胶质细胞生长特性。培养的胶质细胞经GFAP染色后,胞浆着色(如图 1箭头指示),细胞形态稳定,纯度高,证明培养的细胞为星型胶质细胞,可用于后续实验。
|
| 图 1 胶质细胞GFAP鉴定 Fig. 1 Identification of astrocytes by GFAP |
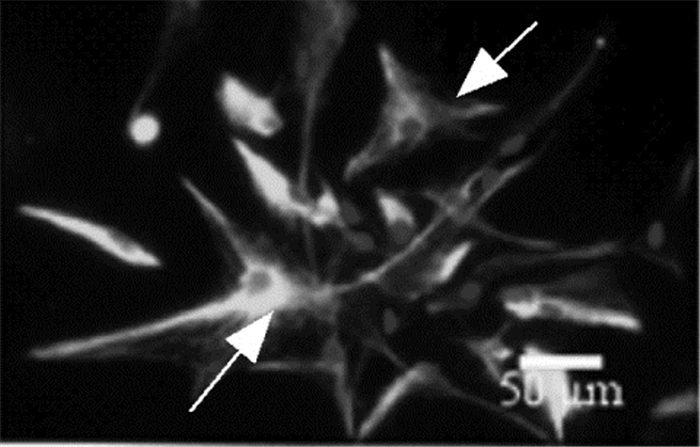
实验进一步对胶质细胞进行缺氧条件的摸索,从图 2A可以看出,与对照组相比,胶质细胞经含0.062 5 mmol/L dBcAMP和低浓度FBS培养基培养后,缺氧3 h后复氧3、4 h细胞活力显著下降。缺氧4 h,复氧2、3、4 h胶质细胞的活力同样显著下降,因此后续研究选用缺氧4 h作为缺氧时长。将谷氨酸加入到胶质细胞培养液高达100 μmol/L,检测不同时间点胶质细胞胞外谷氨酸浓度,从图 2B可以看出,随着时间延长,培养液中谷氨酸的浓度逐渐降低,3 h后降低约50%,证明培养的胶质细胞对胞外谷氨酸具有清除能力,故研究选用3 h为复氧时间点,进一步考察胶质细胞对胞外高浓度谷氨酸清除。为了进一步验证上述缺氧复氧时间点的有效性,从图 2C可以看出,胶质细胞缺氧4 h/复氧3 h(Hypo 4 h/Reox 3 h)后,细胞外培养基中谷氨酸浓度显著比对照组高,说明此时胶质细胞的谷氨酸清除能力减弱。综上,研究选用Hypo 4 h/Reox 3 h作为胶质细胞对胞外谷氨酸清除模型研究的时间点,基于此模型对XNJI有效组分进行药效学评价。
|
| 与对照组比较,##P < 0.01 图 2 胶质细胞对胞外谷氨酸清除Hypo 4 h/Reox 3 h模型的建立 Fig. 2 Establishment of Hypo 4 h/Reox 3 h model for extracellular glutamate clearance by astrocytes |
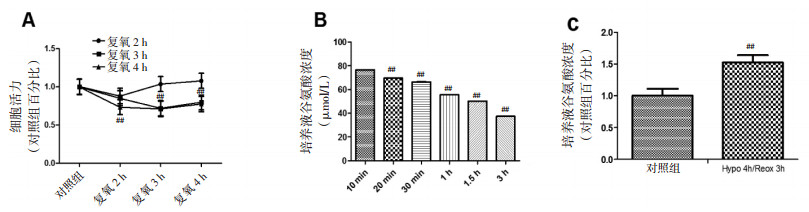
谷氨酸的清除主要依赖胶质细胞上的谷氨酸转运体,逆浓度将谷氨酸转移至细胞内,清除胞外高浓度谷氨酸。从图 3可以看出,与对照组相比,Hypo 4 h/Reox 3 h组胶质细胞胞外培养基中谷氨酸的浓度显著高,说明此时胶质细胞受损导致转运体的功能障碍,对胞外谷氨酸的清除能力显著降低。与Hypo 4 h /Reox 3 h组相比,XNJI有效组分β-榄香烯、吉马酮、龙脑、冰片组胞外谷氨酸浓度显著降低,说明4个有效成分能显著提高Hypo 4 h/Reox 3 h后胶质细胞对胞外高谷氨酸的清除能力。
|
| 与对照组比较,##P < 0.01;与Hypo 4h/Reox 3h组比较,*P < 0.05,**P < 0.01 图 3 XNJI有效组分对Hypo 4 h/Reox 3 h胶质细胞外谷氨酸清除的影响 Fig. 3 Effects of Xingnaojing effective components on astrocytes extracellular glutamate clearance after Hypo 4 h/Reox 3 h |
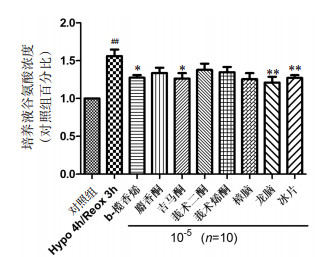
XNJI组分处理缺氧复氧后的胶质细胞,可以增加其对胞外高浓度谷氨酸的清除,取其培养基,培养缺氧后的神经元(图 4A所示)。从图 4B可以看出,与对照组相比,胶质细胞条件培养液Hypo 4 h/Reox 3 h组条件培养液对缺氧6 h神经元细胞活力没有影响;与Hypo 4 h/Reox 3 h组相比,XNJI有效组分吉马酮、龙脑、冰片处理后的条件培养液对缺氧后神经元的活力有显著提高作用,说明这3个成分可以通过缺氧后胶质细胞对缺氧后的神经元活力有提高作用。

|
| 与Hypo 4h/Reox 3h组比较,**P < 0.01 图 4 XNJI组分处理Hypo 4 h/Reox 3 h胶质细胞条件培养液对缺氧6 h神经元活力的影响 Fig. 4 Astrocyte-conditioned medium treated by XNJI component under Hypo 4 h/Reox 3 h attenuates hypoxia 6 h neurons cell viability |
胶质细胞在脑组织损伤或缺血时发生激活等一系列形态和功能的变化[7]。提高胶质细胞内cAMP浓度能够诱导星形胶质细胞的形态变化,常用作星形胶质细胞形态分化激活的研究模型,如在大鼠原代培养的星形胶质细胞和神经胶质瘤细胞,cAMP作用24 h后能够引起细胞形态发生变化[11]。反应性星形胶质细胞的增多可能是为了满足星形胶质细胞代谢活动的增加,星形胶质细胞对腺苷与谷氨酸的代谢调节被认为是中枢神经系统中兴奋性产生与传播的重要环节,在神经元损伤后的修复保护中有重要意义[12]。因此,课题选用环磷酸腺苷诱导胶质细胞活化同时缺氧复氧进行造模,研究表明,实验所采用模型对缺氧复氧后胶质细胞胞外高浓度谷氨酸的清除能力是显著下降的,与Gouix等[13]的研究相吻合。
中枢神经系统中存在着谷氨酸、谷氨酰胺循环,通过合成、释放、回收发挥作用。谷氨酸经星形胶质细胞的转运摄取到胞内,在谷氨酰胺合成酶的作用下合成谷氨酰胺,通过转运蛋白转运到神经元发挥作用,之后通过磷酸化激活的谷氨酰胺脱氨基作用又转变为谷氨酸,继续参与循环[14-16]。生理状态下谷氨酸作为信号传导物质,必须保持在一个低浓度水平,在信号传导中迅速上升,随后又恢复为较低浓度终止信号传导。脑中风病理状态下,谷氨酸浓度异常升高可导致神经元过度兴奋,引起神经元产生谷氨酸的兴奋毒性[8]。近期研究表明作为膳食补充剂的α-硫辛酸(LA)能增加C6星形胶质细胞株谷氨酸摄取、谷氨酰胺合成酶活性和谷胱甘肽含量[17];研究发现采用dBcAMP和TNF-α处理胶质细胞,并用抑肝散处理,星形胶质细胞中GLT-1的谷氨酸转运功能增强[18]。本研究也用dBcAMP对胶质细胞进行活化,研究发现,XNJI中有效成分β-榄香烯、吉马酮、龙脑、冰片可以提高缺氧复氧胶质细胞对胞外谷氨酸的清除能力,其条件培养液培养缺氧神经元,同时,醒脑静的有效成分吉马酮,龙脑、冰片对缺氧后的神经元活力有提高作用,但研究中条件培养液提高神经元活力的深入机制还有待进一步探讨。
综之,XNJI组分能促进缺氧复氧胶质细胞对谷氨酸的清除并提高神经元活力。
| [1] |
廉全荣, 董华丽. 醒脑静注射液治疗急性脑梗死临床观察[J]. 中国中医急症, 2010, 19(3): 430-431. DOI:10.3969/j.issn.1004-745X.2010.03.038 |
| [2] |
孙蓉媚. 醒脑静注射液治疗脑梗塞132例——附虚实两证疗效分析[J]. 浙江中医杂志, 2002, 47(9): 43. |
| [3] |
李红琴.醒脑静择时治疗大面积脑梗死的临床观察[D].武汉: 湖北中医药大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10507-1012253069.htm
|
| [4] |
李春艳, 刘晓明, 高善语, 等. 醒脑静对急性脑梗死的血管炎性反应干预[J]. 菏泽医学专科学校学报, 2014, 26(4): 77-78, 93. DOI:10.3969/j.issn.1008-4118.2014.04.34 |
| [5] |
张国妮, 徐耀琳. 醒脑静注射液对急性脑出血患者神经功能恢复的影响[J]. 中国民间疗法, 2017, 25(1): 53-54. |
| [6] |
韩斌.醒脑静对OGD损伤后血管内皮细胞生存活性的影响及炎性反应抑制机制的体外研究[D].长春: 吉林大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10183-1013194465.htm
|
| [7] |
宿宝贵, 郑发武, 吕来清, 等. 电针对脑梗塞大鼠缺血半影区星形胶质细胞形态的影响[J]. 中国病理生理杂志, 2007, 23(10): 1964-1967. DOI:10.3321/j.issn:1000-4718.2007.10.022 |
| [8] |
张敏, 李文斌, 王彦华. 胶质细胞谷氨酸转运体及其在脑缺血和脑缺血预适应中的变化[J]. 生命科学, 2010, 23(5): 431-436. |
| [9] |
邱永明.缺血后处理对全脑缺血大鼠海马GLT-1和GS表达的影响及意义[D].上海: 上海交通大学, 2011. http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_Y2031417
|
| [10] |
张欢欢, 刘寒, 何林, 等. 星形胶质细胞对脑缺血后神经元保护机制的研究进展[J]. 山东医药, 2017, 57(36): 97-99. DOI:10.3969/j.issn.1002-266X.2017.36.033 |
| [11] |
Haghighat N, McCandless DW, Geraminegad P. Responses in primary astrocytes and C6-glioma cells to ammonium chloride and dibutyryl cyclic-AMP[J]. Neurochemical Research, 2000, 25(2): 277-284. DOI:10.1023/A:1007535922977 |
| [12] |
陈宇亮.星形胶质细胞中腺苷和谷氨酸代谢在中枢神经系统氧中毒中的作用研究[D].上海: 第二军医大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-90030-1015518416.htm
|
| [13] |
Gouix E, Buisson A, Nieoullon A, et al. Oxygen glucose deprivation-induced astrocyte dysfunction provokes neuronal death through oxidative stress[J]. Pharmacology Research, 2014(87): 8-17. |
| [14] |
杨晓运, 李智, 秦绿叶, 等. 星形胶质细胞和神经元之间谷氨酸-谷氨酰胺的代谢偶联[J]. 生理科学进展, 2003, 34(4): 350-352. DOI:10.3321/j.issn:0559-7765.2003.04.015 |
| [15] |
康文博, 张赛, 梁海乾. 星形胶质细胞转分化为神经元的研究进展[J]. 天津医药, 2015, 56(6): 694-697. |
| [16] |
闫荣, 罗晓光, 张尧, 等. 星形胶质细胞条件培养液诱导骨髓基质细胞向神经元样细胞分化的神经营养机制探讨[J]. 中国医科大学学报, 2013, 63(8): 714-721. DOI:10.3969/j.issn.0258-4646.2013.08.011 |
| [17] |
Kleinkauf-Rocha J, Bobermin LD, Machado Pde M, et al. Lipoic acid increases glutamate uptake, glutamine synthetase activity and glutathione content in C6 astrocyte cell line[J]. International Journal of Developmental Neuroscience, 2013, 31(3): 165-170. DOI:10.1016/j.ijdevneu.2012.12.006 |
| [18] |
Ueki T, Kawakami Z, Kanno H, et al. Yokukansan, a traditional japanese medicine, enhances the glutamate transporter GLT-1 function in cultured rat cortical astrocytes[J]. Evidence-Based Complementary and Alternative Medicine:eCAM, 2018(2018): 6804017. |
2. Tianjin Key Laboratory of Chinese Medicine Pharmacology, Tianjin 301617, China;
3. Institute of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2019, Vol. 36
2019, Vol. 36