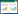文章信息
- 秦越, 庞宗然
- QIN Yue, PANG Zongran
- 洛罗兰糖苷激活Bcl-2通路诱导髓样抑制性细胞凋亡研究
- Study on loroglossin induced myeloid derived suppressor cells apoptosis via activating the Bcl-2 signaling pathway
- 天津中医药, 2019, 36(3): 288-291
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(3): 288-291
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.03.20
-
文章历史
- 收稿日期: 2018-12-10
洛罗兰糖苷是从民族药盘龙参中分离提取的,目前对于洛罗兰糖苷的研究还很少。但盘龙参作为民间的一种疗效极佳的抗癌中草药已经受到越来越多的关注。盘龙参为兰科绶草属,以根或全草入药,味甘,性温,入肺、肝、肾三经。《湖南药物志》记载,盘龙参可“止虚热口渴,肺瘤咳血”,由于其分布广泛,还被藏医,蒙医使用[1]。在藏药中,盘龙参主要用于强身健体,养气生精,但是在效能上弱于手参。也有一些民间古方将其作为治疗糖尿病的药物应用。现代医学研究证实,盘龙参对S180肉瘤,A549肺癌细胞、BEL7402肝癌细胞、HT-29食管癌细胞、MCF-7乳腺癌细胞、SGC-7901胃癌细胞、K562白血病细胞和A498肾癌细胞都有一定毒性,具有明显的抗肿瘤效果[2-5],但其具体机制尚未明确,对其化学组分分离,药理、毒理方面的探索都处于相对初级的阶段。
髓样抑制性细胞(MDSCs)是骨髓细胞谱系的固有部分,包括某些肿瘤相关巨噬细胞,是树突状细胞、巨噬细胞和粒细胞的前体,主要存在与肿瘤微环境中,通常被描述为CD14-CD11b+细胞群,表达CD33和CD15(在小鼠中被标记为Gr1+CD11b+),具有免疫负调控的作用。MDSCs可以抑制T细胞增殖,调节巨噬细胞产生细胞因子,参与肿瘤血管生产与癌细胞迁移等[6]。大量的临床数据显示,在结直肠癌、乳腺癌、非小细胞肺癌等癌症病例中,外周血MDSCs的数值与癌症的发展阶段密切相关[7]。同时,在癌旁组织中,MDSCs的存在也影响着肿瘤治疗的效果,例如,乳腺癌患者的化疗反应及肝癌的放射治疗结果都与MDSCs的浸润程度呈现负相关[8]。因此,靶向MDSCs可能成为肿瘤治疗的一个有效途径。
因此,本课题通过对洛罗兰糖苷作用后MDSCs的增殖、凋亡、蛋白表达几个方面的研究,从改善肿瘤微环境的角度去探求洛罗兰糖苷的药用价值及其抗肿瘤机制。
1 材料与方法 1.1 材料 1.1.1 材料MDSCs细胞系中永生化的细胞MSC-2(获赠于Francois Ghirnghelli,肿瘤内科);洛罗兰糖苷粉末(民族医药教育部重点实验室前期提取);DMEM培养基。
1.1.2 仪器细胞计数板(中国博大博聚科技有限公司),流式细胞仪(美国BD公司),GUAVA微毛细管细胞分析仪(美国BD公司)。
1.2 方法 1.2.1 DMEM+/+培养基的配置DMEM+/+培养基购自Invitrogen公司。取DMEM+/+培养基加入10%的新生牛血清,以及100 U/mL的双抗(链霉素和青霉素)。
1.2.2 磷酸盐缓冲液(PBS)的配制所配制的1×PBS缓冲液中含有:NaCl 8 g,KCl 0.2 g,Na2HPO4·12H2O 3.63 g,KH2PO4 0.24 g和1 000 mL超纯水。
1.2.3 洛罗兰糖苷母液的制备取洛罗兰糖苷粉末加入DMEM+/+培养基,震荡均匀得到浓度为10 mg/mL的悬液,在细胞间内再0.22 μm滤器过滤,得到无菌洛罗兰糖苷母液。
1.2.4 MSC-2细胞培养将水浴锅调至37 ℃,在离心管加入3 mL培养基,在培养瓶内加入10 mL培养基。取出冻存细胞快速放入水浴锅中,待细胞融化后,用纸巾拭去管壁周围的水份,在超净工作台内打开,将细胞转入离心管。离心,1 200 rpm,3 min。弃上清,弹起细胞,将细胞均匀接种入培养瓶内,37 ℃,5% CO2培养箱进行培养。
1.2.5 MTT法检测洛罗兰糖苷抑制MSC-2细胞效果实验设对照组和实验组,每组设6个复孔。MSC2细胞接种于96孔板,细胞密度为5×104个/孔。实验组中加入洛罗兰糖苷,浓度分别为0、0.3、0.6和1.2 mg/mL;对照组加入等体积的DEME+/+培养基。边孔中加入1×PBS 200 μL以防止边缘效应。放入37 ℃,5%CO2细胞培养箱中培养24 h后取出,每孔避光加入MTT试剂10 μL后放回细胞培养箱中培养。培养4 h后取出,加入三联溶解液(10%SDS,5%异丁醇,0.012 mol/L HCL,蒸馏水溶解)溶解6 h后,用酶标仪(美国BIO-RAD Laboratories,Philadelphia,PA)测量570 nm处吸光度。
1.2.6 流式细胞学分析MSC-2细胞接种于96孔板,细胞密度为5×104/孔,加入洛罗兰糖苷,终浓度为0.6 mg/mL。阴性对照每孔加入等体积的DMEM+/+培养基至终体积100 μL/孔。37 ℃细胞培养箱培养1 d。适当力度吹打细胞后吸出液体,分别注入1.5 mL离心管,离心(4 000 r/min,4 ℃)5 min。去上清,加入含2% NCS的PBS 50 μL,依比例加入流式染料,抗体为FITC-AnnexiV和7AAD,冰上放置,抗体染色30min(7AAD最后染5 min)后,离心(4 000 r/min,4 ℃)5 min,沉淀用200 mL含2% NCS的PBS重悬,将细胞悬液转移至流式管,上机检测,流式细胞仪为FACScan flow cytometer(美国BD Calibur),采用Flowjo 7.6进行结果分析。
1.2.7 Western Blotting检测MSC-2细胞经过洛罗兰糖苷处理后,用RIPA细胞裂解液进行裂解,置冰中40 min后,先各取1 μL蛋白待测,再加入4×Loading Buffer,100 ℃加热10 min后放入-80 ℃冷藏。将待测蛋白稀释至50 μL,并配置BSA及AB液,60 ℃放置15 min后用酶标仪测量562 nm处吸光值。测得数值代入公式计算蛋白上样量。
配置10%和12%凝胶电泳分离胶,放入加好电泳液的电泳仪中,按量向两胶中加入蛋白,并在两侧加入5 μL Marker Ⅲ,80 V恒压电泳置溴酚蓝跑出。取出胶体转膜,100 V恒压电泳70 min后将10%胶转得膜中目标蛋白相应位置所在条带剪下。用3%BSA封闭1 h,后分别按比例配置、加入目标蛋白的相关一抗,80 min后洗5×5 min,再加入目标蛋白对应二抗。60 min后洗5×5 min,取出条带,加入显影液后进行置于曝光仪中进行曝光。
1.2.8 统计学分析统计分析使用Graphpad prism 5软件,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析检验,组间两两比较若方差齐采用LSD法,若方差不齐采用Dunnett’s T3法,P < 0.05为差异有统计学意义。
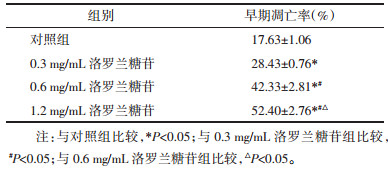
2 结果 2.1 洛罗兰糖苷对MSC-2的毒性作用将MSC-2细胞用不同浓度的洛罗兰糖苷处理24 h。当浓度为0.3~1.2 mg/mL时,洛罗兰糖苷对MSC-2具有明显的抑制作用(P < 0.01),且呈现剂量-效应关系。RAW为小鼠来源的巨噬细胞系,MTT结果显示,此浓度范围内,洛罗兰糖苷对RAW细胞无毒性作用。见表 1,图 1。
|

|
| 图 1 洛罗兰糖苷对MSC-2细胞活性有抑制作用 Fig. 1 Loroglossin suppressed proliferation of MSC-2 cells |
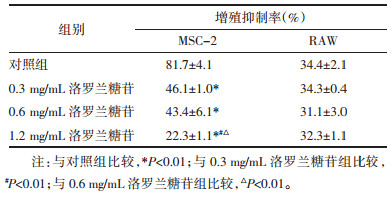
MTT结果显示,洛罗兰糖苷作用下,MSC-2细胞的数量减少。为进一步确定药物的影响,用不同浓度(0、0.3、0.6、1.2 mg/mL)处理24 h,然后用Annexin V-FITC/PI进行双重染色,并进行流式细胞分析。结果表明,早期凋亡细胞百分比由14.7%上升至52.2%。见图 2。统计分析显示,洛罗兰糖苷可促进MDSCs的凋亡,且呈剂量依赖性。见表 2。
|
| 图 2 洛罗兰糖苷诱导MSC-2细胞凋亡 Fig. 2 Loroglossin induced apoptosis of MSC-2 cells |
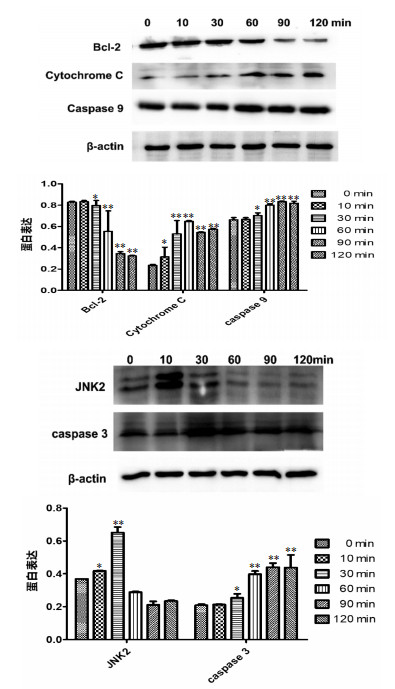
为明确洛罗兰糖苷促进MSC-2细胞凋亡的具体机制,用洛罗兰糖苷(0.6mg/ml)刺激MSC-2细胞,于不同时间段内提取蛋白,Western blot结果显示,JNK2、细胞色素C、caspase-9、caspase-3表达明显上调,而Bcl-2表达下降。因此,洛罗兰糖苷通过Bcl-2信号通路诱导MSC-2细胞凋亡。见图 3。
|
| 与0 min组比较,*P < 0.05;** P < 0.01。 图 3 洛罗兰糖苷对Bcl-2、cytochrome C、Caspase 9、JNK2及Caspase 3蛋白表达水平的影响 Fig. 3 Effect of loroglossin on the expression of Bcl-2, Cytochrome C, Caspase 9, JNK2 and Caspase 3 protein |
在肿瘤微环境中,髓样抑制性细胞的功能主要表现为抑制CD8+T细胞的活化及杀伤肿瘤细胞的功能从而促进肿瘤的生长。另外,髓样抑制性细胞还可通过下调穿孔素和IFN-γ的表达来抑制自然杀伤细胞的细胞毒活性,抑制树突状细胞、巨噬细胞的分化而下调抗免疫应答[9]。实验表明,应用GR1单克隆抗体去除体内髓样抑制性细胞可以增强荷瘤小鼠的免疫反应,表现出对多种肿瘤的排斥反应[10]。因此,以髓样抑制性细胞为靶点的针对性药物研发对肿瘤免疫治疗的发展具有非常诱人的前景。
本实验室前期研究从中草药盘龙参中分离提取到一种苷类化合物洛罗兰糖苷。目前,洛罗兰糖苷的相关研究文献很少,因此,本课题中笔者首先对洛罗兰糖苷的细胞毒性进行筛选,结果显示,洛罗兰糖苷可以特异性的杀伤髓样抑制性细胞。同时,细胞凋亡标记检测显示,洛罗兰糖苷对髓样抑制性细胞的杀伤性主要表现为诱导细胞凋亡。对其凋亡机制的探究表明,洛罗兰糖苷可以下调Bcl-2的表达,上调JNK2、细胞色素C、Caspase-9及Caspase-3的表达。
细胞凋亡可分为内源性凋亡和外源性凋亡两种途径[11]。外源性凋亡是由膜上受体介导的凋亡,通常这些受体的配体为TNF-α、TRAIL和Fas-L等。内源性凋亡是通过线粒体的凋亡途径,其受到Bcl-2家族的严格控制。洛罗兰糖苷处理后,JNK2的表达上调抑制了Bcl-2的表达,从而释放更多的细胞色素C。细胞色素C的大量释放可以激活下游的Caspase家族,进而促进细胞凋亡。
综上,洛罗兰糖苷通过激活Bcl-2信号通路诱导髓样抑制性细胞凋亡,增强肿瘤微环境中的免疫调控,从而具有一定的抗肿瘤作用。
| [1] |
照日格图, 萨仁格日乐. 蒙药旺拉嘎的本草考证[J]. 中药材, 2005, 28(4): 345-346. DOI:10.3321/j.issn:1001-4454.2005.04.037 |
| [2] |
Tezuka Y, Ueda M, Kikuchi T, et al. Studies on the constituents of Orchidaceous Plants. Ⅷ. Constituents of Spiranthes sinensis (PERS.) AMES var.Amoena(M.BIEBERSON) HARA. Isolati-on and Structure of Spiranthol-A, Spiranthol-B, and Spiranthol A, New Isopentenyldihydrophen-anthrenes[J]. Chem. Pharm. Bull, 1989, 37(12): 3195-3199. DOI:10.1248/cpb.37.3195 |
| [3] |
李文丽. 盘龙参抗S-(180)肉瘤的实验观察[J]. 数理医药学杂志, 2005, 18(3): 193-195. DOI:10.3969/j.issn.1004-4337.2005.03.001 |
| [4] |
Peng JY, Xu QW, Xu YW, et al. A new anticancer dihydro flavanoid from the root of Spiranthes australis (R.Brown) Lindl[J]. Natural Product Research, 2007, 21(7): 641-645. DOI:10.1080/14786410701371165 |
| [5] |
Lin Y, Huang R, Don M, et al. Dihydrophenanthrenes from Spiranthes sinensis[J]. Journal of natural products, 2000, 12(63): 1608-1610. |
| [6] |
Kumar V, Patel S, Tcyganov E, et al. The Nature of Myeloid-Derived Suppressor Cells in the Tumor Microenvironment[J]. Trends Immunol, 2016, 37: 208-220. DOI:10.1016/j.it.2016.01.004 |
| [7] |
Filippo Veglia, Michela Perego, Dmitry Gabrilovich. Myeloid-derived suppressor cells coming of age[J]. Nature Immunology, 2018, 19(2): 108-119. |
| [8] |
Angell T. Circulating myeloid-derived suppressor cells predict differentiated thyroid cancer diagnosis and extent[J]. Thyroid, 2016, 26(3): 381-389. DOI:10.1089/thy.2015.0289 |
| [9] |
Gabrilovich DI, Bronte V, Chen SH, et al. The terminology issue for myeloid-derived suppressor cells[J]. Cancer Research, 2007, 67(1): 425-426. |
| [10] |
Yang L, DeBusk LM, Fukuda K, et al. Expansion of myeloid immune suppressor Gr+CD11b+ cells in tumor-bearing host directly promotes tumor angiogenesis[J]. Cancer Cell, 2004, 6(4): 409-421. DOI:10.1016/j.ccr.2004.08.031 |
| [11] |
Bratton S, Salvesen G. Regulation of the Apaf-1-caspase-9 apoptosome[J]. J Cell Sci, 2010, 123(Pt 19): 3209-3214. |
 2019, Vol. 36
2019, Vol. 36