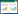文章信息
- 瞿娟娟, 王双宇, 张超, 徐海发, 陈惠敏, 周少英, 韩亚非, 王朝宗, 余婷
- QU Juanjuan, WANG Shuangyu, ZHANG Chao, XU Haifa, CHEN Huimin, ZHOU Shaoying, HAN Yafei, WANG Chaozong, YU Ting
- 苦参素对局灶性脑缺血再灌注大鼠血液流变学的影响及机制探讨
- Effects of oxymatrine on hemorheology after focal cerebral ischemia-reperfusion in rats and its mechanism
- 天津中医药, 2019, 36(3): 292-295
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(3): 292-295
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.03.21
-
文章历史
- 收稿日期: 2018-11-12
2. 邯郸市中心医院肾内一科, 邯郸 056001;
3. 邯郸市中医院内科, 邯郸 056001
随着人口老龄化的加剧,缺血性脑血管病已逐渐发展成为致残和死亡的主要疾病之一,尽快通过药物溶栓或介入治疗以恢复血流再灌注是挽救患者生命、降低血栓后遗症的首要治疗方案,但缺血再灌注并发症的存在却严重影响着其治疗效果。缺血再灌注损伤病理机制非常复杂,其中血液流变性指标改变是其重要的病理机制之一[1-2]。苦参素(OMT)为传统中药品种苦参的主要有效成分之一,既往研究发现OMT能够通过抑制继发性神经细胞凋亡、抑制炎症反应等而对局灶性脑缺血再灌注损伤起到一定的保护作用[3-4],但关于OMT能否改善脑缺血再灌注后血液流变学改变的文献报道尚不多见,本研究将通过大鼠实验研究OMT对脑缺血再灌注后血液流变学指标的影响并探讨其可能的作用机制。
1 材料与方法 1.1 实验动物实验用SD大鼠(雌雄不限)购自河北医科大学实验动物中心[SCXK(冀)2013-1-003],适应性饲养1周后进行实验。
1.2 药物与试剂OMT购自南京泽朗医药科技有限公司(批号:20170114);苏木精-伊红(HE)试剂盒购自北京博奥森生物技术有限公司(批号:161209);2,3,5-氯化三苯基四氮唑(TTC)购自上海化学试剂公司(批号:161209);超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)试剂盒购自南京建成生物工程研究所(批号:20170309、20170413、20170114)。
1.3 实验方法 1.3.1 分组与模型制备取140只实验用大鼠按照随机数字表法随机分为假手术组、模型组和OMT低[25 mg/(kg·d)]、中[50 mg/(kg·d)]、高[100 mg/(kg·d)]剂量组,每组28只。通过线栓法阻断大脑中动脉制备局灶性脑缺血再灌注大鼠模型,假手术组行手术操作但不插入栓线。术后第2天开始腹腔注射给药治疗(1次/d),疗程7 d[8]。
1.3.2 神经功能评分采用10分制盲法评分:置地上,向缺血对侧转圈,计1分;提鼠尾,缺血对侧前肢腕屈曲计1分、肘屈曲计2分、肩内旋计3分;对侧推动时阻力下降,据下降程度计1~3分;置金属网上,据缺血对侧肌张力下降程度计1~3分。
1.3.3 脑组织含水量和梗死体积每组随机选取6只大鼠,深度麻醉后断头并剥取脑组织,去除小脑和低位脑干后称重大脑组织质量(W),110 ℃恒温烘烤48 h后称质量(D),脑组织含水量计算公式:脑含水量(%)=[(W-D)/W]×100%。每组另随机取6只大鼠,深度麻醉后断头取脑,置于-20 ℃冷冻15 min后沿冠状切片(厚度约2 mm),于2%的TTC染色液中避光孵育0.5 h(梗死区呈苍白色),运用图像分析软件计算大脑组织梗死百分比。
1.3.4 脑组织海马CA1区神经元形态结构各组随机取6只大鼠,参照1.3.3方法取大脑、多聚甲醛溶液(浓度4%)固定3 d、石蜡包埋、切片、脱蜡水化,然后行常规HE染色,封片后通过显微镜观察脑组织海马CA1区神经元形态结构。
1.3.5 抗氧化酶活性和MDA含量各组取剩余10只大鼠,参照1.3.3方法取大鼠大脑并剥取海马组织,研磨匀浆、3 000 rpm离心10 min取上清液,遵照试剂盒步骤处理后通过紫外-可见分光光度计测定抗氧化酶(SOD、CAT)活性和MDA含量。
1.3.6 血液流变学指标及红细胞膜流动性指标于1.3.5断头取脑前,开腹并经腹主动脉取血,做抗凝处理,用R-80锥板型血液流变检测仪测定全血黏度(低切、中切、高切)和血浆黏度,计算红细胞聚集指数、红细胞变性指数、红细胞刚性指数、红细胞压积,测定血沉;测定红细胞膜流动性指标:荧光偏振度、平均微黏度、各向异性。
1.4 统计学处理运用软件SPSS 19.0进行统计分析,计量资料以均数±标准差(x±s)表示,多组间均数比较采用单因素方差分析,组间比较采用LSD-t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 OMT对局灶性脑缺血再灌注大鼠神经功能评分、脑组织含水量及梗死体积的影响与假手术组比较,模型组大鼠神经功能评分、脑组织含水量和梗死体积均显著升高(P < 0.01);与模型组比较,OMT中、高剂量组大鼠神经功能评分、脑组织含水量和梗死体积显著降低(P < 0.05或P < 0.01)。见表 1。

|
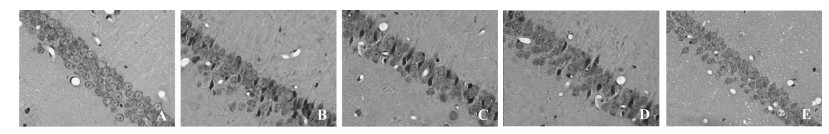
假手术组大鼠海马CA1区神经元层次清晰,排列整齐,形态完整,核膜、核仁清晰,形态结构未见异常;模型组大鼠海马CA1区神经元呈现层次紊乱,排列稀疏、间隙增大、数量减少,胞体肿胀变形,胞核固缩或溶解等形态结构病理性改变;与模型组比较,OMT各剂量组海马CA1区神经元病理性形态结构改变呈不同程度改善,该效果以OMT高剂量组最为显著。见图 1。
|
| A.假手术组;B.模型组;C.OMT低剂量组;D.OMT中剂量组;E.OMT高剂量组 图 1 各组大鼠大脑海马CA1区神经元形态结构(HE,×400) Fig. 1 Morphological structure of neurons in hippocampal CA1 region of rats in each group (HE, ×400) |
与假手术组比较,模型组大鼠海马组织抗氧化酶(SOD、CAT)活性显著降低且MDA含量显著升高(P < 0.01);与模型组比较,OMT中、高剂量组大鼠海马组织SOD、CAT活性显著提高且MDA含量显著降低(P < 0.05或P < 0.01)。见表 2。
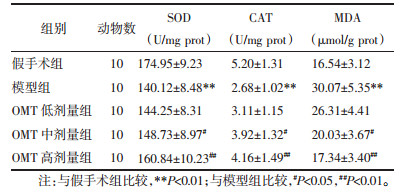
|
与假手术组比较,模型组大鼠全血黏度低、中、高切均显著升高(P < 0.05),血浆黏度显著升高(P < 0.01)。与模型组比较,OMT中、高剂量组大鼠全血黏度低、中、高切及血浆黏度均显著降低(P < 0.05或P < 0.01)。结果见表 3。
与假手术组比较,模型组大鼠红细胞聚集指数、刚性指数均显著升高(P < 0.05),红细胞变形指数显著降低(P < 0.01);与模型组比较,OMT中、高剂量组大鼠红细胞聚集指数、刚性指数并显著升高红细胞变形指数均显著降低(P < 0.05或P < 0.01)。见表 4。
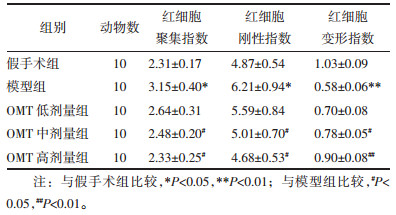
|
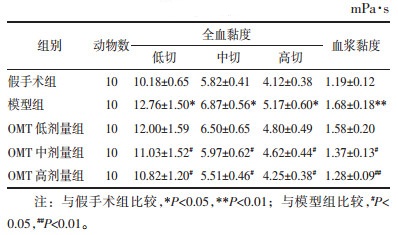
与假手术组比较,模型组大鼠红细胞压积、血沉显著升高(P < 0.05或P < 0.01);与模型组比较,OMT中、高剂量组大鼠红细胞压积和血沉均显著降低(P < 0.05或P < 0.01)。见表 5。
缺血再灌注损伤并发症严重影响缺血性脑病患者治疗效果,其病理机制非常复杂,既往病理研究发现急性缺血性脑病患者血液血液黏度增高,呈浓、黏、凝、聚状态[5-6],血液流变学指标均显著高于正常对照组,表现出红细胞变形能力下降、聚集程度升高以及血液黏度提高等指标变化[7],血液高凝状态将导致局部血液微循环持续恶化,进而诱发神经细胞继发性凋亡[2, 8],为缺血再灌注损伤的重要病理机制之一。因此,通过改善血液流变学以预防梗死灶进一步扩大和二次脑梗或许是提高急性缺血性脑病患者临床疗效有效方案。
苦参(Sophora flavescens Ait.)味苦、性寒,具有清热燥湿、利水退黄、祛风杀虫之功效。OMT是苦参的主要有效成分之一,具有抗炎、抗细胞凋亡等多种生物学活性[8-9]以及扩张血管、改善微循环等药理学作用[11],但OMT是否能够改善脑缺血再灌注后血液流变学指标而起到一定保护作用的研究报道尚不多见。实验通过制备局灶性脑缺血再灌注大鼠模型并腹腔注射给予苦参素进行干预,发现经OMT 50~100 mg/(kg·d)治疗能够有效降低脑缺血再灌注大鼠神经功能评分、改善神经功能症状,降低脑组织含水量,降低脑组织梗死体积,抑制脑组织海马CA1区病变,改善海马CA1区抗氧化酶活性(SOD、CAT)并降低MDA含量[12-13]、降低氧化应激损伤,提示OMT对脑缺血再灌注损伤具有一定的保护作用。本实验研究发现,经OMT干预治疗能够显著降低脑缺血再灌注大鼠全血低切黏度、全血中切黏度、全血高切黏度以及血浆黏度,降低红细胞聚集指数、刚性指数并提高红细胞变性指数,减低红细胞压积和血沉,提示OMT具有改善脑缺血再灌注损伤大鼠血液流变学、改善血液高凝状态、改善局部微循环的作用。
总之,OMT可能通过改善血液流变学而对脑缺血再灌注损伤起到一定的保护作用。
| [1] |
曾聪彦, 胡莹, 高玉桥, 等. 熄风通脑胶囊对局灶性脑缺血再灌注大鼠血液流变学的影响[J]. 中成药, 2015, 37(9): 2037-2040. |
| [2] |
艾宗耀, 易燕锋, 肖梅红, 等. 活血通络解毒方对脑缺血Wistar大鼠血液流变学的影响[J]. 中国中医急症, 2016, 25(7): 1288-1289. DOI:10.3969/j.issn.1004-745X.2016.07.007 |
| [3] |
付燕燕, 段静雨, 宋远见. 氧化苦参碱对大鼠局灶性脑缺血再灌注后caspase-12表达的影响[J]. 山东医药, 2009, 49(47): 40-41. DOI:10.3969/j.issn.1002-266X.2009.47.016 |
| [4] |
吕文伟, 张晓璐, 刘芬, 等. 氧化苦参碱对大鼠局灶性脑缺血再灌注损伤的保护作用及其机制研究[J]. 中草药, 2008, 39(4): 579-582. DOI:10.3321/j.issn:0253-2670.2008.04.033 |
| [5] |
陈立杰, 金咏华, 梁庆成. 急性脑梗死患者凝血纤溶状态及血粘度检测的临床意义[J]. 中国微循环, 2002, 6(1): 40-41. |
| [6] |
魏巍. 浅谈脑梗死患者黏度及血脂改变[J]. 中国伤残医学, 2010, 18(4): 102-103. |
| [7] |
蒋翡翎, 邓碧兰, 韩永. 脑梗死患者血液流变学及血小板参数的变化及意义[J]. 山东医药, 2012, 50(20): 58-59. |
| [8] |
王键, 谭辉, 菅威, 等. 脑络欣通对局灶性脑缺血一再灌注大鼠血液流变学及相关调节因子的作用[J]. 中国脑血管病杂志, 2012, 9(11): 590-591. DOI:10.3969/j.issn.1672-5921.2012.11.008 |
| [9] |
黄秀梅, 李波, 等. 氧化苦参碱对TNFA、IL-6和IL-8的影响[J]. 中成药, 2003, 25(11): 903-906. DOI:10.3969/j.issn.1001-1528.2003.11.015 |
| [10] |
孔秀岩, 苏志刚. 氧化苦参碱对细胞凋亡影响的研究现状[J]. 河北医药, 2007, 29(12): 1371-1373. DOI:10.3969/j.issn.1002-7386.2007.12.055 |
| [11] |
王雪芬, 王磊, 陈树杰. 苦参素对大鼠心肌缺血再灌注损伤的保护作用及其机制研究[J]. 中国中医急症, 2016, 25(6): 988-992. DOI:10.3969/j.issn.1004-745X.2016.06.013 |
| [12] |
Lartigue A, Burlat B, Coutard B, et al. The Megavirus chilensis Cu, Zn-superoxide dismutase:the first viral structure of a typical cellular copper chaperone-independent hyperstable dimeric enzyme[J]. J Virol, 2015, 89(1): 824-832. DOI:10.1128/JVI.02588-14 |
| [13] |
Kwiecien S, Magierowska K, Magierowski M, et al. Role of sensory afferent nerves, lipid peroxidation and antioxidative enzymes in the carbon monoxide-induced gastroprotection against stress ulcerogenesis[J]. J Physiol Pharmacol, 2016, 67(5): 717-729. |
2. Department of No.1 Nephrology, Handan Central Hospital, Handan 056001, China;
3. Handan Traditional Chinese Medicine, Handan 056001, China
 2019, Vol. 36
2019, Vol. 36