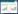文章信息
- 徐磊, 张丽萍, 宋瑞雯, 陈颖
- XU Lei, ZHANG Liping, SONG Ruiwen, CHEN Ying
- 加味温胆汤对抑郁模型大鼠胃肠动力的影响
- Effect of modified Wendan Decoction on gastrointestinal motility in rat with depression
- 天津中医药, 2019, 36(4): 387-391
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(4): 387-391
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.04.19
-
文章历史
- 收稿日期: 2018-12-15
抑郁症是一种以显著而持久的心境低落为主要临床特征的情感性精神障碍,临床常伴有纳差、胃痛胃胀、嗳气反酸、恶心呕吐、腹痛腹胀、腹泻或便秘等胃肠功能紊乱症状,且抑郁情绪与胃肠动力障碍症状相互影响,使该病反复发作、缠绵难愈,已成为严重威胁人类健康的一种疾病。抑郁症可能与患者长期遭遇到的各种各样的精神和社会因素等慢性应激有关[1]。研究表明[2],慢性身心应激模型大鼠具有食欲不振和饮食量减少等消化不良症状。本课题组前期临床实践证实:基于调理脾胃法的加味温胆汤治疗抑郁症疗效肯定,可明显改善患者抑郁情绪及纳呆、腹胀等胃肠动力障碍症状[3];相关实验研究提示:加味温胆汤能改善抑郁行为,其机制可能与调节抑郁大鼠中枢和局部神经肽神经肽Y(NPY)、P物质(SP)、生长激素抑制素(SS)、促肾上腺皮质激素释放激素(CRH)的含量有关[4-5]。本研究在前期研究工作的基础上,首次观察加味温胆汤对孤养结合慢性应激抑郁模型大鼠胃肠动力及胃肠组织超微结构的影响,以期进一步探讨加味温胆汤的抗抑郁作用机制。
1 材料与方法 1.1 实验材料 1.1.1 实验动物及分组选用8周龄SPF级SD健康大鼠[动物合格证号:SCXK(军)2017-0001],雌雄各半,体质量180~200 g,造模前进行旷场实验,筛选行为学评分相近的大鼠,编号,按随机数字表随机分为3组,每组12只,即:空白对照组、模型组、加味温胆汤组。除正常组外,其余组采用目前国际公认的孤养结合慢性不可预见性温和应激方法复制抑郁大鼠模型。
1.1.2 药物中药复方加味温胆汤(半夏、橘皮、枳实、竹茹、茯苓、石菖蒲、合欢花、生姜、甘草等)购于北京同仁堂天津南开大药房有限公司,选用优质药材,经中药植化室鉴定后,水煎浓缩为1.5 g/mL,置4 ℃冰箱内备用。
1.1.3 主要仪器旷场实验系统:包括旷场实验箱(自制长100 cm、宽100 cm、高40 cm旷场实验箱,用墨水将自制旷场实验箱内部刷黑,在底部用白色油漆笔画成面积相等的25个正方形)、摄像机、笔记本电脑、超薄切片机(徕卡UC-7)、透射电子显微镜(H-7500,日本日立)。
1.1.4 主要试剂3%多聚甲醛、4 ℃预冷1%戊二醛、37 ℃预热0.9%生理盐水、10%水合氯醛、4%戊二醛、输液器、琼脂糖粉、嗅乙锭、4%多聚甲醛、羧甲基纤维素钠、奶粉、糖、淀粉和活性炭末由赛东南试剂公司提供。1/15 mol/L磷酸缓冲液、1%四氧化锇、丙酮、包埋液、醋酸双氧铀、柠檬酸铅由河北医科大学电镜实验中心提供。
1.1.5 特殊试剂配制制备营养性半固体糊:参照文献[6],取10 g羧甲基纤维素钠,溶于250 mL蒸馏水中,分别加入奶粉16 g,糖8 g,淀粉8 g和活性炭末2 g,搅拌均匀。配制成300 mL约300 g的黑色半固体糊状物。冰箱冷藏,用时恢复至室温。本实验营养性半固体糊,营养结构接近日常食物,能更接近反映药物对胃排空生理机能的影响;在营养性半固体糊中加入炭末,可同时观察药物对胃、肠运动的影响,节省实验动物。
透射电镜固定液:选用4%戊二醛固定液。戊二醛固定液需用1/15 mol/L磷酸缓冲液配制。磷酸缓冲液的配制方法:A液:磷酸二氢钾1.816 g溶于200 mL双蒸水;B液:Na2HPO4·12H2O 5.5 g溶于200 mL双蒸水。4%戊二醛固定液配制(pH7.2~7.4):A液:11 mL,B液:55 mL,50%戊二醛原液:6 mL。新鲜配制,4 ℃冰箱保存。出现混浊、絮状物沉淀或pH不准确时不能使用。
1.2 实验方法 1.2.1 给药处理空白组每日正常进水、进食,模型组、加味温胆汤组连续3周造模成功后,其他各组开始给药(相当于70 kg成人等效量),模型组胃饲生理盐水2 mL/(kg·d),每日早晨8:00开始,加味温胆汤组胃饲加味温胆汤12 g/(kg·d),连续给药4周。在造模成功后的给药期间,为防止模型大鼠抑郁状态出现消退,间断给予除空白组外其他各组慢性不可预见性温和刺激来维持其抑郁状态。
1.2.2 造模方法除空白组外,其他各组大鼠均采用分笼饲养方法,每笼1只,自分组之日起,模型组及加味温胆汤组接受21 d各种未预知的应激,包括24 h禁食、24 h禁水、通宵照明、4 ℃冷水游泳5 min、45 ℃烘箱热烘5 min、夹尾l min、高速水平振荡3 min、100 V电击足底l min、悬尾l min,共9种刺激,21 d内随机安排每日给予1种刺激,每种刺激出现2~3次,同一种刺激不能连续出现,使动物不能预知给予的刺激。
1.2.3 旷场实验以动物穿越旷场实验箱底面1个方块(四爪均进入方格方可计分)或原地旋转1周记为水平活动得1分;以直立次数为垂直活动得分,两前爪腾空或攀附墙壁均可计1分,计算水平活动得分与垂直得分总和。分别于造模前、造模21 d后及给药28 d后测定各组大鼠水平活动得分和垂直活动得分,每只鼠每次观察4 min,去掉之前1 min适应时间,读取后3 min数据,计算各组大鼠旷场实验总分,比较各组大鼠旷场实验得分变化趋势。
1.2.4 糖水偏好实验各组大鼠在造模前后及给药干预后进行糖水偏好实验。实验前先进行糖水适应,给予2瓶1%的蔗糖水24 h后,再给予1瓶1%的蔗糖水、1瓶纯水24 h,12 h时交换2瓶的位置,禁食禁水24 h,予1瓶1%的蔗糖水、1瓶纯水,2瓶位置随机放置,观察其在1 h内的糖水和纯水的消耗量,并排除饮水瓶滴漏所致的液体消耗量。糖水偏爱率=糖水消耗/总液体消耗×100%。
1.2.5 胃排空率检测各组大鼠胃动力实验开始时向胃中灌入营养性半固体糊,并记录灌胃量,灌胃结束20 min后处死动物,解剖取胃,将胃体称量并记录质量,沿胃大弯剪开、展平胃体,用生理盐水清洗胃内容物,然后用对其称量记为胃净质量,计算各组大鼠胃排空率。胃排空率的计算公式:胃排空率=[1-(胃全质量-胃净质量)/总灌胃量]×100%。
1.2.6 小肠推进率检测各组大鼠肠动力实验开始时向胃中灌入营养性半固体糊,灌胃20 min后处死动物,打开腹腔,分离出肠。用镊子轻轻提取上端至幽门、下端至回盲部的肠管,平铺于实验台上,轻轻将小肠拉成直线,用直尺测量小肠推进指标。量小肠全长(Ll)以及幽门至炭末所达最前端的长度(L2),计算各组大鼠小肠推进率。小肠推进率的计算公式:小肠推进率(%)=L2/L1×100%。
1.2.7 透射电镜检测各组大鼠胃肠组织的超微结构形态结构心脏灌流后,摘下整个胃部,沿胃大弯剖开,剪取胃底部胃壁全层大小为1 mm×1 mm×1 mm的组织标本2~3块;分离出结肠,自离盲肠端约2 cm处向上剪取结肠组织,剪取大小为1 mm×1 mm×1 mm的组织标本2~3块,于4%戊二醛中固定2~4 h以上,送电镜室固定。组织块完成固定后,采用1/15 mol/L磷酸缓冲液清洗15 min,清洗3次。1%四氧化锇进行后固定2 h,4 ℃冰箱保存。再次使用1/15 mol/L磷酸缓冲液清洗15 min,清洗3次。分别使用50%、70%、80%、90%、100%丙酮逐级脱水,每次各15 min,进行2次。100%丙酮与包埋液1:1的比例浸透1 h,100%丙酮与包埋液以1:3的比例过夜,纯包埋液5 h后,用包埋剂将样本包埋在包埋板里。置入烤箱聚合:37 ℃,24 h;60 ℃,48 h。用超薄切片机(徕卡UC-7)将样本切成厚约50 nm的超薄切片。醋酸双氧铀45 min、柠檬酸铅30 min进行电子染色。置于电镜下观察胃、肠组织神经元超微结构的变化。
1.3 统计学分析采用SPSS 22.0软件进行统计分析。数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较用SNK-q检验,以P < 0.05为差异有统计学意义。
2 实验结果 2.1 旷场实验造模前各组旷场实验得分无统计学差异(P>0.05);造模21 d后,模型组、加味温胆汤组得分低于空白组,差异有统计学意义(P < 0.01),说明造模成功;给药28 d后,模型组得分低于正常组,差异有统计学意义(P < 0.01),加味温胆汤组得分高于模型组,差异有统计学意义(P < 0.05),结果见表 1。
|
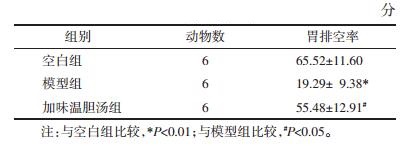
造模前各组大鼠糖水偏爱率差异均无统计学意义(P>0.05)。21 d慢性应激后,与空白组比较,其余2组糖水偏爱率显著降低(P<0.01),给药28 d后,与模型组比较,加味温胆汤组大鼠糖水偏爱率显著增加(P<0.01)。结果见表 2。
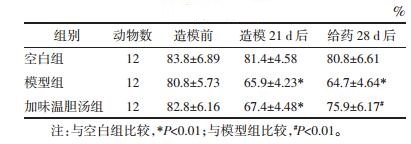
对营养性半固体食物的胃排空率比较结果显示:与空白组比较,模型组的胃排空率得分显著降低(P<0.01);与模型组比较,加味温胆汤组的胃排空率得分增加,差异有统计学意义(P<0.05)。结果见表 3。
对营养性半固体食物的小肠推进率比较结果显示:与空白组比较,模型组的小肠推进率得分显著降低(P<0.01);与模型组比较,加味温胆汤组的小肠推进率得分增加,差异有统计学意义(P<0.05)。结果见表 4。
正常组:胃主细胞细胞膜结构完整清晰,内质网未发现明显扩张,线粒体分布均匀并呈静息状态,黏原颗粒均匀覆盖于细胞表面及胞质内,细胞核核膜结构完整,大小形态正常规则,无明显染色质边集、浓缩等改变。模型组:大鼠胃主细胞胞膜结构不完整,核严重固缩、核质边移,胞质中部分细胞器出现崩解,线粒体仍呈静息状态,但线粒体排列不均匀且在核周围密集分布,内质网出现明显扩张,细胞核形态明显畸形且出现核溶解,染色质在核内呈边集、浓缩分布。加味温胆汤组:大鼠胃主细胞结构较完整,线粒体结构正常,内质网无明显扩张,胞核形态基本正常,核膜完整无固缩。结果见图 1。
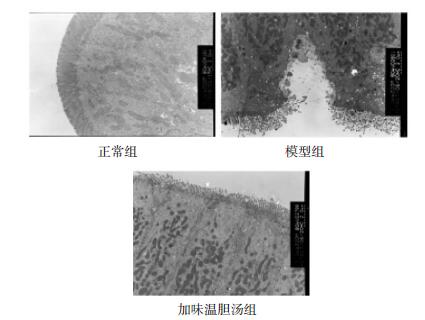
|
| 图 1 胃主细胞超微形态结构(×5 000) Fig. 1 Ultrastructural structure of gastric primary cells(×5 000) |
正常组:紧密连接好,细胞形态正常。模型组:细胞崩解,损伤严重。加味温胆汤组:紧密连接好,线粒体嵴稍模糊,接近正常。结果见图 2。

|
| 图 2 结肠黏膜超微形态结构(×5 000) Fig. 2 Ultrastructural structure of colonic mucosa(×5 000) |
本实验采用慢性应激配合孤养法诱导的大鼠抑郁模型,模拟了人类抑郁症发病过程中的临床症状,是当前应用及研究较多的抑郁症模型[7]。造模21 d成功后给药28 d,同样是为更好地模拟临床对抑郁症的治疗。旷场实验是一个研究动物自发活动与探索行为的实验,能够用于评价动物自发活动以及抑郁状态,糖水偏好实验能够反映动物快感是否缺失[8]。本实验观测了造模前、造模21 d后、给药28 d后的旷场实验得分和糖水偏好率,发现给药28 d后加味温胆汤组旷场实验得分高于模型组,糖水偏好实验得分加味温胆汤组高于模型组,说明加味温胆汤能够改善抑郁模型大鼠的抑郁状态。
国内外研究[9-10]表明,胃肠动力障碍在慢性身心应激患者中普遍存在,胃肠运动功能障碍是慢性身心应激常见的病理改变,表现为胃电节律紊乱,如胃动过缓、胃动过速和节律紊乱等,常见症状表现为消化不良、胃痛、恶心、呕吐、嗳气、饱胀等。胃排空率和小肠推进率实验为研究胃肠功能的基本实验方法。
本研究对营养性半固体食物的胃、小肠排空率比较结果显示:给药4周后,与空白组比较,模型组的胃、小肠排空率得分显著低于空白组(P<0.01);与模型组比较,加味温胆汤组的胃、小肠排空率得分增加(P<0.05)。说明模型组大鼠的胃、肠运动功能下降;加味温胆汤组胃、肠排空率显著升高,接近正常组,说明加味温胆汤具有改善抑郁模型大鼠胃、肠运动功能及增强抑郁大鼠胃、肠动力的作用。
3.2 加味温胆汤对抑郁模型大鼠胃、肠超微结构的影响长期的负面情绪会导致胃酸超量分泌,削弱胃肠黏膜的抗病能力,胃肠黏膜细胞会因强烈或持续的应激,导致胃黏膜上皮大量细胞不可逆的功能结构变异和坏死,使胃黏膜形成应激损伤。本研究观察加味温胆汤对抑郁模型大鼠胃、肠超微结构的影响,结果提示加味温胆汤可显著改善抑郁模型大鼠胃、肠黏膜组织细胞的超微形态结构。
本次实验结果显示,抑郁模型大鼠旷场实验得分和糖水偏好率下降,加味温胆汤能够提升抑郁模型大鼠旷场实验得分和糖水偏爱率,改善抑郁模型大鼠的抑郁状态;抑郁模型大鼠出现了胃肠动力异常改变,加味温胆汤能够有效调节抑郁模型大鼠胃肠动力;抑郁大鼠出现了胃、肠组织神经元超微结构改变,加味温胆汤能够减轻抑郁模型大鼠的胃、肠组织神经元超微结构损害。
| [1] |
Tack J, Lee KJ. Pathophysiology and treatment of functional dyspepsia[J]. J Clin Gastroenterol, 2005, 39(5): 211-216. |
| [2] |
谢慧臣.加味四逆散对慢性身心应激模型大鼠胃肠结构及功能的影响[D].武汉: 湖北中医药大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10507-1013208251.htm
|
| [3] |
汤久慧, 张丽萍, 吴沛然, 等. 加味温胆汤与氟西汀治疗抑郁症的临床对照研究[J]. 环球中医药, 2013, 6(4): 253-257. DOI:10.3969/j.issn.1674-1749.2013.04.004 |
| [4] |
吴沛然, 汤久慧, 张丽萍, 等. 加味温胆汤对抑郁模型大鼠海马SS、SP、NPY、CRH含量的影响[J]. 中华针灸电子杂志, 2015, 4(6): 259-262. |
| [5] |
张丽萍, 夏猛, 谈驰. 解郁1号对抑郁模型大鼠血浆NPY、SP、SS含量的影响[J]. 福建中医学院学报, 2009, 19(2): 19-21. DOI:10.3969/j.issn.1004-5627.2009.02.007 |
| [6] |
邢建峰, 封卫毅, 侯家玉. 小鼠胃排空及小肠推进实验方法的探讨[J]. 北京中医药大学学报, 2003, 45(4): 50-52. |
| [7] |
Porsolt RD. Animal Models of Depression:Utility for Transgenic Research[J]. Rev Neurosci, 2000, 11(1): 53-58. |
| [8] |
蔡思琪, 李沅衡, 黎嘉, 等. 鼠类行为学实验方法研究进展[J]. 医学综述, 2018, 24(5): 916-920. DOI:10.3969/j.issn.1006-2084.2018.05.017 |
| [9] |
Lee HT, Kim BJ. Trimebutine as a modulator of gastrointestinal motility[J]. Arch Pharm Res, 2011, 34(6): 86l-864. |
| [10] |
Zhang M, Leung FP, Huang Y, et al. Increased colonic motility in a rat model of irritable bowel syndrome is associated with up-regulation of L-type calcium channels in colonic smooth muscle cells[J]. Neurogastmenteml Motil, 2010, 22(5): 162-170. |
 2019, Vol. 36
2019, Vol. 36