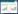文章信息
- 成睿珍, 张春艳, 刘凤婷, 李睿, 吴文静, 李艳霞, 马晓芳, 李丽丽, 刘晓智
- CHENG Ruizhen, ZHANG Chunyan, LIU Fengting, LI Rui, WU Wenjing, LI Yanxia, MA Xiaofang, LI Lili, LIU Xiaozhi
- 灵芝烯酸B诱导Oct4去SUMO化激活G0期胃癌侧群细胞
- Ganoderma acid B induces Oct4 deSUMOylation and activates gastric cancer side population cells in G0 phase
- 天津中医药, 2019, 36(4): 396-399
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(4): 396-399
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.04.21
-
文章历史
- 收稿日期: 2018-12-18
2. 天津医科大学临床医学院, 天津 300070;
3. 天津市第五中心医院中心实验室, 天津 300450;
4. 天津医科大学肿瘤医院骨与软组织肿瘤科, 国家肿瘤临床医学研究中心, 天津市"肿瘤防治"重点实验室, 天津市恶性肿瘤临床医学研究中心, 天津 300060
灵芝烯酸B(GAB)是一种从中草药灵芝中提取分离得到的羊毛甾烷型三萜化合物[1]。研究表明,GAB对多种肿瘤细胞均具有较强的生长抑制作用,是一种颇具开发潜力的中药有效成分[2]。但目前人类对其内在调控机制依旧知之甚少。本研究将以胃癌术后复发的根源——胃癌侧群细胞为研究对象,选择关键的干性维持蛋白八聚体结合转录因子4(Oct4)为靶点,从类泛素化修饰角度分析GAB对胃癌侧群细胞的影响与潜在的分子机制,拟针对当前临床胃癌患者对常规化疗药物顺铂耐药性的问题展开研究,为未来基于GAB的中草药研发和肿瘤治疗方面的应用提供实验参考。
1 材料 1.1 实验细胞人胃癌细胞株SGC-7901,购自美国ATCC公司。
1.2 试剂GAB标准品(青岛捷世康生物科技有限公司)、顺铂(山东齐鲁制药);胎牛血清、达尔伯克改良伊格尔(DMEM)培养基、肿瘤干细胞专用培养基(美国Gibco公司);免疫磁珠(CD133+)细胞分选试剂盒(德国Miltenyi Biotec公司);兔抗人CD133抗体(美国Chemicon公司)、小鼠抗人小泛素样修饰蛋白(SUMO)-1抗体、兔抗人Oct4、Cyclin D1、Cyclin E1、Cyclin A2和Cyclin B1抗体(美国Abcam公司);四甲基噻唑蓝(MTT)试剂盒(北京鼎国公司)。
1.3 仪器二氧化碳培养箱(Thermo公司)、酶联免疫分析仪(BioTek),流式细胞周期检测由国家纳米技术与工程研究院完成。
2 方法 2.1 胃癌侧群细胞分离与培养常规胰酶消化处于对数生长期的SGC-7901胃癌细胞,充分重悬至单细胞悬液,调整细胞终浓度为5×106个/mL,先后加入CD133抗体(终浓度为20 μg/mL)及二抗包被的超微磁珠,轻柔混匀后室温孵育20 min,利用磁场及分离柱装置分离得到CD133+和CD133-胃癌侧群细胞。将CD133+胃癌侧群细胞接种于96孔板中,使每孔仅含1个细胞,于含5%CO2、37 ℃的细胞培养箱中培养。
2.2 实验分组与处理取直径接近100 μm的胃癌侧群细胞克隆球,对其进行实验分组:1)对照组:常规培养细胞96 h;2)GAB组:加入终浓度为10 μmol/L的GAB,持续作用96 h。每隔24 h于倒置显微镜下测量10个细胞克隆球直径,绘制克隆球直径变化曲线。
2.3 细胞周期检测取对照组及GAB组胃癌侧群细胞分别经胰酶消化得单细胞悬液,磷酸缓冲盐溶液(PBS)漂洗后以70%乙醇4 ℃冰箱内固定过夜,碘化丙啶(PI)染色30 min,行流式细胞术检测细胞周期分布情况,CELL Quest软件采样分析结果,以公式PIx=(S+G2M)/(G0G1+S+G2M)计算细胞增殖指数。
2.4 蛋白免疫印迹(Western Blot)方法检测蛋白表达提取对照组及GAB组胃癌侧群细胞总蛋白,以10%分离胶进行电泳,冰浴下110 V转膜60 min,室温下脱脂奶粉抗原封闭60 min,然后分别加入Oct4(1:1 000)、SUMO-1(1:2 000)、Cyclin D1(1:1 000)、Cyclin E1(1:2 000)、Cyclin A2(1:5 000)和Cyclin B1(1:2 000)抗体,4 ℃水平摇床孵育过夜。次日使用二抗(1:2 000)孵育60 min后用超信号蛋白检测试剂盒检测蛋白表达,凝胶成像系统扫描光密度值,Quantity One软件进行定量分析。以β-actin为内参。
2.5 MTT实验按上述实验分组在细胞培养基中加入终浓度分别为0.4、2、10、50和250 μg/mL的顺铂,作用48 h后行MTT实验,于酶联免疫分析仪上分别测定其吸光度值(λ=490 nm),根据实验结果绘制细胞生长曲线,计算顺铂对胃癌侧群细胞的半数致死量IC50;设置空白对照组,3个平行孔。
2.6 统计学方法采用SPSS 19.0统计软件,计量资料数据以均数±标准差(x±s)表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,P < 0.05表示差异有统计学意义。
3 结果 3.1 克隆球生长曲线自GAB药物处理24 h开始后的4个不同检测时间点,GAB组CD133+胃癌侧群细胞克隆球直径均明显小于对照组,两者间具有统计学差异(P < 0.05),见图 1。
|
| 图 1 CD133+胃癌侧群细胞克隆球直径生长曲线 Fig. 1 Clonal growth curve of CD133+ gastric cancer side population cells in different groups |
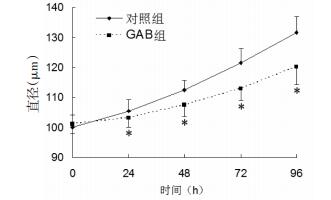
对照组CD133+胃癌侧群细胞处于G0/G1期的比例为(61.49±4.56)%,其细胞增殖指数PIx=(38.51±5.06)%;GAB组CD133+胃癌侧群细胞处于G0/G1期的比例为(43.54±4.09)%,其细胞增殖指数PIx=(56.46±3.87)%,与对照组相比,GAB组的细胞增殖指数具有明显差异(P < 0.01),见图 2。
|
| 图 2 不同处理组CD133+胃癌侧群细胞周期分布比较 Fig. 2 Cell cycle distribution of CD133+ gastric cancer side population cells in different groups |
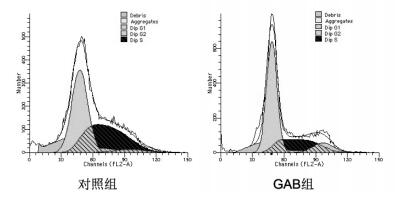
Western Blot结果显示,与对照组比较,GAB组胃癌侧群细胞的Oct4、SUMO-1和Cyclin D1蛋白表达水平显著降低,而Cyclin E1、Cyclin A2和Cyclin B1蛋白表达水平明显升高(P < 0.05或P < 0.01),见图 3。
|
| 与对照组比较,*P < 0.05,**P < 0.01 图 3 Western Blot实验检测不同处理组蛋白表达结果 Fig. 3 Protein expression detected by Western Blot in different groups |
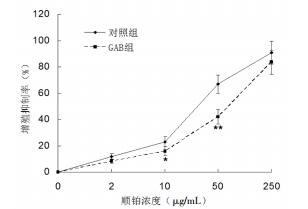
对照组CD133+胃癌侧群细胞对顺铂的IC50为29.65 μg/mL,GAB组CD133+胃癌侧群细胞对顺铂的IC50为87.64 μg/mL,在顺铂浓度为10 μg/mL及50 μg/mL作用下,两组间IC50比较具有统计学差异(P < 0.05),见图 4。
|
| 与对照组比较,*P < 0.05,**P < 0.01 图 4 MTT实验检测GAB对不同组细胞增殖抑制率的比较 Fig. 4 Comparison with inhibition rates of cell proliferation in GAB groups by MTT assay |
胃癌的癌变是个多因素、多步骤、多阶段的发生、发展过程,涉及遗传、环境、心理等多个方面[3]。肿瘤细胞中存在一群具有无限增殖潜能的类干细胞样肿瘤细胞亚群,被称为肿瘤侧群细胞。这些细胞常处于休眠状态,即细胞周期G0期,恰好能够逃避当前以靶向细胞增殖周期S期及G2/M期的常规放、化疗手段[4-5]。因此,理论上,靶向胃癌侧群细胞的治疗能够起到事半功倍的效果。
灵芝为中国传统中药,味甘性平,归心、肝、肺肾经。具有补气安神、止咳平喘、扶正固本之功效[6]。现代药理学研究表明,灵芝及其有效成分具有调节免疫系统、抗氧化清除自由基、保护肝脏等作用[7]。GAB是从灵芝中提取得到的一种羊毛甾烷型三萜化合物。研究表明,GAB对多种肿瘤细胞均具有较强的生长抑制作用[8]。Liu等[9]研究发现,GAB能够通过逆转肿瘤侧群细胞中ATP结合盒子家族G成员-2的多药耐药活性,进而提高肝癌侧群细胞对化疗药物的治疗敏感性。
基于上述发现,笔者推测GAB也能够提高胃癌侧群细胞对化疗药物的治疗敏感性,但是目前几乎未见相关报道。因此,本研究首次以胃癌侧群细胞为研究对象,观察GAB对其生长抑制效果,并从干性维持核心蛋白Oct4的类泛素化修饰角度解读GAB增加胃癌侧群细胞化疗敏感性的内在机制,以期为未来靶向胃癌侧群细胞的中草药研发提供实验参考和借鉴。
本研究以具有肿瘤干细胞特征的CD133+的SGC-7901胃癌侧群细胞为研究对象[10]。首先利用流式细胞术分选得到该类细胞,并GAB处理96 h。通过绘制克隆球直径变化曲线发现,GAB能够明显抑制胃癌侧群细胞克隆球的生长,进一步的流式细胞周期分析发现,GAB能够诱导胃癌侧群细胞的细胞周期时相由G0/G1期向G2/M期发生偏移。为进一步验证该结论,本研究检测了不同细胞周期时相的标记蛋白Cyclins的蛋白表达情况。结果表明,G0/G1期早期标志蛋白Cyclin D1的蛋白水平在正常胃癌侧群细胞中高表达,但在GAB处理后该蛋白表达水平明显下降,与此同时,G1/S过渡期标志蛋白Cyclin E1,G2期标志蛋白Cycin A2以及G2/M过渡期标志蛋白Cyclin B1的蛋白水平均明显升高。提示,GAB能够显著诱导胃癌侧群细胞的细胞周期时相发生后移。为进一步了解GAB诱导发生的细胞周期时相后移是否能够提高胃癌侧群细胞对传统化疗药物的敏感性,本研究检测了顺铂对CD133+胃癌侧群细胞的IC50,结果发现GAB处理能够使顺铂对胃癌侧群细胞IC50从69.84 μg/mL下降至35.67 μg/mL。该结果表明,GAB的确可以通过诱导胃癌侧群细胞的细胞周期时相后移,使其自身暴露于化疗药物顺铂的杀伤范围,进而增加化疗敏感性。
蛋白质类泛素化修饰是近年来发现的一类参与蛋白质构象稳定、核浆移位、拮抗泛素水解等多种功能的蛋白质翻译后修饰形式[11]。Wei等[12]报道维持细胞干性功能的核心Oct4为SUMO-1的调节靶蛋白之一。Oct4蛋白上特定赖氨酸位点被SUMO结合修饰后可使其自身的蛋白构象发生改变,避免被泛素介导的蛋白水解酶降解,进而维持在较高的水平,参与干细胞干性维持。基于上述分析,本研究推测Oct4的SUMO化修饰调节机制可能参与了GAB诱导的胃癌侧群细胞周期时相后移过程,因此该研究也检测了SUMO-1和Oct4的蛋白表达水平。结果表明GAB的确能够诱导Oct4蛋白的去SUMO化修饰,进而促使Oct4蛋白降解,最终降低胃癌侧群细胞的干性维持能力。
总之,本研究发现GAB能够通过诱导Oct4去SUMO化修饰途径激活G0期的胃癌侧群细胞,促使其发生细胞周期时相后移,进而暴露于常规化疗药物顺铂的作用区间,实现对胃癌侧群细胞化疗增敏效果。该研究为未来基于GAB的中草药研发及胃癌侧群细胞的靶向治疗提供了重要的参考价值和实验借鉴。
| [1] |
杜国华, 王宏旭, 闫征, 等. 灵芝三萜化合物的抗肿瘤靶点预测与活性验证[J]. 中国中药杂志, 2017, 42(3): 517-522. |
| [2] |
闫征, 王宏旭, 刘莉莹, 等. 灵芝三萜类化合物的体外抗肿瘤活性研究[J]. 国际检验医学杂志, 2017, 38(5): 633-634, 637. DOI:10.3969/j.issn.1673-4130.2017.05.023 |
| [3] |
庄庆昕, 徐建明, 林莉, 等. 636例胃癌患者临床治疗现状分析[J]. 中华肿瘤杂志, 2012, 34(4): 316-320. DOI:10.3760/cma.j.issn.0253-3766.2012.04.017 |
| [4] |
汪学非, 孙益红, 李雪, 等. 胃癌侧群细胞分选生物学特性的体外鉴定[J]. 中华实验外科杂志, 2009, 26(1): 11-13. DOI:10.3760/cma.j.issn.1001-9030.2009.01.004 |
| [5] |
陈建新, 王均惠, 彭永海, 等. 胃癌干细胞的研究现状及发展方向[J]. 中华肿瘤杂志, 2014, 36(11): 801-804. DOI:10.3760/cma.j.issn.0253-3766.2014.11.001 |
| [6] |
查良平, 袁媛, 黄璐琦. 灵芝古今临床效用考[J]. 中国现代中药, 2016, 18(5): 653-656. |
| [7] |
Sanodiya BS, Thakur GS, Baghel RK, et al. Ganoderma lucidum:a potent pharmacological macrofungus[J]. Curr Pharm Biotechnol, 2009, 10(8): 717-742. DOI:10.2174/138920109789978757 |
| [8] |
Ruan W, Lim AH, Huang LG, et al. Extraction optimisation and isolation of triterpenoids from Ganoderma lucidum and their effect on human carcinoma cell growth[J]. Nat Prod Res, 2014, 28(24): 2264-2272. DOI:10.1080/14786419.2014.938337 |
| [9] |
Liu DL, Li YJ, Yang DH, et al. Ganoderma lucidum derived ganoderenic acid B reverses ABCB1-mediated multidrug resistance in HepG2/ADM cells[J]. Int J Oncol, 2015, 46(5): 2029-2038. DOI:10.3892/ijo.2015.2925 |
| [10] |
Gao GL, Sun ZL, Liu WY, et al. A preliminary study of side population cells in human gastric cancer cell line HGC-27[J]. Ann Transplant, 2015, 20: 147-153. DOI:10.12659/AOT.892197 |
| [11] |
周鹏成, 王志伟, 薄祥坤, 等. 八聚体结合转录因子4和胚胎干细胞转录因子对胰腺癌干细胞体内干性特征的影响[J]. 中华实验外科杂志, 2015, 32(1): 18-20. DOI:10.3760/cma.j.issn.1001-9030.2015.01.007 |
| [12] |
Wei F, Schöler HR, Atchison ML. Sumoylation of Oct4 enhances its stability, DNA binding, and transactivation[J]. J Biol Chem, 2007, 282(29): 21551-21560. DOI:10.1074/jbc.M611041200 |
2. The College of Clinical Medicine of Tianjin Medical University, Tianjin 300070, China;
3. The Central Laboratory, The Fifth Central Hospital of Tianjin, Tianjin 300450, China;
4. Department of Bone and Soft Tissue Oncology, Tianjin Medical University Cancer Institute and Hospital, National Clinical Research Center for Cancer, Key Laboratory of"Cancer Prevention and Therapy"of Tianjin, Tianjin Clinical Research Center for Malignant Tumor, Tianjin 300060, China
 2019, Vol. 36
2019, Vol. 36