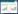文章信息
- 赵丽, 华夏, 谭晔
- ZHAO Li, HUA Xia, TAN Ye
- 辣椒碱通过上调NLRP3炎性小体诱导胃癌MGC-803细胞转移
- Promotion effects of capsaicin on the human MGC-803 gastric cancer cells metastasis through upregulating the inflammatory corpuscle NLRP3
- 天津中医药, 2019, 36(4): 404-407
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(4): 404-407
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.04.23
-
文章历史
- 收稿日期: 2018-11-05
胃癌是中国常见的恶性肿瘤之一,并且在全球肿瘤患者中占据第3位[1]。流行病学调查发现中国胃癌患者例数占全球的42%左右,每年死亡人数更是远远超过30万[2]。研究发现长期炎性因子的浸润是胃癌发生发展的一个重要诱导机制[3-4]。饮食习惯及生活方式也是诱发炎症或者肿瘤的重要原因,其中辣椒碱为辣椒中的主要活性成分[5],长期使用过多的辣椒容易诱发胃黏膜炎症反应,并且一定浓度范围的辣椒碱可以诱发一系列炎症因子的高表达,还具有抗凋亡及促进血管生成等作用[6-7]。早期发现辣椒碱能诱导胃癌细胞的增殖[8],但是与胃癌细胞转移的相关研究较少,并且炎症可以促使肿瘤细胞的转移[9]。笔者主要探讨核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎性小体是否参与辣椒碱促使人胃癌MGC-803细胞转移,证实炎性通路在辣椒碱诱发MGC-803细胞转移的作用。
1 材料及方法 1.1 材料 1.1.1 人胃癌MGC-803细胞购买于武汉巴菲尔生物有限公司(来自美国ATCC细胞库)。
1.1.2 实验试剂辣椒碱(山东绿叶制药,批号H20060291,纯度≥99%),白细胞介素-1β(IL-1β)酶联免疫吸附(ELISA)试剂盒(CUSABIO公司,批号CSB-E04505m),白细胞介素-6(IL-6)ELISA试剂盒(CUSABIO公司,批号CSB-E05207a),肿瘤坏死因子-α(TNF-α)ELISA试剂盒(CUSABIO公司,批号CSB-E02308d),活性氧(ROS)抑制剂N-乙酰半胱氨酸(NAC,美国Sigma公司,批号CT-20161006),NLRP3抑制剂(美国Sigma公司,批号CZ-20170614),NLRP3(批号ab0252411)、细胞钙依粘连蛋白(E-cadherin,批号ab1025855)、波形蛋白(Vimentin,批号ab1102239)、β-actin(批号ab2255027)抗体购自英国Abcam公司。
1.2 实验方法 1.2.1 细胞培养MGC-803细胞培养于10%胎牛血清(FBS)的完全达尔伯克改良伊格尔(DMEM)培养基(含1%的105 U/L青霉素及100 mg/L链霉素)中,培养箱设置为37 ℃、5%CO2的恒湿条件,采用15 μmol/L辣椒碱干预MGC-803细胞48 h。采用1 μmol/L MCC950及1 μmol/L NAC分别与辣椒碱共同干预MGC-803细胞48 h。
1.2.2 ELISA实验取各组细胞(对照组、辣椒碱组、MCC950+辣椒碱组)培养液上清100 μL加入包被好的ELISA板中,37 ℃反应2 h,用洗涤液洗板3次,每次2 min。扣干后加入生物素化的一抗37 ℃反应1 h,用洗涤液洗板3次,每次2 min。扣干后加入辣根过氧化物酶(HRP)标记的二抗,37 ℃反应30 min,用洗涤液洗板5次,每次2 min。最后加入3,3’,5,5’-四甲基联苯胺(TMB)显色剂,反应时间为15~30 min,加入终止液,酶标仪450 nm波长下检测吸光度值。
1.2.3 Transwell实验将对数生长期的MGC-803细胞接种于Transwell小室,贴壁后加入辣椒碱溶液及MCC950/辣椒碱混合液,药物干预上室MGC-803细胞48 h后,结晶紫染色测定迁移的细胞个数。
1.2.4 Western Blot实验收集各组细胞,采用RIPA裂解液在冰上进行细胞裂解30 min,4 ℃、13 000 g离心力下离心15 min,吸去蛋白上清自新离心管中,采用二喹啉甲酸(BCA)试剂盒进行蛋白浓度测定,加入适量样品缓冲液混匀,100 ℃煮沸7 min。用12%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶块电泳分离蛋白,完成后转膜。切割不同分子量目的蛋白至对应一抗溶液中(稀释比均为1:3 000),4 ℃震荡过夜,采用HRP标记的二抗(稀释比1:1 000)37 ℃孵育1 h,TBST洗膜3次后加入ECL显影液,采用X线曝光。
1.2.5 活性氧ROS检测辣椒碱溶液及MCC950/辣椒碱混合液共同处理细胞48 h后,收集细胞悬浮于稀释好的2,7-二氯荧光素二乙酸酯(DCFH-DA,1:1 000)液中,37 ℃细胞培养箱内孵育30 min。用无血清DMEM培养基洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。流式细胞仪检测荧光强度。
1.3 数据分析采用SPSS 20.0统计学软件处理数据,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,以P < 0.05为差异具有统计学意义。
2 结果 2.1 辣椒碱诱导MGC-803细胞产生炎性因子辣椒碱组细胞培养液中IL-1β、IL-6及TNF-α含量相对于对照组显著升高,差异有统计学意义(P < 0.05),见图 1。
|
| 与对照组比较,*P<0.05。 图 1 MGC-803细胞培养液中炎性因子水平 Fig. 1 Levels of inflammatory cytokines in MGC-803 cell medium |
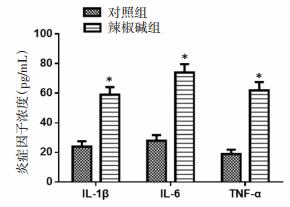
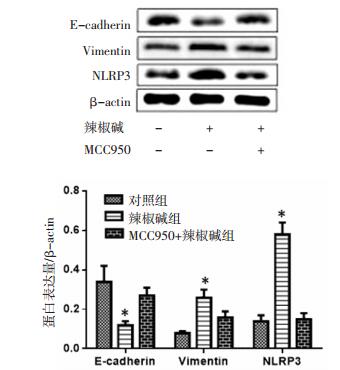
Western Blot实验结果发现辣椒碱组细胞中NLRP3炎性小体表达水平显著升高,同时E-cadherin蛋白表达显著降低、Vimentin蛋白表达明显升高,与对照组比较差异有统计学意义(P < 0.05),见图 2。图 3显示辣椒碱组细胞迁移细胞数相对于对照组显著增多,而辣椒碱+MCC950组细胞迁移数相对于对照组没有明显差异,并且发现MCC950干预细胞后,培养液中炎性因子IL-1β、IL-6及TNF-α含量与对照组比较没有明显差异(P>0.05),结果见图 4。还进一步发现MCC950联合辣椒碱共同干预细胞后,NLRP3炎性小体表达水平显著降低,同时E-cadherin蛋白表达显著升高及Vimentin蛋白表达明显降低。
|
| 与对照组比较,*P<0.05。 图 2 NLRP3、E-cadherin及Vimentin蛋白表达 Fig. 2 Expression of NLRP3, E-cadherin and Vimentin proteins |

|
| 图 3 MGC-803细胞迁移能力(×200) Fig. 3 Metastasis ability of MGC-803 cells(×200) |
|
| 与对照组比较,*P<0.05。 图 4 MGC-803细胞培养液中炎性因子水平 Fig. 4 Levels of inflammatory cytokines in MGC-803 cell medium |
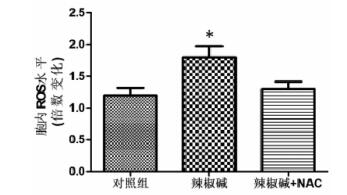
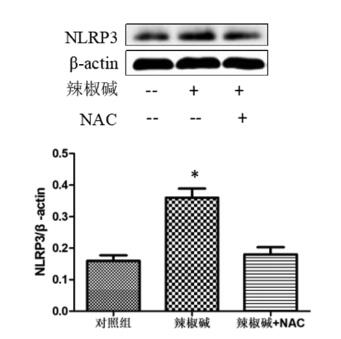
辣椒碱组细胞内ROS含量显著升高,而NAC可以逆转辣椒碱诱导的ROS含量及NLRP3表达上调,结果见图 5、图 6。
|
| 与对照组比较,*P<0.05。 图 5 不同组间ROS水平比较 Fig. 5 Comparison of ROS in different groups |
|
| 图 6 不同组间NLRP3表达水平比较 Fig. 6 Comparison of NLRP3 expression in different groups |
肿瘤细胞的迁移及侵袭是肿瘤进一步恶化的重要标志,并且细胞上皮间质转化(EMT)在肿瘤细胞的迁移侵袭过程中起着关键作用[10]。在肿瘤细胞出现转移过程中EMT往往处于活化状态,表现在间质样标志物Vimentin的表达升高、上皮样标志物E-cadherin表达降低等[11]。研究发现炎性反应可以促使肿瘤细胞的转移,而且炎性因子的产生还能够加快EMT进程,于是肿瘤炎症微环境促使了肿瘤细胞的侵袭及转移能力[12]。NLRP3炎性小体是主要的炎症调控元件,其表达上调会激活Cleaved casapse-1的水解成熟,从而诱导炎症因子IL-1β及炎性通路NF-κB的活化[13]。前期研究报道NLRP3炎性小体在肿瘤发生发展过程中发挥着重要作用,并且其表达含量的提升可诱导胃肿瘤细胞的迁移及侵袭[14]。本研究发现用辣椒碱干预MGC-803细胞48 h后,NLRP3炎性小体表达显著上升,并且间质样标志物Vimentin表达升高、上皮样标志物E-cadherin表达降低,说明辣椒碱可诱导MGC-803细胞发生EMT,同时MGC-803细胞培养液中炎性因子IL-1β、IL-6及TNF-α含量显著升高,说明辣椒碱可加剧MGC-803细胞炎症反应。然而采用NLRP3的特异性抑制剂MCC950干预MGC-803细胞后,可以解除辣椒碱诱导的细胞转移能力。
相关研究提示,氧化应激可以促使肿瘤细胞死亡达到肿瘤治疗的目的,作为机体发生氧化应激反应的主要分子,ROS能够诱导肿瘤细胞凋亡、坏死及自噬性死亡进而抑制肿瘤的恶化[15]。然而近年来报道ROS可以作为第二信使参与细胞内多种生理调节,进而介导肿瘤的迁移及侵袭[16]。机体产生的ROS可诱导NLRP3炎性小体活化,当细胞内NLRP3炎性小体受到ROS刺激后会使无活性的caspase-1前体进一步活化为有活性的caspase-1,后者能够把无活性的IL-1β前体剪切为IL-1β而分泌到细胞外,进而导致下游炎性通路的活化[17]。本研究发现辣椒碱可以促使胃肿瘤细胞内ROS的升高,而加入NAC干预细胞后能改善辣椒碱诱导的ROS增高,并且还减弱了细胞内的炎症反应,提示ROS在辣椒碱介导的胃癌转移中发挥了关键性作用,但辣椒碱诱导ROS产生的分子机制尚存在疑惑,需更深层次的研究。
总之,本文研究发现辣椒碱能诱导ROS产生进而激活NLRP3炎性小体,从而诱导胃肿瘤细胞发生EMT并促进胃癌转移。
| [1] |
Karimi P, Islami F, Anandasabapathy S, et al. Gastric cancer:descriptive epidemiology, risk factors, screening, and prevention[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(5): 700-713. DOI:10.1158/1055-9965.EPI-13-1057 |
| [2] |
Liu SZ, Wang B, Zhang F, et al. Incidence, survival and prevalence of esophageal and gastric cancer in Linzhou city from 2003 to 2009[J]. Asian Pac J Cancer Prev, 2013, 14(10): 6031-6034. DOI:10.7314/APJCP.2013.14.10.6031 |
| [3] |
Senol K, Ozkan MB, Vural S, et al. The role of inflammation in gastric cancer[J]. Adv Exp Med Biol, 2014, 816: 235-257. DOI:10.1007/978-3-0348-0837-8 |
| [4] |
Li G, Wang Z, Ye J, et al. Uncontrolled inflammation induced by AEG-1 promotes gastric cancer and poor prognosis[J]. Cancer Res, 2014, 74(19): 5541-5552. DOI:10.1158/0008-5472.CAN-14-0968 |
| [5] |
Surh YJ, Lee SS. Capsaicin in hot chili pepper:carcinogen, co-carcinogen or anticarcinogen[J]. Food Chem Toxicol, 1996, 34(3): 313-316. DOI:10.1016/0278-6915(95)00108-5 |
| [6] |
Di Giminiani P, Petersen LJ, Herskin MS. Capsaicin-induced neurogenic inflammation in pig skin:a behavioural study[J]. Res Vet Sci, 2014, 96(3): 447-453. DOI:10.1016/j.rvsc.2014.03.023 |
| [7] |
Pabalan N, Jarjanazi H, Ozcelik H. The impact of capsaicin intake on risk of developing gastric cancers:a meta-analysis[J]. J Gastrointest Cancer, 2014, 45(3): 334-341. DOI:10.1007/s12029-014-9610-2 |
| [8] |
Wang HM, Chuang SM, Su YC, et al. Down-regulation of tumor-associated NADH oxidase, tNOX (ENOX2), enhances capsaicin-induced inhibition of gastric cancer cell growth[J]. Cell Biochem Biophys, 2011, 61(2): 355-366. DOI:10.1007/s12013-011-9218-0 |
| [9] |
De Vasconcelos NM, Van Opdenbosch N, Lamkanfi M. Inflammasomes as polyvalent cell death platforms[J]. Cell Mol Life Sci, 2016, 73(11-12): 2335-2347. DOI:10.1007/s00018-016-2204-3 |
| [10] |
陈龙.RUNX3对人胃癌细胞上皮——间质转变(EMT)的影响及分子机制研究[D].济南: 山东大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10422-1012465748.htm
|
| [11] |
Zhai X, Zhu H, Wang W, et al. Abnormal expression of? EMT-related proteins, S100A4, vimentin and E-cadherin, is correlated with clinicopathological features and prognosis in HCC[J]. Med Oncol, 2014, 31(6): 970-978. DOI:10.1007/s12032-014-0970-z |
| [12] |
Zaki MH, Vogel P, Malireddi RK, et al. The NOD-like receptor NLRP12 attenuates colon inflammation and tumorigenesis[J]. Cancer Cell, 2011, 20(5): 649-660. DOI:10.1016/j.ccr.2011.10.022 |
| [13] |
Haneklaus M, O'Neill LA. NLRP3 at the interface of metabolism and inflammation[J]. Immunol Rev, 2015, 265(1): 53-62. |
| [14] |
Xu Y, Li H, Chen W, et al. Mycoplasma hyorhinis activates the NLRP3 inflammasome and promotes migration and invasion of gastric cancer cells[J]. Plos One, 2013, 8(11): e77955. DOI:10.1371/journal.pone.0077955 |
| [15] |
Lei Y, Huang K, Gao C, et al. Proteomics identification of ITGB3 as a key regulator in reactive oxygen species-induced migration and invasion of colorectal cancer cells[J]. MolCell Proteomics, 2011, 10(10): 110-117. |
| [16] |
Qin W, Li C, Zheng W, et al. Inhibition of autophagy promotes metastasis and glycolysis by inducing ROS in gastric cancer cells[J]. Oncotarget, 2015, 6(37): 39839-39854. |
| [17] |
Patel MN, Carroll RG, Galvan-Pena S, et al. Inflammasome priming in sterile inflammatory Disease[J]. Trends Mol Med, 2017, 23: 165-180. DOI:10.1016/j.molmed.2016.12.007 |
 2019, Vol. 36
2019, Vol. 36