据统计,全球每年约1 407万人罹患癌症,其中800多万患者死亡[1]。中国癌症每年新发病例约320万,病死率为180.54/10万,排在城市死亡的第1位、农村死亡的第2位[1-2],已严重威胁到人类的生命健康。
目前,放、化疗是临床上广泛用于中晚期肿瘤的治疗方法,但因药物不能完全准确地作用于癌细胞,会引起一系列毒副反应。其中骨髓抑制是常见的剂量毒性反应之一,表现为贫血、白细胞减少、血小板减少等,导致放、化疗被迫减量或停药,降低临床疗效[3]。因此,减轻其骨髓抑制是保证疗效的关键。研究表明中医药在防治癌症放、化疗骨髓抑制中能够增效减毒,被广泛使用[4]。
复方阿胶浆由阿胶、人参、党参、熟地黄、山楂组成,具有补益气血、滋补肝肾、健益脾胃的功效,可有效治疗肿瘤相关性贫血、白细胞减少等,减轻化疗后骨髓抑制,提高生活质量[5]。其与化疗联用是否比常规化疗具有优势,目前虽有多个研究发表,但尚无系统评价/Meta分析进行综合证据评价。鉴此,本研究旨在通过检索关于复方阿胶浆联合放、化疗治疗癌症的研究,系统评价复方阿胶浆辅助化疗防治癌症骨髓抑制的作用,为临床治疗提供有价值的证据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型
随机对照试验(RCT)。
1.1.2 研究对象
病理学诊断为恶性肿瘤的患者。
1.1.3 干预措施
试验组:复方阿胶浆联合放/化疗;对照组:单纯放/化疗。
1.1.4 结局指标
主要指标:白细胞计量,血红蛋白浓度,血小板计量。次要指标:红细胞计量,中性粒细胞计量,生活质量评分,不良反应。
1.1.5 排除标准
重复发表、数据错误或不全、无法获取全文等文献。
1.2 文献检索
检索CNKI、WanFang、SinoMed、PubMed、EMbase和The Cochrane Library数据库,并补充灰色文献。采用主题词与自由词相结合的方式检索,时限从建库至2017年3月。英文检索词有:Ejiao、E’jiao、collacoriiasin、compound Ejiao;中文检索词有:复方阿胶浆、化疗、放疗、随机、随机对照试验。
1.3 文献筛选及资料提取
由2位作者独立筛选文献、提取资料,并交叉核对。如遇分歧,经讨论解决。缺乏资料的研究与原作者联系予以补充。文献筛选过程中,先剔除重复文献,再阅读文题和摘要,排除明显不符合纳入标准的文献,剩余文献阅读全文,确定最终纳入文献。采用Access表进行资料提取,内容包括:纳入研究的基本信息;基线特征;干预措施;偏倚风险;结局指标。
1.4 偏倚风险评价
偏倚风险评价采用Cochrane 5.1.0手册偏倚风险评价工具,主要包括随机方法、分配隐藏、盲法、数据完整性、选择性报告及其他偏倚。
1.5 统计分析
采用RevMan 5.3软件进行Meta分析。计数资料效应量表达采用比值比(OR)及95%置信区间(95%CI),计量资料效应量表达采用均数差(MD)及95%CI表示。首先采用χ2检验对纳入研究进行异质性检验(检验水准为α=0.1),并结合I2判断异质性大小。若P>0.1、I2<50%,则异质性可接受,采用固定效应模型合并效应量;若P≤0.1、I2≥50%,则存在较显著异质性,需要分析异质性来源。在排除明显临床异质性后采用随机效应模型合并效应量。可根据临床异质性来源进行亚组或敏感性分析。Meta分析的检验水准设为α=0.05。
2 结果
2.1 检索结果
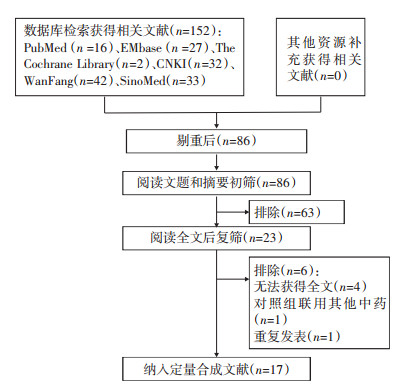
初检获得152篇相关文献,筛选后最终纳入17个RCT[6-22],均为化疗研究。共1 139例患者,复方阿胶浆组572例,单纯化疗组567例。文献筛选流程图及结果见图 1。
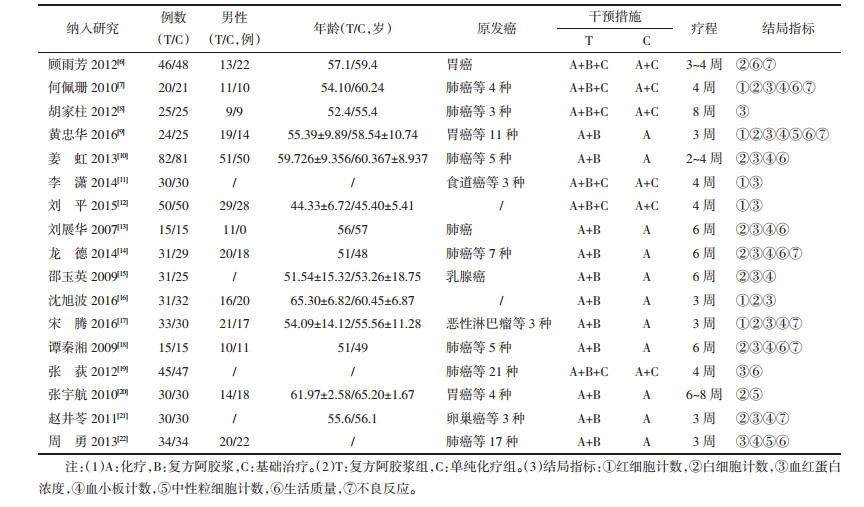
2.2 纳入研究的基本特征和偏倚风险评价结果
纳入研究的基本特征见表 1。偏倚风险评价显示:9个RCT报告随机方法[6, 8, 10, 15-17, 20-22],6个为计算机随机,3个为按病历号等半随机方法;1项研究说明分配隐藏[16];1项研究使用盲法[16];结局数据均完整,6项报告退出或失访记录[6, 9-11, 16, 22];选择性报告与其他偏倚来源均不详。
表 1 纳入研究的基本特征
Tab. 1
Basic characteristics of studies included
2.3 Meta分析结果
2.3.1 白细胞数量
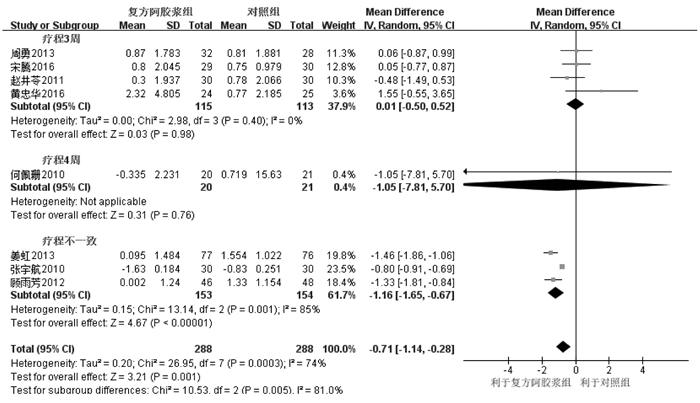
纳入12个RCT[6-7, 9-10, 13-15, 17-18, 20-22],其中8个为连续性变量,4个为二分类变量。8个RCT[6-7, 9-10, 17, 20-22]随机效应模型Meta分析显示,复方阿胶浆组白细胞数量下降程度明显低于对照组,其差异具有统计学意义[MD=-0.71,95%CI(-1.14,-0.28),P=0.001]。根据疗程进行亚组分析,随机效应模型Meta分析显示,治疗3、4周白细胞下降程度差异均无统计学意义[MD=0.01,95%CI(-0.50,0.52),P=0.98;MD=-1.05,95%CI(-7.81,5.70),P=0.76];包含多个疗程的RCT白细胞数量下降程度差异有统计学意义[MD=-1.16,95%CI(-1.65,-0.67),P<0.000 01],见图 2。
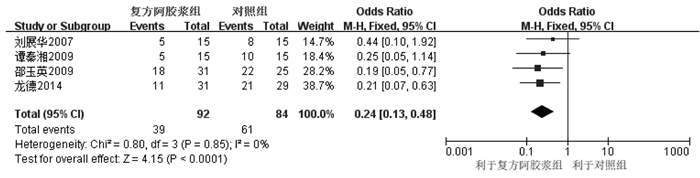
4个RCT[13-15, 18]固定效应模型Meta分析显示,复方阿胶浆组白细胞下降所致骨髓毒性的例数明显少于对照组,差异具有统计学意义[OR=0.24,95%CI(0.13,0.48),P<0.000 1],见图 3。
2.3.2 血红蛋白浓度
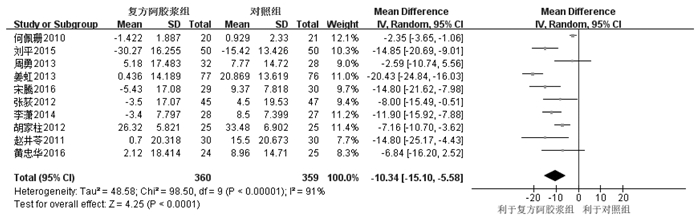
14个RCT[7-15, 17-19, 21-22]报告血红蛋白浓度,其中10个为连续性变量,4个为二分类变量。10个RCT[7-12, 17, 19, 21-22]随机效应模型Meta分析显示,复方阿胶浆组血红蛋白浓度下降程度明显低于对照组,差异有统计学意义[MD=-10.34,95%CI(-15.10,-5.58),P<0.001],见图 4。
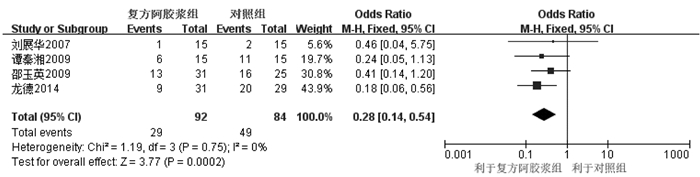
4个RCT[13-15, 18]固定效应模型Meta分析显示,复方阿胶浆组血红蛋白下降所致骨髓毒性的例数明显少于对照组,差异具有统计学意义[OR=0.28,95%CI(0.14,0.54),P=0.000 2],见图 5。
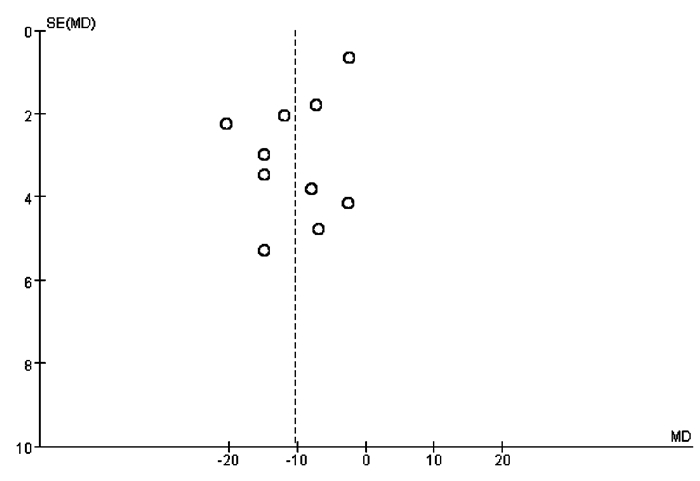
其中反应骨髓抑制疗效的研究作漏斗图,各研究在漏斗图两侧分布基本对称,提示存在发表性偏倚的可能性不大,见图 6。
2.3.3 血小板数量
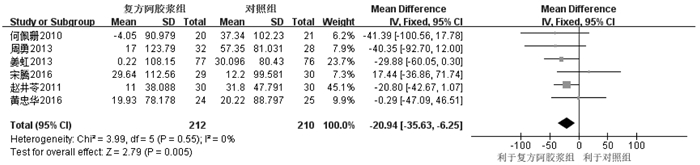
纳入10个RCT[7, 9-10, 13-15, 17-18, 21-22],6个为连续性变量,4个为二分类变量。6个RCT[7, 9-10, 17, 21-22]固定效应模型Meta分析显示,复方阿胶浆组血小板下降程度明显低于对照组,其差异具有统计学意义[MD=-20.94,95%CI(-35.63,-6.25),P=0.005],见图 7。
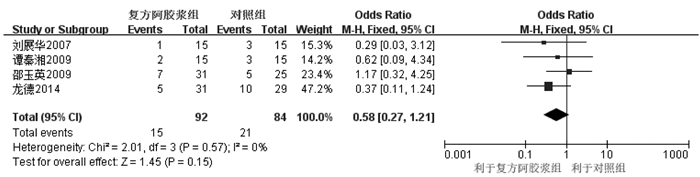
4个RCT[13-15, 18]固定效应模型Meta分析显示,两组血小板下降所致骨髓毒性差异无统计学意义[OR=0.58,95%CI(0.27,1.21),P=0.15],见图 8。
2.3.4 红细胞数量
纳入6个RCT[7, 9, 11-12, 17, 22],随机效应模型Meta分析显示,复方阿胶浆组红细胞计数下降明显低于对照组,其差异有统计学意义[MD=-0.46,95%CI(-0.69,-0.23),P<0.000 1],见图 9。
根据疗程进行亚组分析。随机效应模型Meta分析显示,治疗4周红细胞减少差异有统计学意义[MD=-0.59,95%CI(-0.71,-0.47),P<0.000 01];治疗3周红细胞减少差异无统计学意义(P=0.10),见图 9。
2.3.5 中性粒细胞计数
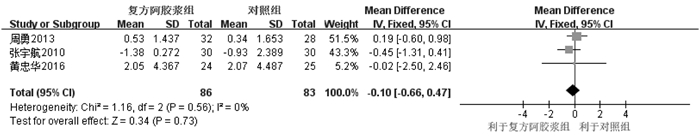
纳入3个RCT[9, 20, 22]。固定效应模型Meta分析显示,两组中性粒细胞计数下降程度差异无统计学意义[MD=-0.10,95%CI(-0.66,0.47),P=0.73],见图 10。
2.3.6 生活质量改善率
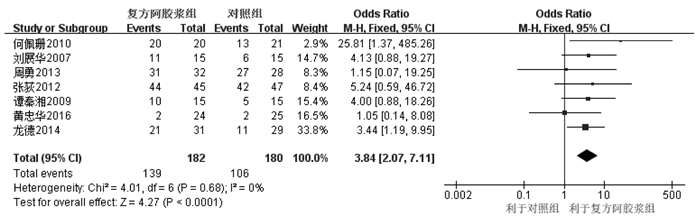
纳入7个RCT[7, 9, 13-14, 18-19, 22]。固定效应模型Meta分析显示,复方阿胶浆组生活质量改善率明显高于对照组,差异有统计学意义[OR=3.84,95%CI(2.07,7.11),P<0.000 1],见图 10。
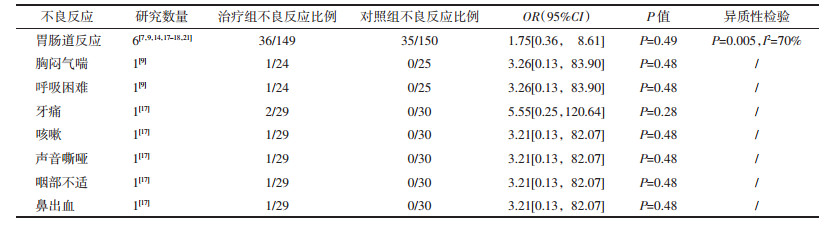
2.3.7 不良反应
6个RCT[7, 9, 14, 17-18, 21]报告不良反应情况,随机效应模型Meta分析显示,两组胃肠道反应、胸闷气喘、呼吸困难、牙痛、咳嗽、声音嘶哑、咽部不适和鼻出血发生率差异均无统计学意义,见表 2。
表 2 复方阿胶浆组与单纯化疗组防治骨髓抑制相关不良反应比较的Meta分析结果汇总
Tab. 2
Meta analysis results of prevention and treatment of adverse reactions related to bone marrow suppression between the compound Ejiao Jiang group and the chemotherapy group
3 讨论
对于癌症放、化疗后所致的骨髓抑制,西医多采用利血生、鲨肝醇、粒细胞刺激因子等药物,价格昂贵、疗效欠佳,且维持时间短、易反复[4]。中药具有作用平稳、价廉、不良反应小等优点,在肿瘤的整体治疗中发挥着积极作用。癌症患者久病虚损,多表现为虚证。中医对虚证提出了“损者益之”的治疗原则,复方阿胶浆即基于此理论组方而成,被广泛用于防治癌症放、化疗后骨髓抑制。
研究过程中发现,纳入的原始研究质量较差、异质性较大,主要表现在:1)干预复杂,化疗方案多样。每个研究运用不同的化疗方案,其中一个RCT中化疗方案多达8个。2)原发癌多样。研究对象存在多个癌症类型,最多达21种,原发癌的不同影响了化疗方案的选择。3)疗程差异,化疗方案的不同决定了疗程的不一致性。4)结局指标差异大,难以合并。连续性变量作分类变量报告;指标选择不一致,临床相关性较低。5)方法学质量较低。6)报告不完整。8项研究未说明化疗方案,且多数未报告分配隐藏、盲法及其他偏倚等信息。
本研究的局限性:1)纳入研究较少,证据强度较低;2)研究对象病情较重、不良反应较多,对症治疗中可能会用到多种药物产生影响;3)未考虑原发癌种类、化疗方案的不同。
综上,当前RCT证据显示,与单纯化疗相比,联用复方阿胶浆防治化疗后骨髓抑制,在防治白细胞、血红蛋白、血小板、红细胞减少和改善生活质量方面有一定优势,且安全性较好;在中性粒细胞保护方面证据不足,存在一定风险。因纳入研究质量较低,上述结论仍需通过严格设计的高质量研究进一步验证。
Efficacy and safety of compound Ejiao Jiang for bone marrow suppression after cancer chemotherapy: A systematic review
Evidence-Based Medicine Center, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2019, Vol. 36
2019, Vol. 36