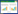文章信息
- 张梦迪, 牟睿宇, 刘宏根, 杨佩颖, 王晓群, 贾英杰
- ZHANG Mengdi, MOU Ruiyu, LIU Honggen, YANG Peiying, WANG Xiaoqun, JIA Yingjie
- 消癌平注射液联合化疗治疗晚期非小细胞肺癌的Meta分析
- Meta-analysis of Xiaoaiping Injection combined with chemotherapy in the treatment of advanced non-small cell lung cancer
- 天津中医药, 2019, 36(5): 466-473
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(5): 466-473
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.05.14
-
文章历史
- 收稿日期: 2018-11-18
2. 天津中医药大学研究生院, 天津 301617
化疗目前仍为晚期非小细胞肺癌的主要治疗手段,其作用地位虽未发生根本动摇,但治疗效果已趋于平台期,且化疗产生的一系列不良反应也成为了其剂量限制因素。中医药治疗因其具有多靶点的特性,中药的活性成分可多途径在肿瘤治疗中发挥作用,故目前在临床应用中饱受青睐。
消癌平注射液的主要成分是中药乌骨藤的提取物,多年来在临床中广泛使用,常用于姑息治疗,并配合放疗、化疗以提高肺癌、食管癌、肝癌、胃癌、白血病等多种恶性肿瘤的疗效。近年来消癌平注射液单药联合化疗的临床研究报道很多,本研究通过Meta分析的方式,对近年来的研究文献进行综合整理,评价消癌平注射液在晚期非小细胞肺癌治疗中的临床疗效及安全性。
1 资料与方法 1.1 检索策略由PubMed数据库确定检索主题词及自由词,访问Cochrane Library、PubMed、EMBASE、中国期刊全文数据库(CNKI)、万方期刊数据库、维普资讯中文期刊服务平台(VIP),检索文献发表日期从2000年2月—2018年5月,使用以下检索词:非小细胞肺癌、NSCLC、Carcinoma、Non Small Cell Lung、Carcinomas、Non-Small-Cell Lung、Lung Carcinoma、Non-Small-Cell、Lung Carcinomas、Non-Small-Cell、Non-Small-Cell Lung Carcinomas、Nonsmall Cell Lung Cancer、Non-Small-Cell Lung Carcinoma、Non Small Cell Lung Carcinoma、Carcinoma、Non-Small Cell Lung、Non-Small Cell Lung Cancer、消癌平、XAP、Xiaoaiping、xiaoaiping、Xiao-aiping、Xiao-Ai-Ping。
中文检索式以CNKI举例:
(TI=“非小细胞肺癌”OR KY=“非小细胞肺癌”OR AB=“非小细胞肺癌”)AND(TI=“消癌平”OR KY=“消癌平”OR AB=“消癌平”)
英文检索式以PubMed举例:
#1:检索“Carcinoma,Non-Small-Cell Lung”。
#2:检索“Carcinoma,Non Small Cell Lung”OR“Carcinomas,Non-Small-Cell Lung”OR“Lung Carcinoma,Non-Small-Cell”OR“Lung Carcinomas,Non-Small-Cell”OR“Non-Small-Cell Lung Carcinomas”OR“Nonsmall Cell Lung Cancer”OR“Non-Small-Cell Lung Carcinoma”OR“Non Small Cell Lung Carcinoma”OR“Carcinoma,Non-Small Cell Lung”OR“Non-Small Cell Lung Cancer”。
#3:Search“#1”OR“#2”。
#4:Search“XAP”OR“Xiaoaiping”OR“xiaoaiping” OR“Xiao-aiping”OR“Xiao-Ai-Ping”。
#5:Search“#3”AND“#4”。
1.2 文献的纳入与排除标准 1.2.1 文献纳入标准1)研究对象为ⅢB-Ⅳ期非小细胞肺癌患者;2)研究类型为临床随机对照试验(RCT);3)干预措施:对照组给予化疗治疗,试验组给予消癌平注射液联合化疗治疗;4)原始资料完整,信息准确可信;5)文献语言为中、英文。
1.2.2 文献排除标准1)各数据库检出的重复文献;2)无明确对照组;3)文献内容、数据重复发表;4)数据异常;5)非RCT;6)动物实验或机制研究、系统评价、综述、经验研究等。
1.3 文献的管理与筛选根据检索式检索文献后,将所得文献题录导入NoteExpress进行批量管理,库内查重删除重复文献。文献的筛选由两名研究者独立进行,通过阅读文献题目及摘要,初步排除重复及非RCT文献,然后阅读全文,筛选出符合纳入标准的研究。此过程中若遇到分歧,则讨论决定或由第3名研究者予以判断。
1.4 研究质量评价研究的质量评估及偏倚风险分析由“Cochrane偏倚风险评估工具”评定,评价共包含6个条目:1)选择性偏倚:随机序列的产生、分配隐藏;2)实施偏倚:对研究者和受试者的施盲情况;3)测量偏倚:研究结局盲法评价;4)随访偏倚:结局数据的完整性;5)发表偏倚选择性报告研究结果;6)其他偏倚来源。依据偏倚风险评估标准,对每个条目给予低偏倚风险(Low Risk)、不明风险(Unclear)和高偏倚风险(High Risk)的评定。
1.5 资料提取资料提取的项目包含以下内容:篇名、作者、发表年份、出处、研究对象、试验组干预措施、对照组干预措施、随机方式、是否采用盲法、疗效指标、不良反应等。
1.6 观察指标 1.6.1 主要观察指标1)终点事件(中位生存期、总生存期等);2)临床疗效的有效率;3)对生活质量的改善情况。
1.6.2 次要观察指标不良反应发生情况、化验室指标等。
1.7 统计学方法采用Cochrane协作组提供的Review Manager 5.3软件进行Meta分析。计数资料的表示采用风险比(RR)及其95%可信区间(CI);连续变量资料采用均数差(MD)及其95%CI表示;各项纳入研究结果间的异质性采用Chi2检验。当各项研究间具有统计学同质性(P > 0.1,I2 < 50%)时,采用固定效应模型对各研究进行Meta分析;当各项研究间具有统计学异质性,重新对纳入数据进行复核,排除因数据异常导致的统计学异质性,若数据提取及录入无异常或数据异常纠正后异质性仍存在,则进一步分析异质性产生的原因,对研究中可能对统计结果产生异质性的因素进行亚组分析,当各项研究存在统计学异质性而对临床无意义时,合并后应用随机效应模型进行Meta分析,若两组间异质性过大或无法找寻数据来源时,则采用描述性分析。结局指标纳入研究的样本量大时,采用漏斗图分析其可能存在的发表偏倚。
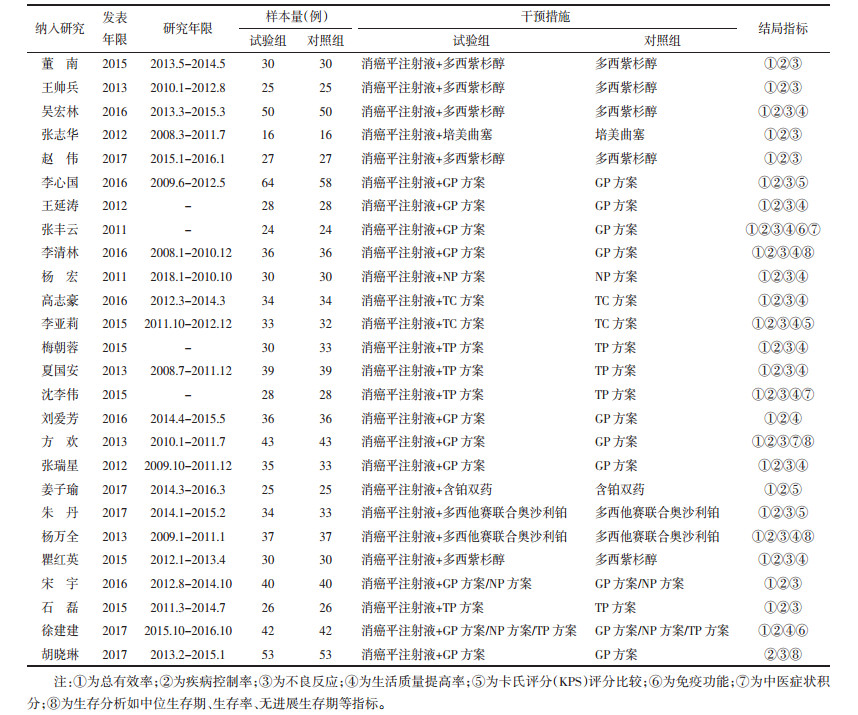
2 结果 2.1 文献检索结果及特征检索相关文献226篇,NoteExpress库内查重删除重复文章57篇,剩余169篇,阅读文章题目及摘要筛选文献91篇,进一步阅读全文后排除不符合纳入标准及数据异常文献65篇,最终纳入26篇RCT研究[1-26]进行Meta分析。具体筛选过程见图 1。本课题累计纳入1 783例晚期非小细胞肺癌患者,试验组895例,对照组888例。所选文献基本特征见表 1。
|
| 图 1 文献筛选流程及结果 Fig. 1 Flow chart describing the article selection |
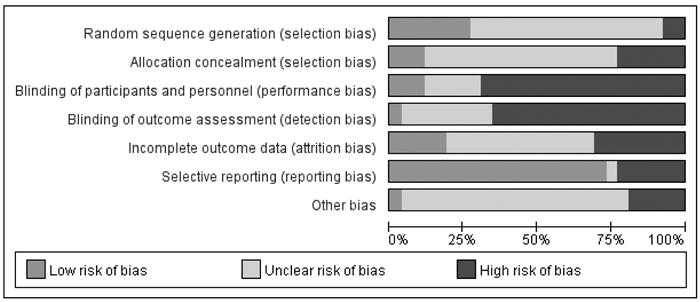
纳入文献中共7项研究描述了具体的随机分配方法,其余研究只提及了进行随机分配,但未具体说明随机序列的产生。所有文献均未提及是否随访、是否采用分配隐藏及盲法,具体情况见图 2。
|
| 图 2 纳入文献偏倚风险评估 Fig. 2 Risk assessment of included literature bias |
纳入文献中共有4篇提到了生存事件,1项研究[9]共纳入72例患者,试验组中位生存期为14.9个月,1 a生存率为58.9%,2 a生存率为34.3%;对照组中位生存期为15.1个月,1 a生存率为56.2%,2 a生存率为17.2%。两组间生存事件试验组优于对照组,但均无统计学差异。方欢等[17]的研究结果显示,试验组与对照组中位生存期、无进展生存期、1 a生存率及1.5 a生存率差异均无统计学意义。胡晓琳等[23]的研究结果显示,试验组中位生存时间是8.4个月,肿瘤进展时间为5.3个月,1 a生存率为26.4%;对照组中位生存时间是7.7个月,肿瘤进展时间为4.2个月,1 a生存率为11.3%,组间比较差异有统计学意义。杨万全等[25]的研究中试验组中位生存期388 d,对照组为243 d,差异有统计学意义;试验组6个月生存率为70.3%,对照组生存率为51.4%,12个月时试验组生存率为54.1%,对照组生存率为37.8%,差异均具有统计学意义。
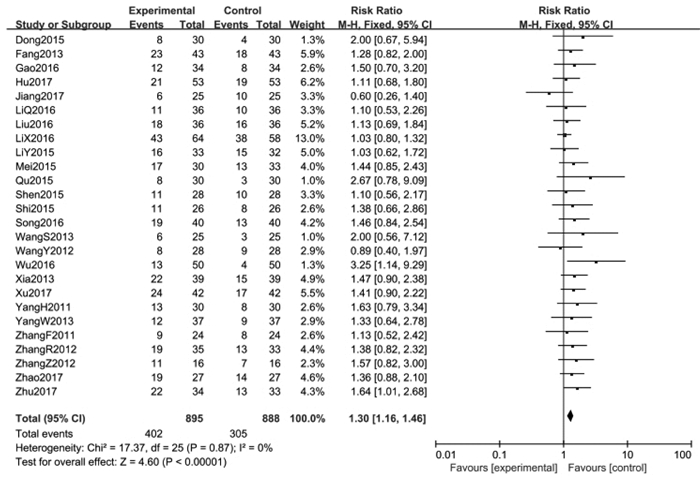
2.3.1.2 总有效率纳入的26篇文献[1-26]均报告了治疗后的总有效率,Meta分析的结果显示:异质性检验P=0.87,I2=0%,表示各项研究之间无显著的异质性,采用固定效应模型进行统计分析,合并效应量RR=1.30,95%CI(1.16,1.46),Z=4.60(P < 0.000 01),差异具有统计学意义。代表总有效率的菱形方块位于等效竖线的右侧,提示消癌平注射液联合化疗对晚期非小细胞肺癌患者的总有效率优于单纯化疗组。见图 3。
|
| 图 3 试验组与对照组总有效率的Meta分析 Fig. 3 Meta-analysis of total effective rate between treatment group and control group |
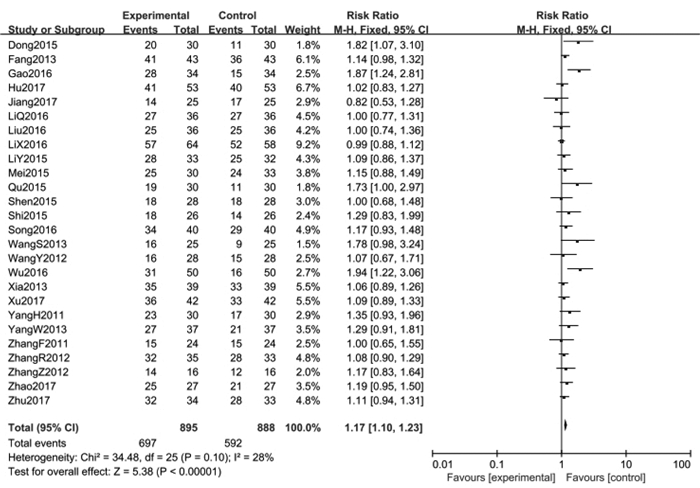
疾病控制率的Meta分析共纳入26篇文献[1-26],结果显示:异质性检验P=0.10,I2=28%,采用固定效应模型进行统计分析,合并效应量RR=1.17,95%CI(1.10,1.23),Z=5.38(P < 0.000 01),试验组与对照组两组间差异具有统计学意义。提示消癌平注射液联合化疗对晚期非小细胞肺癌患者的疾病控制率优于单纯化疗组。见图 4。
|
| 图 4 试验组与对照组疾病控制率的Meta分析 Fig. 4 Meta-analysis of disease control rate between treatment group and control group |
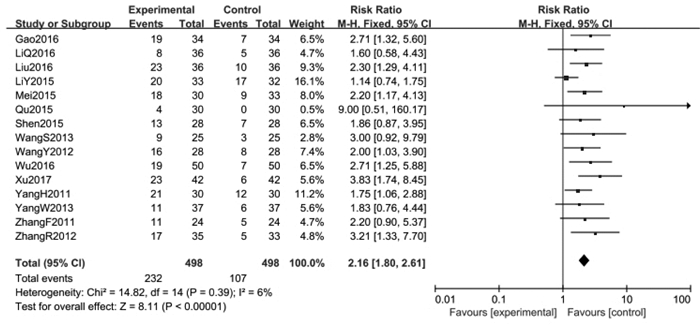
纳入16篇文献[2-3, 7-16, 18, 22, 25-26],Meta分析的结果显示:异质性检验Chi2=23.96,P=0.07,I2=37%,纳入文献具有明显异质性,通过观察各项研究之间的可信区间分布情况,发现夏国安[14]研究所得的生活质量提高率的数据与其他研究相比具有很大的差异性,剔除该研究后重新进行异质性检验,Chi2=14.82,P=0.39,I2=6%,各项研究间具有统计学同质性,采用固定效应模型统计学分析,结果显示RR=2.16,95%CI(1.80,2.61),P < 0.000 01,试验组与对照组间差异具有统计学意义,提示消癌平注射液联合化疗对患者的生活质量改善情况明显优于对照组。见图 5。
|
| 图 5 试验组与对照组生活质量提高率的Meta分析 Fig. 5 Meta-analysis of quality of life improvement rate between treatment group and control group |
共纳入4篇文献[6, 12, 19, 24],采用连续性变量Meta分析,异质性检验Chi2=5.95,P=0.11,I2=50%,研究间具有异质性,采用随机效应模型分析MD=6.75,95%CI(4.29,9.20),P < 0.000 01。依次去除其中1个研究后再重新统计以分析纳入研究的敏感性,发现当剔除权重最大的研究[19]后,异质性检验Chi2=0.11,P=0.95,I2=0%,各项研究具有统计学同质性,采用固定效应模型进行分析,MD=5.35,95%CI(3.25,7.45),P < 0.000 01。该结果表明,剔除的研究为此项Meta分析异质性的主要来源,但删除该项研究后的结果与之前总的结果合并效应量变化不大,说明该项研究存在偏倚,但偏倚影响不大,结果比较稳健。提示消癌平注射液联合化疗较对照组可以显著提高患者用药后KPS评分。见图 6。

|
| 图 6 试验组与对照组KPS评分变化的Meta分析 Fig. 6 Meta-analysis of KPS score between treatment group and control group |
最终纳入的文献中提到的常见不良反应主要有消化道反应、白细胞下降、血红蛋白下降、血小板下降。消化道不良反应共纳入11篇文献[2, 6-7, 9-10, 13, 17, 21, 24-26],异质性检验:Chi2=11.60,P=0.31,I2=14%,采用固定效应模型进行分析,RR=0.64,95%CI(0.56,0.74),P < 0.000 01,差异具有统计学意义。纳入文献中有15篇[2, 6-10, 12-13, 15, 17-18, 20, 23-25]报告了不良反应白细胞下降,共纳入1 073例患者,试验组540例,对照组533例。各试验研究之间存在异质性(Chi2=26.8,P=0.02,I2=47%),采用随机效应模型进行统计学分析得RR=0.74,95%CI(0.64,0.86),P < 0.000 01,两组间差异具有统计学意义。12篇文献[6-9, 12-13, 15, 17-18, 20, 23, 25]报道了两组治疗后血红蛋白下降情况,纳入896例患者,试验组451例,对照组445例。异质性检验各组研究间具有统计学同质性(Chi2=8.66,P=0.65,I2=0%),采用固定效应模型进行统计分析,RR=0.72,95%CI(0.62,0.83),P < 0.000 01,组间具有统计学差异。血小板下降共纳入15篇文献[2, 6-10, 12-13, 15, 17-18, 20, 23-25],异质性检验:Chi2=22.16,P=0.08,I2=37%,选用随机效应模型进行统计分析,RR=0.57,95%CI(0.40,0.80),P=0.001,组间差异具有统计学意义。综合以上Meta分析结果,消癌平注射液联合化疗对比单纯化疗组,不良反应的发生率更低,在化疗同时联合使用消癌平注射液,具有一定的安全性。
2.3.2.2 免疫功能在纳入的文献中,共有2篇文献[8, 22]报告了免疫功能,其中均涉及的免疫指标为:CD3+、CD4+/CD8+。对CD3+进行Meta分析,结果具有统计学同质性(Chi2=0.02,P=0.88,I2=0%),采用固定效应模型分析,MD=11.56,95%CI(10.13,12.99),P < 0.000 01。提示治疗后试验组CD3+数值高于对照组。对CD4+/CD8+数值进行分析,结果具有显著异质性(Chi2=18.25,P < 0.000 01,I2=95%),采用随机效应模型分析,MD=0.37,95%CI(-0.09,0.83),P=0.12,差异无统计学意义。
2.3.2.3 中医症状体征张丰云等[8]的研究中对比了治疗前后试验组及对照组的症状体征(咳嗽、食欲减退、胸闷、疲乏、胸痛),两组治疗后症状体征均有不同程度改善,但改善情况组间差异无统计学意义。
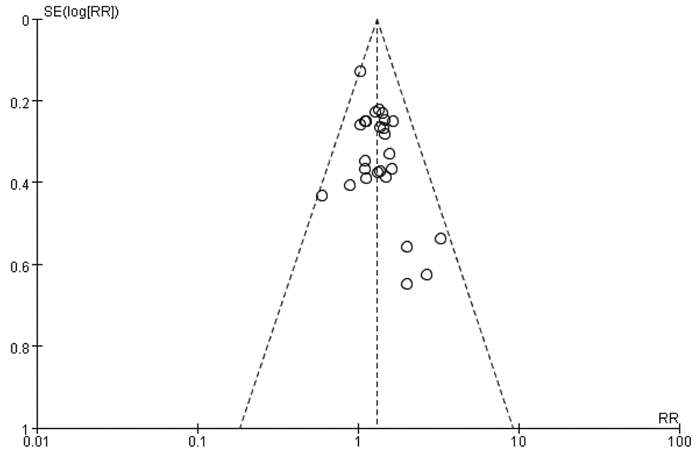
2.3.3 漏斗图分析对消癌平注射液联合化疗治疗晚期非小细胞肺癌总有效率进行偏倚分析,结果显示漏斗图分布不完全对称,提示可能存在发表偏倚及阴性结果试验未发表的情况。见图 7。
|
| 图 7 总有效率的漏斗图 Fig. 7 Funnel plot of total effective rate |
肺癌是目前最常见的恶性肿瘤之一,据2018年美国癌症统计年报显示[27],肺癌的病死率高居榜首,5 a相对生存率仅为18%。在肺癌的发病中非小细胞肺癌以84%列居首位,约70%的患者就诊时已属晚期,失去了手术治疗的机会[27-28]。目前化疗仍是非小细胞肺癌主要的治疗方法,但多药耐药性(MDR)的产生降低了化疗疗效甚或导致化疗失败,此外化疗也会给患者带来诸如骨髓抑制、胃肠道反应等不良反应,影响化疗进程、限制化疗剂量。因此在晚期非小细胞肺癌患者的治疗过程中,增敏提效、改善生活质量、降低不良反应变得尤为重要。
中医药是中华传统文化衍生出的珍宝,中医药的多种活性成分通过多途径、多靶点在肿瘤的治疗中起到减毒增效的作用,在推动机体抗御外邪、增强疗效、逆转耐药、减轻不良反应方面独具特色,近年来中西医结合治疗肿瘤也成为领域研究热点。
消癌平注射液主要成分为乌骨藤提取物,单味多组分,具有清热解毒,化痰软坚的功效。乌骨藤又名通光藤、通关散等[29],最早记载于《滇南本草》。现代药理学研究证实乌骨藤具有抗癌、免疫调节、平喘、保肝、利尿等作用[30]。乌骨藤成分复杂,含C21甾体皂苷、萜类化合物、酚酸、多糖、醇类等物质,以往主要用于支气管炎、哮喘等疾病治疗,近年其制剂消癌平注射液因具有明显的抗肿瘤特性,在临床用于多种肿瘤的辅助治疗,具有增强机体免疫功能[31]、抑制肿瘤细胞增殖[32]、诱导细胞分化、促进细胞凋亡[33]、抗肿瘤血管生成[34]、减轻不良反应[35]等作用。且因消癌平注射液可阻断肿瘤的细胞周期,使肿瘤细胞增殖停留于M期,故而对化疗具有一定的增敏效果。
本Meta分析的结果表明:消癌平注射液对于晚期非小细胞肺癌的治疗具有一定疗效,且能减轻不良反应的发生。在纳入的研究中,仅有4项报告了生存事件,然而这些研究中出现了不同的结果,所以尚不能为消癌平注射液联合化疗治疗晚期非小细胞肺癌的远期疗效给出定论。本研究存在一定的局限性:1)所有检索的文献均由电子数据库内检出,未进行手工检索,可能存在因检索策略的不完善而导致的文献检索不全;2)所有的研究均未提及样本量估算,很多试验的样本量较小,仅3项研究样本量大于100例,可能导致检验效能低;3)纳入文献的质量较低,存在偏倚风险,影响数据结果的科学性;4)纳入的文献中只有7项研究报告了随机分组方法,所有的研究均未提及盲法、是否存在破盲风险及分配隐藏,并且对随访病例未进行明确报告;5)部分文献之间的异质性偏高。以上各项因素均可能对结果的可靠性造成影响。
本研究纳入的文献缺乏高质量临床试验,原因可能是在研究过程中存在偏倚。纳入的文献中没有统一的标准化治疗方案,存在治疗疗程不统一、中药给药介入时机不统一。且文献中对盲法的应用均未提及,可能是与本研究盲法较难实行,或者研究者忽视了盲法有关。本Meta分析纳入的研究文献异质性偏高,可能是由于研究中存在化疗方案不同、用药疗程不同等问题。综上所述,虽然目前的证据显示消癌平注射液联合化疗可以提高临床疗效并减轻不良反应,但因纳入的文献质量较低,存在局限性,故仍需大样本、多中心、双盲、平行对照临床试验数据支持,更好地评价消癌平注射液辅助治疗的有效性及安全性。
| [1] |
董南. 多西紫杉醇联合消癌平注射液二线治疗晚期NSCLC的效果分析[J]. 中国实用医药, 2015, 10(5): 140-141. |
| [2] |
王帅兵, 刘威威, 齐秀恒, 等. 多西紫杉醇联合消癌平注射液二线治疗晚期非小细胞肺癌的临床观察[J]. 现代中西医结合杂志, 2013, 22(30): 3334-3336. DOI:10.3969/j.issn.1008-8849.2013.30.010 |
| [3] |
吴宏林. 多西紫杉醇联合消癌平注射液二线治疗晚期非小细胞肺癌的效果评价[J]. 中国医药指南, 2016, 14(15): 171-172. |
| [4] |
张志华, 张海冬. 培美曲塞联合消癌平注射液治疗中晚期非小细胞肺癌32例临床疗效观察[J]. 中国医药指南, 2012, 10(12): 553-554. DOI:10.3969/j.issn.1671-8194.2012.12.424 |
| [5] |
赵伟. 消癌平联合多西紫杉醇治疗晚期非小细胞肺癌的疗效研究[J]. 心理医生, 2017, 23(2): 65-66. |
| [6] |
李心国, 姜晓静. 消癌平注射液联合GP方案治疗晚期非小细胞肺癌的临床观察[J]. 中国临床医生杂志, 2016, 44(10): 62-64. DOI:10.3969/j.issn.2095-8552.2016.10.022 |
| [7] |
王延涛. 消癌平注射液联合GP方案治疗晚期非小细胞肺癌的临床研究[J]. 青岛医药卫生, 2012, 44(4): 246-248. DOI:10.3969/j.issn.1006-5571.2012.04.003 |
| [8] |
张丰云, 李秋文, 管静芝, 等. 消癌平注射液联合GP方案治疗晚期非小细胞肺癌疗效观察[J]. 肿瘤基础与临床, 2011, 24(5): 415-417. DOI:10.3969/j.issn.1673-5412.2011.05.018 |
| [9] |
李清林, 程斌. 消癌平注射液联合GP化疗方案治疗晚期非小细胞肺癌临床疗效研究[J]. 中华中医药学刊, 2016, 34(4): 785-787. |
| [10] |
杨宏, 吕爽, 王珏, 等. 消癌平注射液联合NP方案治疗晚期NSCLC的临床观察[J]. 中国医药导报, 2011, 8(8): 64-65. DOI:10.3969/j.issn.1673-7210.2011.08.028 |
| [11] |
高志豪. 消癌平注射液联合TC方案治疗非小细胞肺癌晚期患者的疗效观察[J]. 当代医学, 2016, 22(25): 153-154. DOI:10.3969/j.issn.1009-4393.2016.25.101 |
| [12] |
李亚莉, 周恒根, 倪敬忠, 等. 消癌平注射液联合TC方案治疗晚期非小细胞肺癌临床观察[J]. 现代中西医结合杂志, 2015, 24(3): 316-318. DOI:10.3969/j.issn.1008-8849.2015.03.037 |
| [13] |
梅朝蓉, 王恳, 雷娜, 等. 消癌平注射液联合TP方案治疗晚期非小细胞肺癌的临床观察[J]. 中国药房, 2015, 24(11): 1531-1533. DOI:10.6039/j.issn.1001-0408.2015.11.31 |
| [14] |
夏国安. 消癌平注射液联合TP方案治疗晚期非小细胞肺癌临床观察[J]. 临床医药实践, 2013, 22(2): 83-85. DOI:10.3969/j.issn.1671-8631.2013.02.001 |
| [15] |
沈李伟, 邱文生, 兰传鑫, 等. 消癌平注射液联合TP化疗治疗晚期非小细胞肺癌疗效观察[J]. 中外医学研究, 2015, 13(32): 8-9. |
| [16] |
刘爱芳. 消癌平注射液联合化疗治疗晚期非小细胞肺癌的疗效体会[J]. 临床医药文献电子杂志, 2016, 3(22): 4415-4416. |
| [17] |
方欢, 王静, 潘春峰, 等. 消癌平注射液联合化疗治疗晚期非小细胞肺癌的临床观察[J]. 中国医院用药评价与分析, 2013, 13(2): 165-168. |
| [18] |
张瑞星, 岳江涛, 王天平, 等. 消癌平注射液联合化疗治疗晚期非小细胞肺癌的临床观察[J]. 肿瘤基础与临床, 2012, 25(5): 438-440. DOI:10.3969/j.issn.1673-5412.2012.05.026 |
| [19] |
姜子瑜, 李灵常. 消癌平注射液联合化疗治疗晚期非小细胞肺癌临床分析[J]. 内蒙古中医药, 2017, 36(23): 100-101. DOI:10.3969/j.issn.1006-0979.2017.23.081 |
| [20] |
宋宇, 钱晓兰, 王少开, 等. 消癌平注射液联合化疗治疗晚期非小细胞肺癌临床疗效评价[J]. 中医临床研究, 2016, 8(36): 122-123. DOI:10.3969/j.issn.1674-7860.2016.36.053 |
| [21] |
石磊, 杨卫兵, 柏玉举, 等. 消癌平注射液联合化疗治疗中晚期肺癌的临床分析[J]. 医药前沿, 2015, 5(26): 155-156. DOI:10.3969/j.issn.2095-1752.2015.26.130 |
| [22] |
徐建建. 消癌平注射液联合化疗治疗中晚期肺癌的临床分析[J]. 中外医疗, 2017, 36(12): 116-118. |
| [23] |
胡晓琳, 刘喜松, 陈细定. 消癌平注射液联合吉西他滨和卡铂治疗ⅢB和Ⅳ期非小细胞肺癌的临床评价[J]. 药物评价研究, 2017, 40(2): 262-265. |
| [24] |
朱丹. 消癌平注射液联合间断化疗对老年晚期非小细胞肺癌的治疗效果观察[J]. 中国医药指南, 2017, 15(36): 206-207. |
| [25] |
杨万全, 王恳. 消癌平注射液联合间断化疗治疗老年晚期非小细胞肺癌[J]. 肿瘤基础与临床, 2013, 26(6): 495-497. |
| [26] |
瞿红英. 多西紫杉醇联合消癌平注射液二线治疗晚期NSCLC的疗效观察[J]. 世界最新医学信息文摘, 2015, 15(A5): 11-12. |
| [27] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. DOI:10.3322/caac.21442 |
| [28] |
石远凯, 孙燕, 丁翠敏, 等. 中国埃克替尼治疗非小细胞肺癌专家共识(2016年版)[J]. 中国肺癌杂志, 2016, 19(7): 489-494. |
| [29] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015: 296-297.
|
| [30] |
白爽, 李奕诺, 徐鑫, 等. 乌骨藤化学成分及药理活性研究进展[J]. 解放军药学学报, 2015, 31(3): 260-264. |
| [31] |
杨洪枢, 张科军, 宋程浩, 等. 消癌平注射液对原发性肝癌术前患者机体免疫功能的影响[J]. 中华中医药学刊, 2015, 33(6): 1438-1440. |
| [32] |
韩淑燕, 郑文献, 何曦冉, 等. 消癌平注射液联合吉非替尼对耐药非小细胞肺癌H460和H1975裸鼠移植瘤的抑制作用[J]. 中国药理学与毒理学杂志, 2016, 30(1): 44-52. DOI:10.3867/j.issn.1000-3002.2016.01.007 |
| [33] |
郑爱文, 李涛, 陈雅卿, 等. 消癌平联合顺铂对高转移人卵巢癌HO-8910PM细胞的抑制作用[J]. 中华肿瘤杂志, 2016, 38(1): 11-16. DOI:10.3760/cma.j.issn.0253-3766.2016.01.003 |
| [34] |
王美鑑, 杜丹玉, 范薇, 等. 消癌平注射液抗血管生成作用及其机制研究[J]. 药学学报, 2016, 51(2): 309-315. |
| [35] |
王峰, 樊青霞, 王洪海, 等. 消癌平注射液联合化疗治疗中晚期食管癌的疗效和安全性[J]. 中华肿瘤杂志, 2017, 39(6): 453-457. DOI:10.3760/cma.j.issn.0253-3766.2017.06.010 |
2. Graduate School, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2019, Vol. 36
2019, Vol. 36