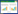文章信息
- 任桐, 朱鹏宇, 杨洪涛
- REN Tong, ZHU Pengyu, YANG Hongtao
- 水蛭素对单侧输尿管梗阻大鼠肾间质损伤及MCP-1、ICAM-1的干预效应研究
- Study on the effects of hirudin on renal interstitial fibrosis and MCP-1, ICAM-1 in unilateral ureteral obstruction rats
- 天津中医药, 2019, 36(5): 477-481
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(5): 477-481
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.05.16
-
文章历史
- 收稿日期: 2018-11-16
肾间质纤维化(RIF)属于肾脏纤维化的一部分,是慢性肾脏病(CKD)进展为终末期肾脏病(ESRD)过程中重要的病理过程。在RIF发生的早期,凝血酶可通过激活肾间质内毛细血管内皮细胞表面蛋白酶激活受体(PAR-1),引起肾间质内毛细血管内皮细胞产生一系列趋化因子及黏附分子如单核细胞趋化蛋白-1(MCP-1)、细胞间黏附分子-1(ICAM-1)等,致使单核/巨噬细胞等炎症反应细胞向肾间质迁移浸润,进一步释放转化生长因子-β1(TGF-β1)等细胞因子,最终引起RIF。本实验从凝血酶这一角度入手,旨在探讨水蛭素对肾间质纤维化过程的干预机制。
1 实验材料与方法 1.1 实验材料 1.1.1 实验动物健康雄性SD大鼠,体质量(180±20)g,购自北京华阜康生物科技有限公司。
1.1.2 实验药物天然水蛭素冻干粉,购自湖北武汉胜天宇生物科技有限公司;盐酸贝那普利片,购自北京诺华制药有限公司。
1.1.3 实验仪器BX60显微镜,购自OLYMPUS;Mini-PROTEAN 3电泳芯,购自Bio-Rad;FluorChem FC2 Imaging System,购自Alpha Innotech;Epgiadients PCR仪,购自Eppendorf;ABI 7500 fast荧光定量PCR仪,购自Life Technologies。
1.1.4 实验试剂10%甲醛溶液、二甲苯、系列乙醇、中性树胶,购自天津血液研究所病理科;牛血清白蛋白(BSA,V900933),购自Sigma-Aldrich;All-in-OneTM First-Strand cDNA Synthesis Kit(AORT-0060),购自GeneCopoeia;Trizol(115596026)、Platinum®SYBR®Green qPCR SuperMix-UDG(C11733-046),购自invitrogen;苏木精-伊红(HE)染色试剂盒(G1120)、RIPA裂解缓冲液(R0010),购自北京索莱宝科技有限公司;BCA蛋白定量分析试剂盒(NCI3225CH),购自Thermo Fisher;PVDF膜(IPVH00010),购自Millipore;ECL(sc-2048),购自Santa Cruz;兔抗大鼠MCP-1多克隆抗体(ab25124)、兔抗大鼠ICAM-1多克隆抗体(ab124760)、辣根过氧化物酶标记的山羊抗兔IgG多克隆抗体(ab6721),购自abcam。
1.2 实验方法 1.2.1 分组方案健康雄性SD大鼠120只,体质量(180±20)g,随机分为假手术组、模型组、水蛭素高剂量组、水蛭素低剂量组、贝那普利组,每组各24只。
1.2.2 大鼠UUO模型制备对模型组、水蛭素高剂量组、水蛭素低剂量组、贝那普利组均建立大鼠UUO模型:大鼠经腹腔注射10%水合氯醛溶液麻醉后固定,于下腹部正中位置切口1.5 cm,游离左侧输尿管并结扎切断,使左肾完全梗阻。对假手术组仅游离左侧输尿管,不结扎切断。术后每只大鼠均应用20万单位青霉素注射行抗感染治疗3 d。
1.2.3 实验过程术后第1天起,水蛭素高剂量组均给予水蛭素(84 U/kg,1次/日)皮下注射,水蛭素低剂量组均给予水蛭素(42 U/kg,1次/日)皮下注射,贝那普利组均给予盐酸贝那普利片溶于生理盐水后(2 mL,1次/日)灌胃,假手术组、模型组均给予生理盐水(2 mL,1次/日)皮下注射。每组分别于术后第3、7、14天时,随机选择8只大鼠处死,取梗阻侧肾组织,部分制作石蜡切片以备病理检测,其余部分放入液氮保存并制作冰冻切片,以备逆转录-聚合酶链反应(RT-PCR)及蛋白免疫印迹(Western Blot)检测。
1.2.4 病理检测用二甲苯、系列乙醇将石蜡切片脱蜡并水化;加入苏木素染液,室温下静置20 min;自来水冲洗5 min;加入分化液,室温下静置30 s;浸入自来水15 min;加入伊红染液2 min;自来水冲洗5 min;自来水浸泡5 min;脱水、透明、封片,镜下观察其肾小管等肾间质结构形态变化、淋巴细胞、单核/巨噬细胞浸润情况及纤维组织形态。
1.2.5 RT-PCR检测取出100 mg冰冻组织保存于Eppendorf管中;加入1 mL Trizol溶液,用电动匀浆机进行匀浆;室温下静置15 min;加入0.2 mL三氯甲烷,振荡混匀;室温下静置10 min后,4 ℃下离心(12 000 r/min,10 min);取上清液转移至另一新Eppendorf管中;加入0.5 mL异丙醇,在室温下静置10 min后,4 ℃下离心(12 000 r/min,10 min);弃去上清液,用无水乙醇洗涤沉淀物2次,每次5 min,4℃下离心(8 000 r/min,10 min);室温下干燥;加入100 μL DEPC水以重悬;按照试剂盒说明书,用All-in-OneTM First-Strand cDNA Synthesis Kit进行反转录,用Platinum®SYBR®Green qPCR SuperMix-UDG进行扩增;取扩增产物5 μL,琼脂糖凝胶电泳,凝胶成像系统观察结果,用β-actin作参照,MCP-1、ICAM-1相对表达水平采用2-ΔΔCT公式计算[1]。
1.2.6 Western Blot检测采用Western Blot方法检测肾组织中MCP-1、ICAM-1的表达。方法如下:取出冰冻组织,加入RIPA裂解缓冲液,冰上匀浆,4 ℃下离心(12 000 r/min,20 min)后保存于Eppendorf管中;取50 μL裂解物,测定蛋白质浓度;取等量蛋白质及β-Actin进行SDS-PAGE,100 V下电泳1 h;转移至PVDF膜;加入含5%奶粉的TBST溶液室温下静置1 h;加入含5%奶粉的TBST溶液稀释一抗,4 ℃下孵育过夜;用TBST冲洗PVDF膜3次,每次5 min;加入含5%奶粉的TBST溶液稀释二抗,室温下孵育1 h;用TBST冲洗PVDF膜3次,每次5 min;用TBS冲洗PVDF膜5 min;加入ECL,室温下避光静置10 min以显色;曝光显影。
1.2.7 统计学方法实验所得数据采用SPSS 22.0统计软件进行分析。数据以均数±标准差(x±s)表示,数据多组间比较采用单因素方差分析(one-way Anova),组间两两比较采用LSD法,以P < 0.05认为差异有统计学意义。
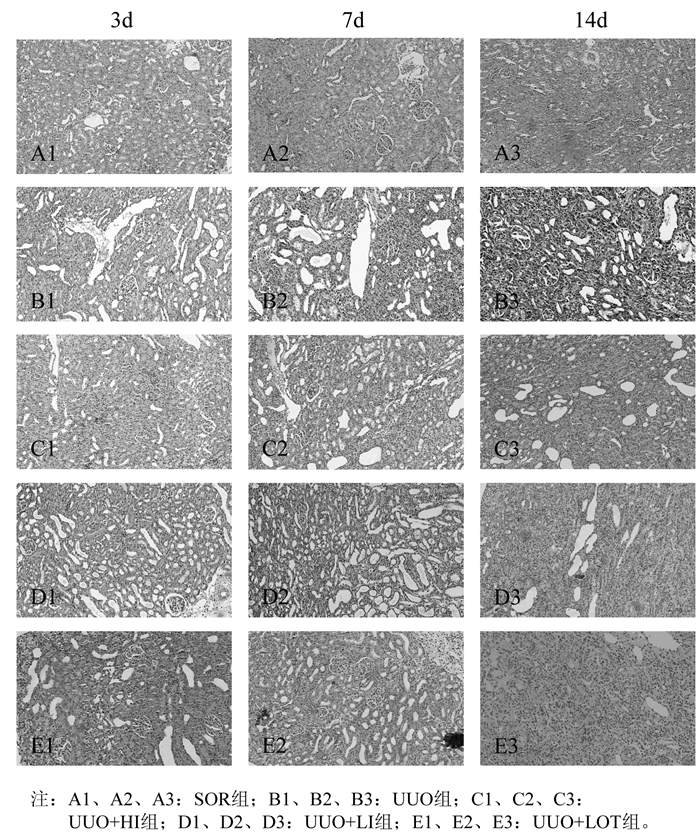
2 结果 2.1 HE染色结果假手术组术后各时间点未见明显病理改变。模型组自术后第3天可见肾小管轻度扩张,肾间质轻度水肿,单核/巨噬细胞少量浸润;第7天可见肾小管进一步扩张,肾小管上皮细胞空泡变性,肾间质内单核/巨噬细胞等炎症细胞浸润增多,纤维组织轻度增生;第14天可见肾皮质、髓质变薄,肾小管结构破坏,出现肾小管萎缩,基底膜部分消失,肾小管上皮细胞坏死,纤维组织明显增生,肾间质内淋巴细胞、单核/巨噬细胞大量浸润。与模型组相比:水蛭素高剂量组、水蛭素低剂量组、贝那普利组肾间质损伤均有不同程度减轻。具体见图 1。
|
| 图 1 HE染色结果(×200倍) Fig. 1 HE staining results (× 200) |
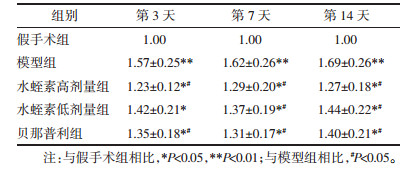
与假手术组相比:模型组各时间点及水蛭素低剂量组第3、7天MCP-1蛋白质相对表达量显著增加(P < 0.01);水蛭素高剂量组、贝那普利组第3、7天及水蛭素低剂量组第14天MCP-1蛋白质相对表达量增加(P < 0.05)。与模型组相比,水蛭素高剂量组第14天MCP-1蛋白质相对表达量显著减少(P < 0.01);水蛭素高剂量组第3、7天及贝那普利组第3、14天MCP-1蛋白质相对表达量减少(P < 0.05)。具体见表 1。
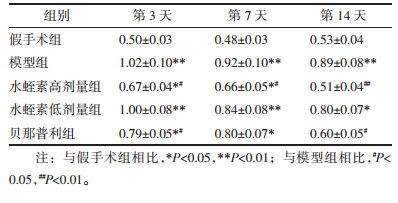
与假手术组相比:模型组各时间点ICAM-1蛋白质相对表达量均显著增加(P < 0.01);水蛭素低剂量组、贝那普利组各不同时间点ICAM-1蛋白质相对表达量均增加(P < 0.05)。与模型组相比:水蛭素高剂量组第7天ICAM-1蛋白质相对表达量显著减少(P < 0.01);水蛭素高剂量组第3、14天及水蛭素低剂量组第14天、贝那普利组各不同时间点ICAM-1蛋白质相对表达量均减少(P < 0.05)。具体见表 2。
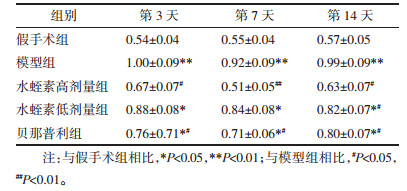
与假手术组相比:模型组各时间点、贝那普利组第3天MCP-1 mRNA相对表达量显著升高(P < 0.01);水蛭素高剂量组、水蛭素低剂量组各不同时间点及贝那普利组第7、14天MCP-1 mRNA相对表达量升高(P < 0.05)。与模型组相比:水蛭素高剂量组第7、14天MCP-1 mRNA相对表达量显著降低(P < 0.01);水蛭素高剂量组第3天及水蛭素低剂量组、贝那普利组各不同时间点MCP-1 mRNA相对表达量降低(P < 0.05)。具体见表 3。
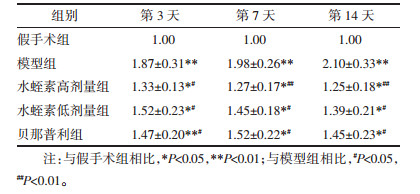
与假手术组相比:模型组各不同时间点ICAM-1 mRNA相对表达量均显著升高(P < 0.01);水蛭素高剂量组、水蛭素低剂量组及贝那普利组ICAM-1 mRNA相对表达量均升高(P < 0.05)。与模型组相比:水蛭素高剂量组、贝那普利组各不同时间点及水蛭素低剂量组第7、14天ICAM-1 mRNA相对表达量均降低(P < 0.05)。具体见表 4。
作为CKD进展为ESRD的主要病理过程,RIF一直是研究的热点。目前,尚未发现能抑制甚至逆转RIF过程的特效药物。RIF的主要表现包括细胞外基质(ECM)增多与肾小管上皮细胞转分化(TEMT)。
CKD进展至ESRD过程中,肾脏长期处于缺血、缺氧状态。有害内环境可使氧自由基、细胞因子、内毒素及凝血酶等浓度升高。其中,凝血酶能激活肾间质毛细血管内皮细胞表面PAR-1,进而激活多种信号通路,导致肾间质毛细血管内皮细胞释放大量细胞因子、黏附分子如MCP-1、ICAM-1等,引起一系列病理过程,如Grandaliano等[1]的研究表明PAR-1表达的增加与纤溶酶原激活物抑制剂-1(PAI-1)表达的减少能促进RIF发生过程中ECM的蓄积;Mercer等[2]的研究证实在肺纤维化过程中PAR-1的激活能诱导肺泡上皮细胞释放MCP-1增多,进而从多种途径引起肺纤维化;Rahman等[3]的研究证实PAR-1能激活毛细血管内皮细胞核转录因子-κB(NF-κB)信号通路,从而促进ICAM-1转录。由上述研究可知PAR-1的激活能诱导细胞MCP-1、ICAM-1表达上调,这与对应器官纤维化过程有着密切的联系。
MCP-1对单核/巨噬细胞有趋化和激活作用[4];ICAM-1主要功能是使单核细胞激活并与内皮细胞紧密黏附后穿出血管壁到达炎症部位[5]。肾间质内毛细血管内皮细胞释放MCP-1、ICAM-1后可引起单核/巨噬细胞激活并定向迁移、穿出毛细血管壁到达肾间质中,引起一系列炎症反应。激活的单核/巨噬细胞能释放TGF-β1,而TGF-β1已被大量研究证实能引起ECM分泌增多,能促进肾间质纤维化的发生与发展。Yang等[6]的研究证实TGF-β1能诱导TEMT;而Zheng等[7]的研究则证实MCP-1可直接作用于肾小管上皮细胞,引起TEMT发生。与此同时,MCP-1与ICAM-1能直接影响ECM的合成,如Lee等[8]的研究指出在MCP-1能诱导腹膜间皮细胞发生EMT及ECM过度积聚;Paccosi等[9]的研究则表明应用MCP-1合成抑制剂可抑制肾功能恶化过程,且这一作用可能与其减少了肾间质中ECM过度沉积有关。ICAM-1在诱导单核/巨噬细胞激活与黏附过程之外,也能通过诱导ECM过度沉积导致肾功能恶化,如Janssen等[10]使用ICAM-1基因敲除小鼠证实了ICAM-1在肾损伤过程中可导致ECM过度沉积及肾功能进行性恶化。
结合目前研究现状,设计了本实验,旨在研究通过对凝血酶的干预,是否能对与RIF密切相关的MCP-1、ICAM-1两种标志物造成影响,从而在一定程度上抑制RIF的发生、发展,并研究凝血酶抑制剂水蛭素在上述一系列病理过程中的保护性作用。从MCP-1、ICAM-1等方面入手,以UUO大鼠为模型,进行了为期14 d的研究。结果显示:水蛭素高剂量组及水蛭素低剂量组均能不同程度地减轻UUO模型大鼠肾间质损伤程度并抑制MCP-1、ICAM-1的表达,且水蛭素高剂量组相比水蛭素低剂量组有着更好的效果。在相同的剂量下,随着给药时间的延长,水蛭素对MCP-1、ICAM-1表达的抑制作用可持续增强,如水蛭素低剂量组第3天ICAM-1 mRNA相对表达量及第3、7天ICAM-1蛋白质相对表达量无统计学意义(P > 0.05),但在第14天时,水蛭素低剂量组ICAM-1 mRNA及蛋白质相对表达量相比模型组均有一定降低(P < 0.05)。
综上所述,通过本实验研究,可得出如下结论:水蛭素能不同程度地减轻UUO模型大鼠肾间质损伤程度并下调MCP-1、ICAM-1 mRNA及蛋白质的表达,且水蛭素高剂量组的下调作用更强。因此,水蛭素能在一定程度上下调RIF发生过程中肾间质血管内皮细胞表达的趋化因子、黏附因子水平,从而抑制单核/巨噬细胞趋化与激活,减轻单核/巨噬细胞浸润及炎症反应,达到抑制肾间质纤维化发生、发展的目的。其作用机制或与水蛭素抑制UUO模型大鼠肾间质血管内皮细胞凝血酶活性,进而下调肾间质MCP-1、ICAM-1 mRNA及蛋白的表达有关。
| [1] |
Grandaliano G, Di Paolo S, Monno R, et al. Protease-activated receptor 1 and plasminogen activator inhibitor 1 expression in chronic allograft nephropathy:the role of coagulation and fibrinolysis in renal graft fibrosis[J]. Transplantation, 2001, 72(8): 1437-1443. |
| [2] |
Mercer PF, Johns RH, Scotton CJ, et al. Pulmonary epithelium is a prominent source of proteinase-activated receptor-1-inducible CCl2 in pulmonary fibrosis[J]. American Journal of Respiratory and Critical Care Medicine, 2009, 179(5): 414-425. DOI:10.1164/rccm.200712-1827OC |
| [3] |
Rahman A, True AL, Anwar KN, et al. Gαq and Gβγ regulate PAR-1 signaling of thrombin-induced NF-κB activation and ICAM-1 transcription in endothelial Cells[J]. Circulation Research, 2002, 91(5): 398-405. |
| [4] |
Denton, Shi W, Sutton, et al. Scleroderma fibroblasts promote migration of mononuclear leucocytes across endothelial cell monolayers[J]. Clinical & Experimental Immunology, 1998, 114(2): 293-300. |
| [5] |
Shi C, Velázquez P, Hohl TM, et al. Monocyte trafficking to hepatic sites of bacterial infection is chemokine independent and directed by focal intercellular adhesion molecule-1 expression[J]. The Journal of Immunology, 2010, 184(11): 6266-6274. |
| [6] |
Yang J, Liu Y. Dissection of key events in tubular epithelial to myofibroblast transition and its implications in renal interstitial fibrosis[J]. Am J Pathol, 2001, 159(4): 1465-1475. |
| [7] |
Zheng F, Wen X, Li X, et al. Synergistic effect of monocyte chemotactic protein-1 and aristolochic acid Ⅰ on transdifferentiation of human tubular epithelial cells in vitro[J]. Zhonghua Nei Ke Za Zhi, 2000, 39(12): 831-834. |
| [8] |
Lee SH, Kang HY, Kim KS, et al. The monocyte chemoattractant protein-1(MCP-1)/CCR2 system is involved in peritoneal dialysis-related epithelial-mesenchymal transition of peritoneal mesothelial cells[J]. Lab Invest, 2012, 92(12): 1698-1711. DOI:10.1038/labinvest.2012.132 |
| [9] |
Paccosi S, Musilli C, Mangano G, et al. The monocyte chemotactic protein synthesis inhibitor bindarit prevents mesangial cell proliferation and extracellular matrix remodeling[J]. Pharmacol Res, 2012, 66(6): 526-535. DOI:10.1016/j.phrs.2012.09.006 |
| [10] |
Janssen U, Ostendorf T, Gaertner S, et al. Improved survival and amelioration of nephrotoxic nephritis in intercellular adhesion molecule-1 knockout mice[J]. J Am Soc Nephrol, 1998, 9(10): 1805-1814. |
 2019, Vol. 36
2019, Vol. 36