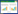文章信息
- 杨杰
- YANG Jie
- 芹菜素对慢性肾功能衰竭大鼠贫血和电解质代谢紊乱的影响
- Effects of apigenin on anemia and disorders of electrolyte metabolism in chronic renal failure rats
- 天津中医药, 2019, 36(5): 482-485
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(5): 482-485
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.05.17
-
文章历史
- 收稿日期: 2018-11-19
慢性肾功能衰竭(CRF)是各种慢性肾脏疾病持续进展的共同结局,电解质代谢紊乱、内分泌失调、酸碱失衡以及贫血是其早期主要的临床表现[1-3]。芹菜素(APG)是一种具有广泛生物学活性的天然存在的黄酮类化合物,在多种水果蔬菜中均含量丰富,王珂等[4]和王强等[5]研究发现黄酮类化合物对CRF大鼠具有一定的保护作用,本实验将通过复制CRF模型大鼠并腹腔注射给予APG进行治疗,通过相关指标检测并对比正常对照组、模型组实验数据,探讨APG对CRF大鼠贫血和电解质代谢紊乱的影响。
1 材料与方法 1.1 实验动物健康无特定病原体(SPF级)雄性SD大鼠(8周龄,220~260 g)购自河北省实验动物中心[SCXK(冀)2013-1-003]。饲养环境:23~25 ℃、相对湿度55%~60%,光照周期12 h:12 h。
1.2 药物与试剂芹菜素(陕西慧科植物开发有限公司,批号:170329);血清铁(SI)、总铁结合力(TIBC)测定试剂盒(北京博奥森生物技术有限公司,批号:071128、070916);铁蛋白(FER)酶联免疫吸附法(ELISA)测定试剂盒(美国R&D公司,E01627);血尿素氮(BUN)、血肌酐(SCr)、尿素(UA)测定试剂盒(深圳迈瑞生物医疗电子股份有限公司,批号:201711012、201710025、201705023);腺嘌呤(国药集团化学试剂有限公司)。
1.3 实验方法 1.3.1 分组、造模与给药取100只实验用大鼠按照随机数字表法随机分为正常对照组、模型组、APG低剂量组[10 mg/(kg·d)]、APG中剂量组[20 mg/(kg·d)]、APG高剂量组[40 mg/(kg·d)]组,每组20只。复制CRF大鼠模型[6]:制备25%腺嘌呤溶液,连续灌胃21 d [250 mg/(kg·d)]以制备CRF大鼠模型,造模结局判断[7]:SCr水平高于正常高值,肾脏组织呈现炎性细胞浸润、肾间质纤维化等病理性改变,即造模成功。造模完成后,APG各剂量组腹腔注射给药治疗(1次/日),正常对照组和模型组同步腹腔注射给予生理盐水,疗程28 d。
1.3.2 肾功能指标检测麻醉后经腹主动脉取血(不做抗凝处理),1 500 r/min离心10 min取血清,通过生化分析仪测定血清中BUN、SCr、UA含量。
1.3.3 肾脏指数的计算称量各组大鼠体质量,麻醉后开腹摘取两侧肾脏组织,生理盐水冲洗干净后称量左侧肾脏质量,然后进行计算,肾脏指数=左侧肾脏质量/体质量。
1.3.4 贫血监测指标参照1.3.2方法取血,血常规分析仪测定全血红细胞(RBC)、血红蛋白(HGB)、红细胞压积(HCT);1 500 r/min离心10 min取血清,通过生化分析仪测定各组大鼠血清中SI、TIBC、FER含量。
1.3.5 电解质测定经腹主动脉取血并分离血清后通过化分析仪测定血清K+、Na+、Ca2+、P3+含量。
1.3.6 肾脏组织病理学检查取右侧肾脏组织,置4%多聚甲醛溶液进行固定,72 h后进行石蜡包埋和切片,脱蜡水化处理后行常规HE染色[依次进行乙醇梯度脱蜡、磷酸盐缓冲液(PBS)洗涤、苏木素染色5 min、0.5%乙醇盐酸分色、伊红染色20 s等步骤],通过光学显微镜观察肾脏组织形态。
1.4 统计学处理运用软件SPSS 18.0进行数据统计分析,实验数据采用均数±标准差(x±s)方式表示,多组间均数比较采用单因素方法分析,组间两两比较采用LSD法,P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠肾功能检测结果比较模型组大鼠血清BUN、SCr、UA含量较正常对照组均显著升高(P < 0.01);与模型组比较,APG中、高剂量组CRF大鼠血清经治疗28 d后BUN、SCr、UA含量均显著降低,差异有统计学意义(P < 0.05或P < 0.01)。见表 1。
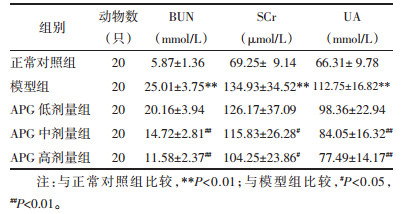
模型组大鼠体质量、肾脏指数较正常对照组显著升高(P < 0.01);与模型组比较,APG高剂量组CRF大鼠经治疗28 d后体质量升高(P < 0.05),APG中、高剂量组肾脏指数显著降低(P < 0.01)。见表 2。
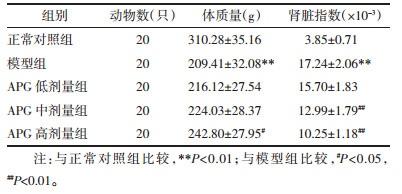
模型组大鼠RBC、HGB、HCT、SI、TIBC、FER较正常对照组均显著降低(P < 0.01);与模型组比较,APG中、高剂量组CRF大鼠经治疗28 d后HGB、HCT、SI、TIBC、FER显著升高,且高剂量组RBC显著升高,差异具有统计学意义(P < 0.05或P < 0.01)。见表 3。
模型组大鼠血清Ca2+含量较正常对照组显著降低且K+、Na+、P3+含量显著升高(P < 0.01);与模型组比较,APG中、高剂量组CRF大鼠经治疗28 d后血清Ca2+含量显著升高(P < 0.05),P3+含量显著降低且高剂量组K+、Na+含量显著降低(P < 0.05或P < 0.01)。见表 4。
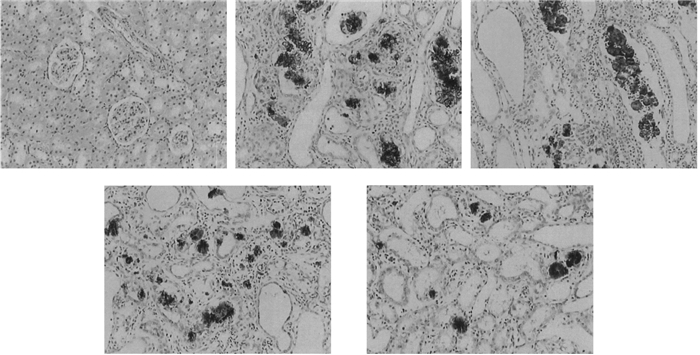
正常对照组大鼠肾脏组织结构和细胞形态均未见异常;与正常对照组比较,模型组大鼠肾脏组织呈现明显的病理性改变,主要表现为肾小球数量减少、球囊粘连、囊腔扩大、肾小管坏死、大量炎症细胞和出现、中性粒细胞浸润等;较模型组,经APG中、高剂量组治疗28 d后CRF大鼠肾脏组织病变明显改善,改善效果以高剂量组最为显著。见图 1。
|
| A.正常对照组;B.模型组;C. APG低剂量组;D. APG中剂量组;E. APG高剂量组 图 1 肾脏组织病理学检查结果(HE,×400) Fig. 1 The histopathological examination results of renal tissue (HE, ×400) |
流行病学调查发现CRF发病率达568/100万,具有不可逆及持续进展的特点,是主要致死原因之一[8],是临床上亟待解决的医学难题之一。高浓度腺嘌呤持续摄入是常用的CRF大鼠模型造模方法[7],该方法制作的CRF大鼠模型异常新陈代谢与人类CRF临床表现及病理改变相似[9];该制作方法的机制主要与腺嘌呤代谢形成极难溶于水的2,8-二羟基腺嘌呤,沉积于肾小管并堵塞肾小管腔,影响氮质化合物的排泄,导致氮质血症、毒素蓄积、电解质代谢紊乱而最终引起肾功能衰竭[10],此外还可能与2,8-二羟基腺嘌呤阻塞肾小管而引发肾脏组织炎症反应和氧化应激有关[11]。肾功能指标(BUN、SCr、UA)异常、电解质(P3+、K+、Na+、Ca2+)代谢紊乱、贫血以及肾脏组织病变是CRF的主要临床表现[12]。本实验结果显示,模型组大鼠血清BUN、SCr、UA显著升高,Ca2+含量显著降低且K+、Na+、P3+含量显著升高,贫血监测指标明显异常,肾脏组织病理性改变,提示造模成功。
本实验采用腺嘌呤连续灌胃21 d的方法复制CRF模型大鼠,腹腔注射给予APG进行干预治疗,实验结果显示,经APG 20~40 mg/(kg·d)治疗28 d能够有效改善CRF大鼠肾功能(降低血清BUN、SCr、UA含量),降低肾脏指数,抑制肾脏组织形态和细胞结构病变,提示APG对CRF大鼠肾脏组织损伤具有抑制作用。
肾性贫血主要表现为RBC数量降低,HGB、HCT降低,SI、TIBC、FER含量降低[13-14]。SI是HGB合成的必需元素[15],贫血的发生与HGB合成受阻密切相关,因此HGB水平是评价人体是否贫血的重要指标[16]。本实验结果显示,经APG 20~40 mg/(kg·d)治疗28 d能够有效提高CRF大鼠全血RBC、HGB、HCT水平和血清中SI、TIBC、FER含量,提示APG具有抑制CRF大鼠贫血症状的作用。
电解质代谢紊乱也是CRF患者常见并发症之一,其中钙磷代谢紊乱最常见并形成低钙高磷血症[17],此外电解质代谢紊乱还可诱发继发性甲状旁腺功能亢进、血管钙化等[18]。本实验结果显示,经APG 20~40 mg/(kg·d)治疗28 d能够升高CRF大鼠血清Ca2+水平并降低P3+、K+、Na+水平,说明APG具有抑制CRF大鼠电解质代谢紊乱的作用。
综上所述,APG具有改善CRF大鼠贫血、电解质紊乱的药理学作用,可能是APG对CRF能够起到一定保护作用的机制之一。
| [1] |
贾永慧, 王艳侠, 于燕莉, 等. 消氮颗粒对腺嘌呤所致慢性肾功能衰竭模型大鼠的保护作用[J]. 中国药房, 2014, 25(39): 3653-3655. DOI:10.6039/j.issn.1001-0408.2014.39.02 |
| [2] |
尹懿, 汪东涛, 鲁路, 等. 肾功能衰竭营养胶囊改善慢性肾功能衰竭模型大鼠贫血状态的研究[J]. 时珍国医国药, 2015, 26(6): 1311-1313. |
| [3] |
郭洋洋, 谭会斌. 大蒜素对慢性肾功能衰竭大鼠贫血及血脂、电解质代谢紊乱的影响[J]. 中国中医急症, 2017, 26(9): 1545-1548. DOI:10.3969/j.issn.1004-745X.2017.09.012 |
| [4] |
王珂, 王瑞坡, 李姣, 等. 桑叶黄酮对腺嘌呤诱导大鼠高尿酸血症肾损伤的防治作用[J]. 天然产物研究与开发, 2012, 24(2): 172-175. DOI:10.3969/j.issn.1001-6880.2012.02.008 |
| [5] |
王强, 米军, 李兴平, 等. 地耳草总黄酮对5/6肾切除大鼠肾功能及组织纤维化的影响[J]. 中药药理与临床, 2013, 29(2): 61-64. |
| [6] |
肖炜, 马云, 傅江南. 慢性肾功能衰竭动物模型方法学研究现状[J]. 中国实验动物学杂志, 2002, 12(3): 176-179. DOI:10.3969/j.issn.1671-7856.2002.03.016 |
| [7] |
梁亮, 王圣志, 何学红. 参芪泄浊饮对腺嘌呤致慢性肾功能衰竭大鼠模型肾组织细胞外基质表达影响[J]. 辽宁中医药大学学报, 2015, 17(1): 27-29. |
| [8] |
赵先锋. 中医药治疗慢性肾功能衰竭研究进展[J]. 现代中西医结合杂志, 2014, 23(2): 217-220. DOI:10.3969/j.issn.1008-8849.2014.02.048 |
| [9] |
Yokozawa T, Zheng PD, Oura H, et al. Animal model of adenine-induced chronic renal failure in rats[J]. Nephron, 1986, 44(3): 230-234. DOI:10.1159/000183992 |
| [10] |
Philips FS, Thiersh JB, Bendic HA. Adenine intoxication in relation to in vivo formation and deposition of 2, 8-dioxyadenine in renal tubules[J]. J Pharmacal Exp Ther, 1990, 104(1): 20-30. |
| [11] |
阳晓, 周小舟, 魏毅, 等. 腺嘌呤致大鼠慢性肾功能不全中氧自由基的作用[J]. 中国危重病急救医学, 1996, 8(8): 455-457. DOI:10.3760/j.issn:1003-0603.1996.08.003 |
| [12] |
刘辉, 黄国钧, 聂娜. 慢性肾功能衰竭大鼠模型检测指标研究进展[J]. 辽宁中医药大学学报, 2010, 12(5): 141-143. |
| [13] |
胡志娟, 郭岚, 宗毅, 等. 急、慢性肾功能衰竭病人血清铁蛋白及甲状旁腺素水平的变化[J]. 中国老年学杂志, 2009, 29(15): 1957-1958. DOI:10.3969/j.issn.1005-9202.2009.15.042 |
| [14] |
郭慧娟, 尚晓泓. 慢性肾功能衰竭铁参数与贫血的关系[J]. 中国医药导报, 2008, 5(36): 84-85. DOI:10.3969/j.issn.1673-7210.2008.36.054 |
| [15] |
郑善銮, 于文彬, 杨友贵, 等. 贫血患者红细胞免疫功能的探讨[J]. 细胞与分子免疫学杂志, 2003, 19(6): 613. DOI:10.3321/j.issn:1007-8738.2003.06.036 |
| [16] |
朱金芳, 冯崴, 马小华, 等. 阿胶铁口服液改善营养性贫血的功能研究[J]. 新疆医科大学学报, 2007, 30(8): 797-799. DOI:10.3969/j.issn.1009-5551.2007.08.005 |
| [17] |
陈俊蓉, 陈利国, 谢林林. 关于腺嘌呤慢性肾功能衰竭实验模型的思考[J]. 实验动物科学, 2013, 30(2): 65-67. DOI:10.3969/j.issn.1006-6179.2013.02.015 |
| [18] |
Cernaro V, Santoro D, Lacquaniti A, et al. Phosphate binders for the treatment of chronic kidney disease:role of iron oxyhydroxide[J]. Int J Nephrol Renovasc Dis, 2016, 2(9): 11-18. |
 2019, Vol. 36
2019, Vol. 36