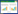文章信息
- 武海阔, 张荣荣, 王军, 李梦虎
- WU Haikuo, ZHANG Rongrong, WANG Jun, LI Menghu
- JNK1在2型糖尿病大鼠股动脉纤维病变中的表达及中药桃仁干预研究
- JNK1 in Ⅱ diabetes rat femoral artery expression and traditional Chinese medicine in the lesions of peach kernel intervention study
- 天津中医药, 2019, 36(5): 486-490
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(5): 486-490
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.05.18
-
文章历史
- 收稿日期: 2018-11-23
糖尿病下肢血管病变是糖尿病常见的慢性并发症,严重影响患者的生存质量,是造成患者伤残与死亡的重要原因。目前认为糖尿病大血管病变的病理改变主要为内膜、中膜层厚度增加,管腔狭窄,管壁顺应性降低,内膜粥样斑块形成致管腔进一步狭窄,直至完全闭塞产生临床症状。高血糖与高血脂的毒性作用、蛋白质非酶糖基化、内皮功能障碍等因素联合作用于血管壁,导致平滑肌细胞增殖,胶原过度表达,最终形成血管纤维化。本课题组前期证明,糖尿病足患者血管病变是以内膜的纤维性增厚为主,脂质沉积以纤维成分所占比例大。JNK又被称为蛋白激酶,近年发现,JNK信号通路和纤维化相关。因此,笔者提出如下科学假说:在高糖、慢性炎症刺激引起内毒素增多的环境下,JNK信号传导通路被激活进而促进血管纤维化的进程。本实验采用2型糖尿病大鼠股动脉纤维病变模型,应用免疫组化、蛋白免疫印迹(Western blot)、聚合酶链反应(PCR)实时荧光定量等技术,从c-Jun氨基末端激酶(JNK1)蛋白的表达水平,JNK1蛋白的磷酸化水平,JNK1基因的表达水平及血管上皮细胞形态功能水平等方面多角度考察JNK1与2型糖尿病大鼠股动脉纤维化的关系,并研究中药桃仁的作用。
1 材料与方法 1.1 实验动物雄性SD大鼠50只,清洁级,2月龄,体质量160~200 g,由天津实验动物中心提供,动物合格证号为SCXK-(军)2012-0004。
1.2 实验药品桃仁,原材料检验合格后,破碎,置多功能中药提取罐中,煎煮2次,过滤3次,真空低温浓缩,喷雾干燥,干法制粒,检验合格后备用,由天津中医药大学第一附属医院颗粒剂药房制备,每克颗粒剂相当于生药20 g。使用时将3 g桃仁颗粒剂溶解200 mL蒸馏水中,形成每毫升含生药0.3 g的药液备用。大鼠的等效剂量约为人体的6倍,生药用药剂量约为3.0 g/(kg·d),即颗粒剂水溶液10 mL/(kg·d)。
1.3 主要实验试剂及仪器兔抗大鼠多克隆抗体(JNK1 BA1219),武汉博士德生物工程有限公司;兔抗大鼠多克隆抗体(p-JNK1 BS-17591r),北京博奥森生物技术有限公司;山羊抗兔IgG二抗抗体,北京中杉金桥生物技术有限公司;辣根过氧化物酶(HRP)标记二抗,天津赛尔生物有限公司;Actin(5A7)mAb M20010内参抗体,天津赛尔生物有限公司;Epgiadients PCR仪,Eppendorf公司;ABI7500 fast荧光定量PCR仪,Life Technologies公司。
1.4 造模方法及实验分组造模方法:雄性SD大鼠50只,随机分为空白对照组、模型对照组、早期干预组、桃仁高剂量组、桃仁低剂量组各10只;空白对照组10只普通饮食喂养,其余各组予高脂高糖饲料喂养,诱导胰岛素抵抗。4周后,禁食不禁水12 h,称质量。行腹腔静脉注射链脲佐菌素(STZ)35 mg/kg。第3、7天测血糖,血糖 > 16.7 mmol/L为2型糖尿病鼠造模成功。此时空白对照组继续普通饮食喂养,其余各组继续高脂高糖喂养10周[1-2],进行2型糖尿病股动脉纤维病变造模,其中早期干预组予桃仁颗粒剂水溶液10 mL/(kg·d)灌胃。
2型糖尿病股动脉纤维病变模型标准:前期实验表明,雄性SD大鼠高脂高糖饲料喂养4周后行腹腔静脉注射STZ,可形成2型糖尿病鼠模型,继续高脂高糖饲料喂养10周后,可形成2型糖尿病股动脉纤维病变模型[3-5]。本次实验中,为验证模型成功率,另取同批次雄性SD大鼠3只单独分组,干预方法同模型对照组,2型糖尿病鼠模型造模成功10周后剥取双侧股动脉,福尔马林溶液固定,光镜下观察,若见纤维帽,胶原纤维玻璃样变,内皮细胞肿胀,其下聚集大量泡沫细胞,平滑肌细胞排列紊乱,弹力纤维断裂,甚至出现胆固醇结晶,血栓形成,钙盐沉着,即证明2型糖尿病鼠股动脉纤维病变模型制作成功(造模结果为阳性,见图 1)。这3只雄性SD大鼠不进入正式实验。
|
| 图 1 2型糖尿病鼠股动脉纤维病变造模结果(HE染色) Fig. 1 Results of model building of femoral artery fiber lesion in type 2 diabetic rats(HE staining) |
实验过程中空白对照组不予药物干预,早期干预组从2型糖尿病造模成功后至实验结束给予桃仁颗粒剂水溶液10 mL/(kg·d)灌胃,模型对照组从2型糖尿病股动脉纤维病变造模成功后给予0.9%生理盐水10 mL/(kg·d)灌胃,桃仁高剂量组从2型糖尿病股动脉纤维病变造模成功后给予桃仁颗粒剂水溶液20 mL/(kg·d)灌胃,低剂量组从2型糖尿病股动脉纤维病变造模成功后给予桃仁颗粒剂水溶液10 mL/(kg·d)灌胃。从2型糖尿病股动脉纤维病变造模成功后连续药物干预3周。
1.6 取材药物干预3周后,禁食24 h,用10%的水合氯醛3 g/kg麻醉,备皮,手术区皮肤消毒。根据股动脉搏动情况确定股动脉的位置和走行方向,将皮肤沿股动脉走向纵向切开,用纹式钳把周围组织钝性分离开来,以暴露股动脉鞘。用眼科镊沿着血管走向钝性分离出股动脉约4~5 cm,两端剪断,磷酸盐缓冲液(PBS)冲洗,平均分成两部分,一部分采用4%多聚甲醛进行固定,另一部分置于无菌冻存管中,-80 ℃冰箱保存。
1.7 观察指标 1.7.1 免疫组化检测股动脉JNK1的表达标本固定、包埋、切片,用4%多聚甲醛固定。经70%乙醇30 min,80%乙醇30 min,90%乙醇30 min 2次,95%乙醇30 min 2次,100%乙醇30 min 2次,二甲苯透明30 min 2次,55℃石蜡中30 min 2次,用铜制模具包埋组织块。将厚度5 μm的组织切片附于经多聚赖氨酸附膜的载玻片上,60 ℃过夜。再经过二甲苯脱蜡。后水化,抗原煮沸热修复,封闭。滴加一抗:将兔抗鼠抗体稀释到适当浓度(按1:100稀释),滴加稀释的抗体。置湿盒中4 ℃孵育过夜。滴加二抗:滴加适量生物素化山羊抗兔免疫球蛋白G(IgG)二抗工作液,37 ℃孵育10~30 min。经PBS冲洗、滴加HRP标记的链霉卵白素工作液,37 ℃孵育再冲洗。避光配置二氨基联苯胺(DAB)显色液,复染,脱水,透明,封固,最后光镜下观察。
1.7.2 Western blot检测股动脉JNK1、应激活化蛋白激酶1(p-JNK1)的表达液氮低温研磨组织。Modified RIPA buffer充分裂解,超声波破碎组织。12 000 g,4 ℃离心15 min,取上清液。利用牛血清白蛋白(BSA)蛋白定量法,对各样本的蛋白浓度进行分析。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶电泳分离蛋白,配制分离胶为10%的SDS-PAGE凝胶。取32 μL总蛋白、8 μL的5×Loading Buffer,煮沸3 min,立即冰置3 min,上样。100 V电压电泳。电转膜:将胶浸于转移缓冲液中平衡10 min。依据胶的大小剪取膜和滤纸3片,放入转移缓冲液中平衡10 min。伯乐半干转印仪器转膜,15 V,40 min。转膜结束,切断电源,取出杂交膜。封闭:用25 mL TBS洗膜5 min,室温,摇动。置膜于25 mL封闭缓冲液中1 h,室温,摇动。15 mL TBS/T洗3次(5 min/T)。与一抗的结合:在摇床上4 ℃轻轻摇动过夜。洗去非特异结合的一抗。与二抗的结合:将上膜和下膜分别浸入含相应HRP标记二抗的Blotto中,缓慢摇动室温孵育1 h。洗去非特异结合的二抗。在15 mL TBS中洗1次。用ECL液(KPL公司)显色,GE自动曝光系统检测、摄像。
1.7.3 实时荧光定量PCR(RT-qPCR)检测股动脉JNK1基因表达应用RT-PCR法检测其中JNK1 mRNA的含量。采用Trizol法提取总RNA,RT-PCR采用25 μL反应体系,反应体系为12.5 μL SYBR Mix,1 μL cDNA,上下游引物各1 μL,ddH2O体积9.5 μL,合计25 μL。仪器为ABI Step-plus系统。JNK1引物序列上游为TGATGTCTGCAATACCCAGGC,下游为TTCGTTAGTCTAGGCTGTGCC。
1.8 统计学处理采用SPSS 17.0统计软件进行数据分析,所有数据皆以均数±标准差(x±s)表示,组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD法,P < 0.05认为差异具有统计学意义。
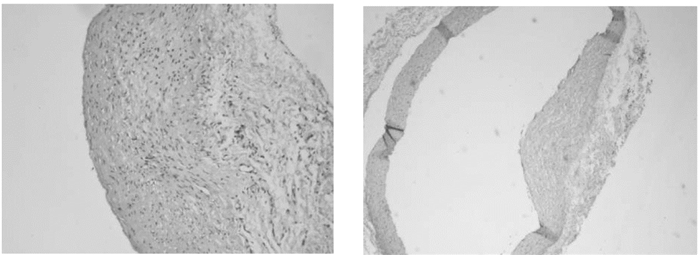
2 结果 2.1 大鼠股动脉JNK1表达的免疫组化定位结果JNK1主要表达于大鼠股动脉血管内皮细胞、中膜平滑肌细胞的细胞膜及细胞质中,采用免疫酶标法(ABC法)检测大鼠股动脉中JNK1表达情况(见图 2),空白对照组大鼠股动脉血管内皮细胞及中膜平滑肌细胞中有散在黄色物质,呈弱阳性改变;模型对照组可见大量棕黄色物质表达呈强阳性反应。早期干预组和桃仁高剂量组可见黄色物质呈阳性反应,提示JNK1表达明显下降,桃仁低剂量组可见大量黄色物质呈强阳性反应,提示JNK1表达无明显下降。
|
| 图 2 大鼠股动脉JNK1免疫组化结果(×400) Fig. 2 Immunohistochemical results of JNK1 in rats femoral artery(×400) |
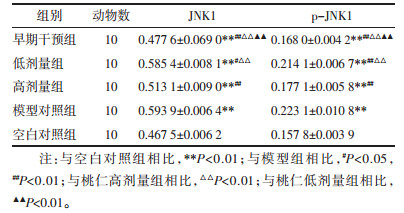
JNK1p-JNK1表达,5组间两两比较,差异均有统计学意义(P < 0.05)。见表 1。
|
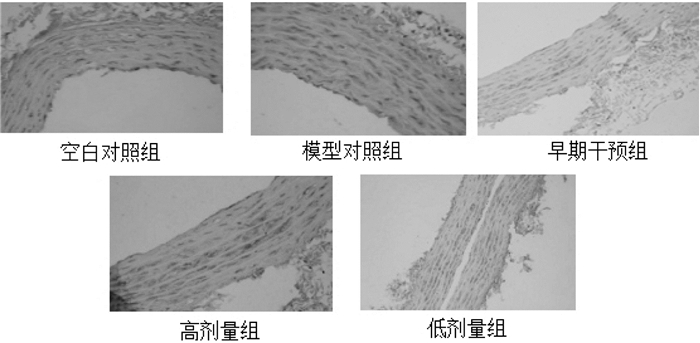
见图 3。各组Western blot灰度值检测结果如图 3所示,图像结合表 1结果分析如下:JNK1:模型对照组大鼠JNK1表达高于空白对照组;早期干预组和桃仁高剂量组与模型对照组相比,JNK1表达明显降低,且以早期干预组最为明显;桃仁低剂量组与模型对照组相比,JNK1表达有所降低。p-JNK1:模型对照组大鼠p-JNK1表达高于空白对照组;早期干预组和桃仁高剂量组与模型对照组相比,p-JNK1表达明显降低,且以早期干预组最为明显;桃仁低剂量组与模型对照组相比,JNK1表达有所降低。
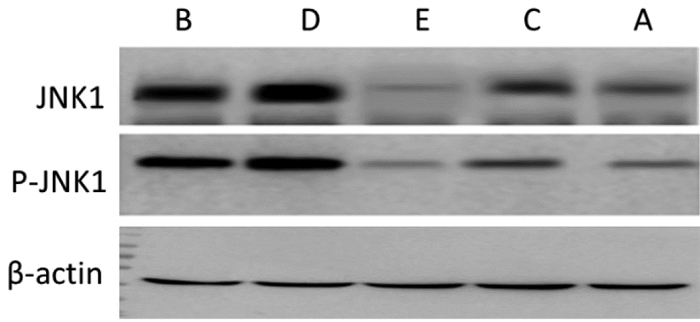
|
| A:桃仁低剂量组;B:模型对照组;C:空白对照组;D:桃仁高剂量组;E:早期干预组 图 3 大鼠股动脉JNK1/p-JNK1 Western blot灰度值 Fig. 3 Gray value of JNK1/ p-jnk1 Western blot in the femoral artery of rats |
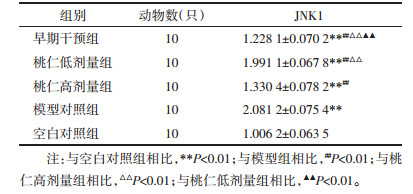
大鼠股动脉JNK1基因表达,5组间两两比较,差异均有统计学意义(P < 0.01)。见表 2。
|
目前认为糖尿病大血管病变的病理改变主要为内膜层及中膜层厚度增加,管腔狭窄,管壁顺应性降低,内膜粥样斑块形成致管腔进一步狭窄,直至完全闭塞产生临床症状。国外研究[6]表明高血糖与高血脂的毒性作用、内皮功能障碍、蛋白质非酶糖基化等因素联合作用于血管壁,可以导致平滑肌细胞增殖和胶原过度表达,这种高糖诱导的过度表达与血管纤维化及血管硬化高度相关。近年来研究发现,胰岛素抵抗引起的相关病理改变和胰岛素信号通路受损已成为2型糖尿病、代谢综合征和血管病变早期发病的危险因素[7]。
JNK在细胞、生产、凋亡、增殖和细胞应激等多种生理和病理过程中起重要作用。目前认为JNK参与了1型糖尿病的形成,诱导活化JNK通路可导致2型糖尿病的发生发展,并且JNK与胰岛β细胞凋亡、胰岛素基因表达障碍、胰岛素抵抗和动脉粥样硬化密切相关。此外,研究表明[8-9]JNK的异常表达可影响转化生长因子-β1(TGF-β1)的活性,进而影响肺脏、肾脏及血管纤维化的进程。2型糖尿病状态下,活化的TGF-β1通过激活JNK信号传导途径,进而引起Ⅰ、Ⅲ型胶原的合成明显增加并能促进纤维连接蛋白(FN)的过度聚集,最终导致组织纤维化的产生。从动物造模及实验结果来看,中晚期糖尿病大鼠存在明显的下肢血管病变,其病理改变与纤维化有关,研究发现,JNK在糖尿病大鼠股动脉中明显升高,可能是导致大血管纤维病变的分子机制。
桃仁为蔷薇科植物桃或山桃的干燥成熟种子,可入中药,也称为“桃核仁”“南杏”,桃仁药用首见于《神农本草经》,载其:“主瘀血血闭,症痛邪气,杀小虫。”《食鉴本草》记载:“桃仁破血,润大肠。”《名医别录》中记载桃仁:“止咳逆上气,消心下坚,除卒暴击血,破症痛,通脉,止痛。”《本草纲目·果一·桃》中记载:“桃仁行血,宜连皮尖生用。”有破血行瘀,润燥滑肠之功效。中医认为瘀血是糖尿病及其血管并发症的重要病理基础,活血化瘀药能明显降低糖尿病鼠大动脉转化生长因子-β、结缔组织生长因子、血小板衍生生长因子、血管内皮生长因子、胶原蛋白Ⅰ、胶原蛋白Ⅲ含量,具备有效抑制糖尿病大血管向纤维化发展的倾向。现代研究证明[10-13]桃仁通过扩张血管、抑制血小板聚集、抗凝血、抗血栓、抗纤维化等发挥活血化瘀的作用。目前研究表明桃仁提取物对肝纤维化均有良好的防治作用,其抗组织纤维化的机制在于促进Ⅰ、Ⅲ、Ⅳ、Ⅵ型胶原和FN的降解[14];此外桃仁对大鼠血液循环障碍及血管内皮细胞凋亡也有明显的抑制作用[10, 15]。
本实验结果表明,中药早期干预对糖尿病股动脉纤维化有明显预防作用,能有效抑制糖尿病血管病变的发展;在血管病变发生后,中药干预3周,早期干预疗效明显,桃仁高剂量组疗效良好,桃仁低剂量组疗效欠佳,表明桃仁对糖尿病股动脉纤维病变的抑制作用与用药剂量及用药时间成正相关。
根据实验结果分析,桃仁可有效改善糖尿病股动脉纤维病变,其作用机制可能是通过抑制JNK1基因的表达,降低JNK1蛋白的生成与表达,从而达到抑制股动脉纤维化形成的目的。
| [1] |
邢玉桂, 马飞, 孙洪胜. 大鼠动脉粥样硬化模型的建立[J]. 药学研究, 2015, 24(4): 192-194. |
| [2] |
唐英, 吴晓牧, 胡凡, 等. 单纯高血糖诱发大鼠动脉粥样硬化的实验研究[J]. 中西医结合心脑血管病杂志, 2015, 13(3): 282-284. DOI:10.3969/j.issn.16721349.2015.03.004 |
| [3] |
王军, 徐阳, 袁向科, 等. 实验性糖尿病鼠大血管病变TGF-β1和CTGF的表达及中药的干预作用[J]. 天津中医药, 2012, 29(3): 266-269. |
| [4] |
丁志明, 武海阔, 王军. 胶原蛋白Ⅰ、胶原蛋白Ⅲ在糖尿病大鼠血管病变中的表达及中药的干预[J]. 天津中医药, 2012, 29(6): 573-575. |
| [5] |
徐阳, 王军, 武海阔. 桃核承气汤对糖尿病大鼠大血管纤维病变Toll样受体通路作用研究[J]. 天津中医药, 2016, 33(5): 299-302. |
| [6] |
Yu Y, Lyons TJ. Alethal tetrad in diabetes:hyperglycemia, dyslipidemia, oxidative stress, and endothelial dysfunction[J]. Am J Med Sci, 2005, 330(5): 227-232. DOI:10.1097/00000441-200511000-00005 |
| [7] |
Prudenie S, Searpelli D, Chandalia M, et al. The TRIB3 Q84R polymorphism and risk of early-onset type2 diabetes[J]. J Clin Endoerinol Metab, 2009, 94(1): 190-196. DOI:10.1210/jc.2008-1365 |
| [8] |
胡月媛, 刘学军, 杜毓锋, 等. JNK信号通路对大鼠肺纤维化Ι型胶原的影响[J]. 中国药物与临床, 2012, 12(3): 306-307. DOI:10.3969/j.issn.1671-2560.2012.03.010 |
| [9] |
刘旭峰, 吴伟, 刘晓亮, 等. JNK1信号分子参与调控糖尿病大鼠心肌细胞肥大和纤维化[J]. 现代生物医学进展, 2017, 3(31): 6018-6023. |
| [10] |
以敏, 邓家刚, 郝二伟, 等. 桃仁对血液循环障碍大鼠内皮细胞凋亡及相关蛋白表达的影响[J]. 中国实验方剂学杂志, 2013, 19(14): 178-182. |
| [11] |
郝二伟, 邓家刚, 杜正彩, 等. 平性药桃仁双向适用药性特征的研究[J]. 中药药理与临床, 2011, 27(1): 56-58. |
| [12] |
Liu L, Shi G P. CD31:beyond a marker for endothelial cells[J]. Cardiovascular Research, 2012, 94(1): 3. |
| [13] |
以敏, 邓家刚, 郝二伟, 等. 桃仁提取物对不同病因所致大鼠血液循环障碍的影响[J]. 中草药, 2013, 44(7): 858-862. |
| [14] |
徐列明, 刘平, 刘成, 等. 桃仁提取物抗实验性肝纤维化的作用观察[J]. 中国中药杂志, 1994, 19(8): 491-494. |
| [15] |
以敏, 徐君毅, 邓家刚, 等. 桃仁提取物对寒热不同血瘀证大鼠内皮细胞的损伤及NF-κB表达的影响[J]. 广西中医药, 2017, 40(2): 65-69. |
 2019, Vol. 36
2019, Vol. 36