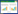文章信息
- 崔勇和, 沈先敏
- CUI Yonghe, SHEN Xianmin
- 白藜芦醇抑制TXNIP/NLRP3信号通路改善脂多糖诱导的肾小管上皮细胞炎性损伤
- Effects of resveratrol against inflammatory injury of human renal proximal tubular cells induced by LPS through the inhibition of TXNIP/NLRP3 signaling pathway
- 天津中医药, 2019, 36(5): 495-498
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(5): 495-498
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.05.20
-
文章历史
- 收稿日期: 2018-12-29
随着医疗技术不断的革新,介入、多层螺旋CT及三维重建技术的普及,对比剂在诊断治疗中的应用越发受到重视。然而,对比剂致急性肾损伤(CIAKI)在临床上出现的风险也越来越高,为导致院内肾功能衰竭的三大原因之一,仅次于肾脏灌注不足及肾毒性药物,而CIAKI占据院内获得性肾功能衰竭的11%[1-2]。引起CIAKI发生发展的病因较多,其中对比剂引起肾脏微血管血流动力学改变、对比剂导致肾小管的毒性、氧化损伤、炎性反应及肾小管梗阻等均会诱导CIAKI的发生[3-4]。其中炎性损伤可能是诱导CIAKI发生发展的一个重要因素。硫氧还蛋白相互作用蛋白(TXNIP)在各种刺激下会引起NLRP3炎性通路的活化,诱导IL-6、IL-1β及TNF-α等炎性因子的释放[5-6];并且研究报道在急性肾损伤模型中TXNIP/NLRP3信号通路处于高度活化的状态[7]。白藜芦醇主要提取于葡萄、虎杖、花生、桑葚等植物,属于一种天然的抗炎剂[8],并且其具有明显的降低蛋白尿及保护肾的药理活性[9]。因此,本研究从细胞水平研究白藜芦醇对人肾小管上皮细胞(HK-2细胞)在脂多糖(LPS)诱导炎性损伤中的作用,并观察其对TXNIP/NLRP3信号通路的影响。
1 材料及方法 1.1 材料及试剂白藜芦醇(湖北盛天恒创生物有限公司,批号:13065-54-8,纯度≥99%);人肾小管上皮(HK-2)细胞由上海斯信科技生物有限公司提供(来源于美国ATCC细胞库);1640培养基及胎牛血清均购自美国Gibco公司;胰蛋白酶购自美国Thermo scientific公司(批号:R001100);CCK8试剂盒购自北京智杰方远科技有限公司(批号:CK04);LPS(批号L2880,美国Sigma公司);IL-6、IL-1β及TNF-α ELISA试剂盒购自武汉华美生物有限公司(批号分别为:WK15204,WK25540,WK36640);SDS-PAGE凝胶配制试剂盒购自武汉谷歌生物有限公司(批号:P57460);兔抗鼠β-actin(货号ab108267)、iNOS(货号ab152104)、COX-2(货号ab105217)、TXNIP(货号ab1520107)及NLRP3(货号ab1663570)一抗均购自英国Abcam公司;HRP标记山羊抗兔IgG二抗购自武汉谷歌生物有限公司。
1.2 仪器BIORAD-550型酶标仪(美国伯乐公司);BBS-V800型单人超净台(山东鑫贝西公司);SPX-250型细胞培养箱(美国Thermo公司);GE-100型凝胶电泳仪(北京六一仪器厂);双色红外激光成像系统(BIO-RAD,美国)。
1.3 HK-2细胞培养采用1640完全培养基培养,培养箱条件为37℃、5%CO2浓度,待细胞长满至95%左右时用PBS清洗后加入胰酶消化,显微镜下观察待细胞变圆后加入培养基终止消化,分装于3个培养瓶进行传代培养。
1.4 白藜芦醇对HK-2细胞增殖的影响取对数生长期细胞消化、离心、重悬后,以5×104个/mL的细胞浓度接种于96孔板,每孔加入200 μL的细胞悬液,每组设置5个复孔。细胞培养过夜后用于后续实验,实验分为5组:正常对照组、LPS诱导组、LPS+低剂量(50 μmol/L)白藜芦醇组、LPS+中剂量(100 μmol/L)白藜芦醇组、LPS+高剂量(200 μmol/L)白藜芦醇组,首先在药物组中加入相应浓度白藜芦醇溶液,2 h后再加入LPS溶液。培养24 h,吸去旧培养液,每孔加入10 μL CCK8试剂,孵育1 h后采用酶标仪450 nm波长下OD值。实验重复3次,计算细胞相对存活率。
1.5 藜芦醇对HK-2细胞炎性因子水平的影响将对数生长期细胞进行消化重悬接种于6孔板,待细胞贴壁后吸去旧培养基,按“1.4”项分组及药物处理24 h后收集细胞及细胞上清,细胞上清用于炎性因子IL-6、IL-1β及TNF-α水平检测,其操作步骤严格按照说明书进行。
1.6 藜芦醇对HK-2细胞炎性蛋白及TXNIP/NLRP3信号通路的影响将“1.5”项收集的细胞裂解制备成匀浆,离心收集上清提取细胞蛋白,BCA法测定细胞总蛋白浓度。各孔取50 μg的蛋白上样,用12%聚丙烯酰胺凝胶电泳进行蛋白分离,将分离后的蛋白电转移至NC膜。加入5%脱脂奶粉封闭液于摇床上室温封闭1 h后,分别加入iNOS、COX-2、TXNIP及NLRP3抗体(体积稀释比例均为1:1 000)4 ℃反应过夜。次日以TBST洗膜3次后加入HRP标记的山羊抗兔IgG(体积稀释比例为1:3 000),室温反应1 h。再用TBST洗膜3次,每次10 min,以ECL试剂显影后进行蛋白条带灰度值分析。
1.7 统计学方法采用SPSS 20.0软件进行统计分析,实验数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P < 0.05具有统计学意义。
2 结果 2.1 白藜芦醇对HK-2细胞相对存活率的影响各组间HK-2细胞相对存活率比较见图 1,提示LPS诱导组HK-2细胞相对存活率显著低于正常对照组,差异有统计学意义(P < 0.05);与LPS诱导组相比,低、中、高剂量白藜芦醇组细胞相对存活率显著升高,差异均有统计学意义(P < 0.05),说明白藜芦醇能促使HK-2细胞增殖。
|
| a:正常对照组,b:LPS诱导组,c:LPS+低剂量白藜芦醇组,d:LPS+中剂量白藜芦醇组,e:LPS+高剂量白藜芦醇组;与正常对照组比较,*P < 0.05;与LPS诱导组比较,#P < 0.05 图 1 各组间HK-2细胞相对存活率的比较 Fig. 1 Comparison of the relative survival rate of HK-2 cells in each group |
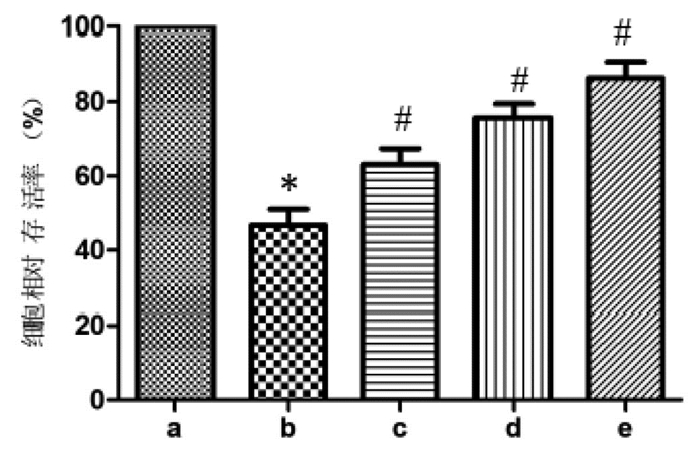
各组间HK-2细胞上清炎性指标水平比较见表 1所示,提示LPS诱导组HK-2细胞上清IL-6、IL-1β及TNF-α水平显著高于正常对照组,差异有统计学意义(P < 0.05);与LPS诱导组相比,低、中、高剂量白藜芦醇组细胞上清IL-6、IL-1β及TNF-α水平显著降低,差异均有统计学意义(P < 0.05),说明白藜芦醇能抑制细胞炎性因子的释放。
|
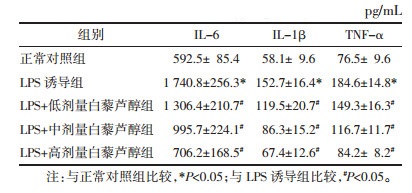
各组间HK-2细胞炎症蛋白iNOS及COX-2表达水平比较见图 2所示,提示LPS诱导组HK-2细胞iNOS及COX-2表达水平显著高于正常对照组,差异有统计学意义(P < 0.05);与LPS诱导组相比,低、中、高剂量白藜芦醇组细胞iNOS及COX-2表达水平显著降低,差异均有统计学意义(P < 0.05),说明白藜芦醇能抑制细胞炎性蛋白iNOS及COX-2的表达。
|
| #P < 0.05;a:正常对照组,b:LPS诱导组,c:LPS+低剂量白藜芦醇组,d:LPS+中剂量白藜芦醇组,e:LPS+高剂量白藜芦醇组;与正常对照组比较,*P < 0.05;与LPS诱导组比较,#P < 0.05 图 2 不同组间炎性蛋白表达比较 Fig. 2 Comparison of inflammatory proteins expression in deferent groups |
各组间HK-2细胞TXNIP、NLRP3蛋白表达水平比较见图 3所示,提示LPS诱导组HK-2细胞TXNIP、NLRP3蛋白表达水平显著高于正常对照组,差异有统计学意义(P < 0.05);与LPS诱导组相比,低、中、高剂量白藜芦醇组细胞TXNIP、NLRP3蛋白表达水平显著降低,差异均有统计学意义(P < 0.05),说明白藜芦醇能抑制HK-2细胞TXNIP/NLRP3信号通路的活化。
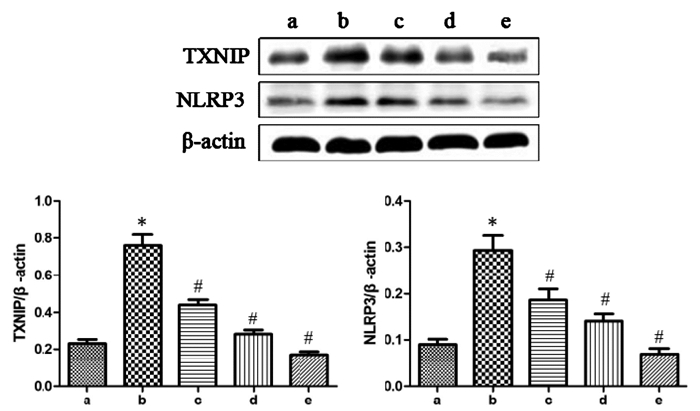
|
| #P < 0.05;a:正常对照组,b:LPS诱导组,c:LPS+低剂量白藜芦醇组,d:LPS+中剂量白藜芦醇组,e:LPS+高剂量白藜芦醇组;与正常对照组比较,*P < 0.05,与LPS诱导组比较,#P < 0.05 图 3 不同组间TXNIP及NLRP3蛋白表达比较 Fig. 3 Comparison of TXNIP and NLRP3 proteins expression in different groups |
CIAKI会进一步引起肾间质纤维化,后者为多种肾脏疾病导致的肾脏功能进行性恶化的重要过程,为各种肾脏病变发展到终末期肾衰竭的共同环节,主要表现在肾间质细胞的炎性损伤、间质成纤维细胞增殖及胞外基质过度沉积等[10]。肾小管上皮细胞在细胞因子的刺激下,能够转变为肌成纤维细胞,参与肾间质纤维化。由于肾小管上皮细胞的存在,其转分化过程的进展程度对于肾脏病的预后至关重要。于是,探索有效抑制肾小管上皮细胞转分化的药物对于改善肾脏疾病有着重要作用。
白藜芦醇属于一种天然的多酚醇类化合物,主要存在于葡萄籽、花生、虎杖等多种植物中,它对心血管、肿瘤、风湿性关节炎等多种疾病都有保护作用。白藜芦醇可以通过抑制氧化应激损伤及炎性损伤保护糖尿病大鼠的肾脏功能,其作用机制与激活Nrf2/Keap1信号通路有关[11];细胞学实验提示白藜芦醇可通过活化Nrf2/ARE信号通路抑制肾脏系膜细胞的增殖[12];还发现白藜芦醇能够通过抑制谷胱甘肽转移酶活性缓解早期大鼠的肾功能损伤[13]。然而白藜芦醇对脂多糖诱导的肾小管上皮细胞炎性损伤的保护作用研究甚少,于是本研究观察了白藜芦醇对脂多糖诱导的HK-2细胞炎性反应的保护作用及其作用机制。研究发现脂多糖能明显诱导HK-2细胞炎性损伤,表现在细胞培养液中炎性因子IL-6、IL-1β及TNF-α水平显著升高,细胞中炎症蛋白iNOS及COX-2表达的显著增高以及细胞相对存活率的明显降低,提示脂多糖构建的HK-2细胞炎性损伤模型是成功的。接着采用不同浓度白藜芦醇干预HK-2细胞后,发现其能明显诱导HK-2细胞增殖,并抑制炎性因子IL-6、IL-1β及TNF-α的产生及炎性蛋白iNOS、COX-2的表达,说明白藜芦醇对脂多糖诱导的HK-2细胞炎性损伤具有显著的保护作用。
炎性损伤在多种肾病的发生机制中起着关键的诱导作用,多种刺激可使间质细胞及内皮细胞的炎性因子水平增高,使其处于炎性损伤状态。然而炎性状态下会诱导TXNIP与NLRP3的相互作用引起NLRP3/caspase-1/IL-1β信号通路的活化。并且NLRP3在糖尿病肾病及肾缺血再灌注损伤中起着关键性作用,于是降低炎性小体NLRP3的活化能抑制炎性反应,可进一步改善肾脏损伤的作用。本实验发现脂多糖能明显诱导TXNIP、NLRP3蛋白的表达上调,进一步导致炎性反应;然而白藜芦醇能明显抑制TXNIP、NLRP3蛋白的表达,降低了TXNIP/NLRP3炎性信号通路的活化,从而达到抑制炎性反应的药理作用。总之,白藜芦醇可以明显抑制LPS诱导的HK-2细胞炎症损伤,抑制炎症相关蛋白的表达,其作用机制可能与抑制TXNIP/NLRP3炎性通路活化相关。
| [1] |
Meinel FG, De Cecco CN, Schoepf UJ, et al. Contrast-induced acute kidney injury:definition, epidemiology, and outcome[J]. Biomed Res Int, 2014, 4(11): 859-868. |
| [2] |
Safi W, Rauscher I, Umgelter A. Contrast-induced acute kidney injury in cirrhotic patients. A retrospective analysis[J]. Ann Hepatol, 2015, 14(6): 895-901. DOI:10.5604/16652681.1171779 |
| [3] |
Limbruno U, Picchi A, Micheli A, et al. Refining the assessment of contrast-induced acute kidney injury:the load-to-damage relationship[J]. J Cardiovasc Med (Hagerstown), 2014, 15(7): 587-594. DOI:10.2459/JCM.0b013e3283638e56 |
| [4] |
Briguori C, Quintavalle C, Donnarumma E, et al. Novel biomarkers for contrast-induced acute kidney injury[J]. Biomed Res Int, 2014, 14(11): 568-574. |
| [5] |
Liu W, Gu J, Qi J, et al. Lentinan exerts synergistic apoptotic effects with paclitaxel in A549 cells via activating ROS-TXNIP-NLRP3 inflammasome[J]. J Cell Mol Med, 2015, 19(8): 1949-1955. |
| [6] |
Xiao J, Zhu Y, Liu Y, et al. Lycium barbarum polysaccharide attenuates alcoholic cellular injury through TXNIP-NLRP3 inflammasome pathway[J]. Int J Biol Macromol, 2014, 69(11): 73-78. |
| [7] |
Yuan X, Zheng Y, Chen C, et al. Anisodamine inhibits endoplasmic reticulum stress-associated TXNIP/NLRP3 inflammasome activation in rhabdomyolysis-induced acute kidney injury[J]. Apoptosis, 2017, 22(12): 1524-1531. DOI:10.1007/s10495-017-1414-y |
| [8] |
Inoue H, Nakata R. Resveratrol targets in inflammation[J]. Endocr Metab Immune Disord Drug Targets, 2015, 15(3): 186-195. DOI:10.2174/1871530315666150316120316 |
| [9] |
Kim MY, Lim JH, Youn HH, et al. Resveratrol prevents renal lipotoxcity and inhibits mesangial cell glucotoxcity in a manner dependent on the AMPK-SIRT1-PGC1α axis in db/db mice[J]. Diabetologia, 2013, 56(1): 204-217. |
| [10] |
Kong FC, Zhang JQ, Zeng C, et al. Inhibitory effects of parthenolide on the activity of NF-kappaB in multiple myeloma via targeting TRAF6[J]. J Huazhong Univ Sci Technolog Med Sci, 2015, 35(3): 343-349. DOI:10.1007/s11596-015-1435-0 |
| [11] |
Palsamy P, Subramanian S. Resveratrol protects diabetic kidney by attenuating hyperglycemia-mediated oxidative stress and renal inflammatory cytokines via Nrf2-Keap1 signaling[J]. Biochim Biophys Acta, 2011, 1812(7): 719-731. DOI:10.1016/j.bbadis.2011.03.008 |
| [12] |
Huang K, Huang J, Xie X, et al. Sirt1 resists advanced glycation end products-induced expressions of fibronectin and TGF-β1 by activating the Nrf2/ARE pathway in glomerular mesangial cells[J]. Free Radic Biol Med, 2013, 65(14): 528-540. |
| [13] |
Jiang B, Guo L, Li BY, et al. Resveratrol attenuates early diabetic nephropathy by down-regulating glutathione s-transferases Mu in diabetic rats[J]. J Med Food, 2013, 16(6): 481-486. DOI:10.1089/jmf.2012.2686 |
 2019, Vol. 36
2019, Vol. 36