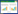文章信息
- 金鑫, 高擎, 翟晓翔, 李洁, 张晓宇
- JIN Xin, GAO Qing, ZHAI Xiaoxiang, LI Jie, ZHANG Xiaoyu
- 白茶、玫瑰花及玳玳花提取物对体外培养黑素细胞功能的影响
- Effects of the extracts of white tea, rose and bitter citrus immature flower on the function of melanocytes in vitro
- 天津中医药, 2019, 36(5): 499-503
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(5): 499-503
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.05.21
-
文章历史
- 收稿日期: 2019-01-02
2. 上海市第七人民医院, 上海 422700;
3. 徐州市中医院, 徐州 221000
黄褐斑是常见的色素沉着性皮肤病,临床表现为淡褐色或深褐色斑片,大多呈对称性分布。患者虽无自觉症状,但严重损害面容美观,给患者造成一定的心理影响。目前黄褐斑没有特效的治疗方法。近年来从天然植物中提取活性成分用于黄褐斑、雀斑等皮肤病的治疗逐渐成为热点。祛斑因子A、B即是从白茶、玫瑰花及玳玳花中所提取的活性成分。本研究采用祛斑因子含药血清作用于体外培养的黑素细胞体系,观察其对黑素细胞增殖、黑素合成、酪氨酸酶活性及其mRNA表达的影响;同时建立角质形成细胞与黑素细胞的体外共培养体,观察祛斑因子对黑素细胞树突生长及黑素小体转运的影响。
1 实验材料 1.1 实验动物SPF级大鼠,雄性30只,体质量(200±20)g(山东大学耳鼻喉实验室)。
1.2 细胞株来源健康儿童(5~12岁)包皮环切术后的包皮(山东大学齐鲁医院医院泌尿外科)。
1.3 实验药品祛斑因子B(白茶提取物)、祛斑因子A(白茶、玫瑰花及玳玳花提取物:将3种中药按照比例投料400 g →加水5 L提取40 min(1提,微沸,避免大火强热)→100目过滤备用→加水5 L提取40 min(2提,微沸,避免大火强热)→100目过滤备用→合并2次提取滤液→浓缩至500 mL左右(微沸,避免大火强热)→填充至10 mL口服液瓶)(两者均为无限极中国有限公司所提取);太太美容口服液(深圳太太药业有限公司,批号:TGC1232);维生素C片(东北制药集团沈阳第一制药有限公司,批号:5141206)用时研细粉,用蒸馏水配成溶液。
1.4 主要试剂和仪器D-Hanks液、双抗(青霉素和链霉素)、DM254培养基、KC-FSFM培养基、DMEM培养基(含10%胎牛血清)、二甲基亚砜(DMSO)、4-甲基偶氮唑蓝(MTT)、左旋多巴(均购自Sigma公司),TritonX-100(Amresco公司),RNA提取试剂盒、0.25%胰蛋白酶-EDTA液、胎牛血清(购自杭州四季青生物有限公司),irTton X-20(Ge nview公司),pulldown试剂盒、蛋白浓度测定试剂盒、Alexa-fluor-594-anti-cytokeratin-19-抗体(购自南京建成生物工程有限公司),CFDA-SE(上海麦约尔生物技术有限公司),Li-Cor近红外成像仪(美国LI-CO公司),BDFalcon流式细胞仪(美国BD生物公司),Wellsean MK3型酶标仪(Labsystems公司),Smartspec300紫外可见光分光光度计、DNA扩增仪、电泳图像分析仪(iBo- Rad公司)。
2 实验方法 2.1 含药血清的制备[1]祛斑因子A临床拟用药量设为高、中、低3组[4 mL/60(kg·d)、8 mL/60(kg·d)、12 mL/60(kg·d)],祛斑因子B设为[6 mL/60(kg·d)],太太美容口服液组[20 mL/60(kg·d)],维生素C组[30 mg/60(kg·d)],按照公式换算法:动物给药剂量=临床用药量×动物等效剂量系数(按体表面积)×培养基内血清稀释度,空白血清对照组给予同等剂量蒸馏水灌胃,2次/日,连续3日,最后1次灌胃后1~2 h内腹主动脉取血,无菌分离血清;-80 ℃保存,使用前灭活。临用时调至终浓度。
2.2 原代黑素细胞的培养参考Halaban R[3]的方法,取包皮组织,分离并纯化黑素细胞,接种于DM254培养基进行培养,收获3~4代备用。
2.3 MTT法检测黑素细胞的增殖将前期收获的黑素细胞接种于96孔板,每孔5×103细胞,24 h后加入含药血清,以不含药物的空白血清作为对照组。继续培养72 h后,离心弃上清,每孔加入5 μg/mL的MTT溶液20 μL,置于37 ℃、5%CO2孵箱4 h,弃上清,每孔加DMSO150 μL,室温振荡10 min,置酶标仪490 nm(630 nm为校准波长)波长下测量各孔吸光度值。黑素细胞抑制率(%)=1-含药血清组OD值/空白血清对照组OD值×100%。
2.4 酪氨酸酶活性测定同MTT法中操作方法,不同配方含药血清作用于黑素细胞72 h后,收集细胞,离心弃上清液,PBS洗2次,加入200 μL0.1% TritonX-100裂解液,置于-80 ℃冰箱中0.5 h,37℃水浴箱中复温0.5 h,加2 mg/ mL L-Dopa(左旋多巴)400 μL,继续37 ℃孵育2 h,紫外分光光度计读取450 nm处OD值,用L-Dopa的自动氧化进行校正。以不加中药的反应混合物作为对照组。酪氨酸酶活性影响率(%)=(含药血清组OD值-空白血清对照组OD值)/空白血清对照组OD值×100%。
2.5 黑素含量测定同MTT法中操作方法,不同配方含药血清作用于黑素细胞72 h后,倾去培养液,用生理盐水清洗1次,胰酶消化,离心,吸出上清液,加入NaOH,于80 ℃水浴保温1 h,置于波长490 nm下测OD值。黑素相对含量(%)=含药血清组/空白血清对照组×100%。
2.6 酪氨酸酶mRNA表达量测定取第3~4代对数生长期的黑色素细胞,以1×104个/cm2密度接种于培养瓶中,不同配方含药血清作用于黑素细胞4 h后,采用Trizol Reagent总RNA提取试剂盒进行总RNA提取,操作步骤按试剂盒说明书进行。电泳鉴定提取RNA的完整性。统一调整总RNA纯度为0.5 g/L,于-70 ℃储存。取6 μLRNA为反转录模板,在GenBank数据库中获得目的基因mRNA序列,采用Primer express2.0软件,在CDS区设计特异性引物(由山东大学齐鲁医院耳鼻喉实验室设计,实验使用引物TYR-421F:GCAAAGCATACCATCAGCTC;TYR-565R:GCAGTGCATCCATTGACACAT)。使用TAKARA的RT-PCR试剂盒将RNA进行反转录生成cDNA,利用SYBRGreenI实时荧光定量PCR检测方法进行酪氨酸酶mRNA的表达的检测。mRNA的相对表达量(%)=含药血清组/空白血清对照组×100%。
2.7 Pull down实验和Western Blot检测GTP-RhoA和GTP-Rac1蛋白的表达在收获的3-4代的黑素细胞中加入含生长因子添加物M254,光学显微镜下计数细胞;将细胞以每孔1×106接种10 cm培养皿,设对照组(空白血清)和实验组(含药血清);隔日更换新鲜培养液,待细胞生长至约70%,更换不含生长因子的M254继续培养,饥饿24 h后吸出培养液加入含有药物血清的M254处理120 min收集细胞,按照pull down试剂盒加入裂解液于冰上行细胞裂解,充分裂解后取裂解液离心收集上清备用,BCA法测上清液中总蛋白量,各组取20 μg样品蛋白进行SDS-聚丙烯酰胺凝胶电泳并转移至PVDF膜上,封闭液室温封闭1 h。加入特异性识别抗体(Ⅰ抗,以适当比例稀释,β-actin为1:1 000,Tyr为1:500),4℃封闭过夜。TBS震荡洗膜后,加入荧光Ⅱ抗(1:10 000),避光室温孵育1 h,Odssey双色红外成像仪扫描,用Image- plus6.0图像分析软件测量数据。蛋白相对表达量(%)=含药血清组/空白血清对照组×100%。
2.8 流式细胞术检测共培养细胞体系培养参照黑素细胞培养方法,不同在于角质形成细胞的培养基为KC-SFM(含生长因子)。将生长至3~4代的角质形成细胞消化后离心,光学显微镜下计数,将细胞浓度调至2×105个/mL,以每孔5 mL接种10 cm培养皿。在前期收获的3~4代黑素细胞加入2 μmol/L的CFDA-SEHanks平衡液10 mL重悬细胞,进行CFDA-SE荧光标记,37 ℃避光孵育后以1:2(黑素细胞:角质细胞)比例进行共培养,用含药物血清的培养液培养5 d,并设空白血清对照组,吸出培养液,用PBS洗2次,充分消化后PBS重悬细胞,光学显微镜下细胞计数,调整细胞浓度至1×106个/mL;取2 mL离心加入试剂A(固定剂)100 μL,室温固定15 min;用PFN 3 mL洗细胞1次,离心,加入试剂B(透膜剂)100 μL,室温孵育10 min;离心,用100 μL PBS重悬细胞,加入anti-cytokeratin-19抗体。PFN洗涤细胞,离心后,用l mL PBS重悬细胞。CFDA- SE可用488 nm激发,anti-cytokeratin-19用590 nm激发(CFDA和anti-cytokeratin-19均阳性者,即成功发生黑素转运的角质形成细胞数目)。黑素小体转运抑制率(%)=(空白血清对照组转运率-含药血清组转运率)/空白血清对照组转运率×100%。
3 统计学方法应用SPSS 19.0进行统计学分析,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
4 实验结果 4.1 祛斑因子A、B对黑素细胞增殖的影响祛斑因子A、B,维生素C及太太美容口服液对黑素细胞增殖的影响结果见表 1。祛斑因子A低、中剂量组、祛斑因子B组、维生素C组黑素细胞相对增殖率均低于空白血清对照组,祛斑因子A高剂量组、太太美容口服液组黑素细胞相对增殖率高于空白血清对照组,但与空白血清对照组比较(差异)均无统计学意义。说明各含药血清组在此药物剂量下对黑素细胞的增殖无影响。
|
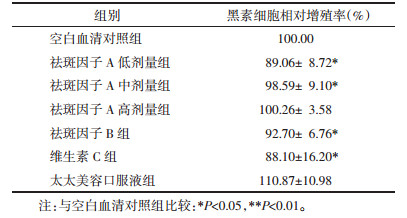
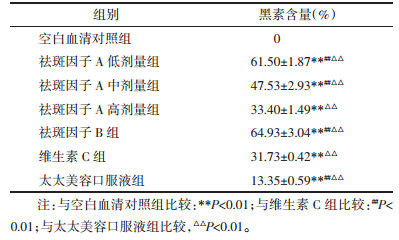
祛斑因子A、B,维生素C及太太美容口服液对黑素合成总量的影响结果见表 2。祛斑因子A高、中、低剂量组、祛斑因子B组、维生素C组及太太美容口服液组黑素含量均低于空白血清对照组,并具有统计学意义。与维生素C及太太美容口服液比较,祛斑因子A高、中、低剂量组、祛斑因子B组其黑素含量有依次降低趋势(表现为祛斑因子A低剂量组 < 祛斑因子A中剂量组 < 祛斑因子B组 < 祛斑因子A高剂量组 < 太太美容口服液组 < 维生素C组),但不具有统计学意义。
|
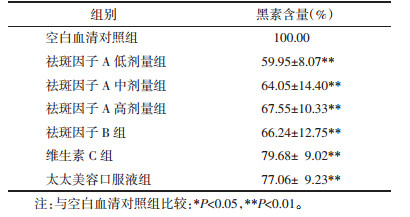
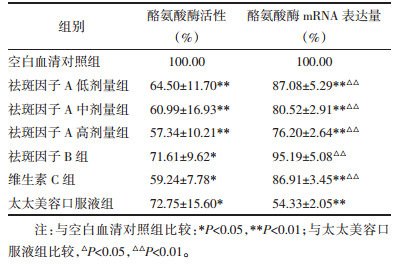
祛斑因子A、B,维生素C及太太美容口服液对酪氨酸酶活性及其mRNA表达量的影响结果见表 3。与空白血清对照组相比,各用药组酪氨酸酶活性均降低,其中尤以祛斑因子A不同剂量组酪氨酸酶活性降低明显,具有统计学意义;从数值分析,低剂量组对酪氨酸酶活性抑制较中、高剂量、祛斑因子B更为明显(祛斑因子A低剂量 > 祛斑因子A中剂量 > 祛斑因子高剂量 > 祛斑因子B),但无统计学意义。祛斑因子A各浓度组、祛斑因子B组与维生素C组及太太美容口服液组比较,差异无统计学意义。
|
酪氨酸酶mRNA表达量的结果显示,各用药组均表现为酪氨酸酶mRNA表达量降低,与空白血清对照组比较,除祛斑因子B组外,其余各组差异均具有统计学意义。
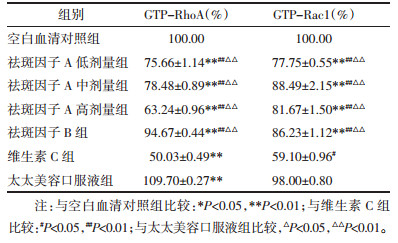
4.4 祛斑因子A、B对黑素细胞GTP-RhoA和GTP-Rac1蛋白的表达的影响各药物组对黑素细胞GTP-RhoA和GTP-Rac1蛋白表达影响见表 4。祛斑因子A高、中、低浓度、祛斑因子B及维生素C组中黑素细胞GTP-RhoA和GTP-Rac1蛋白表达量均低于空白对照组,尤以维生素C组降低明显,具有显著统计学差异。太太美容口服液组黑素细胞中GTP-RhoA蛋白表达量高于空白血清对照组,而GTP-Rac1蛋白表达量低于空白对照组比较,差异无统计学意义;祛斑因子A高、中、低剂量、祛斑因子B组两蛋白表达量均低于太太美容口服液组,且两两组间均具有统计学意义。
|
在人表皮角质形成细胞和黑素细胞的体外共培养体系中,与空白血清对照组比较,含药血清组均对黑素小体的转运有明显的抑制作用(P < 0.05),其中以祛斑因子B、祛斑因子A低剂量抑制作用明显,二者无统计学差异(P > 0.05);祛斑因子A中、低剂量、祛斑因子B组黑素小体转运抑制率均高于太太美容口服液组及维生素C组(P < 0.05),且两两比较组间均具有统计学意义(P < 0.05)。见表 5。
|
黄褐斑是临床多见的获得性色素增多性皮肤病,发病原因众多,发病机制复杂。中医学认为肝郁、脾虚、肾亏导致脏腑失调,气血失和不能上荣于面部而发为本病。临床辨证施治以疏肝理气、健脾除湿、滋补肝肾为主。近年来,随着现代医学研究的不断深入,对其发病机制有了新的发现,如血管内皮长因子、皮肤屏障受损等。但黑素细胞数量或是活性的增加,及黑素合成的增多一直是黄褐斑最主要也是最直接的原因,Sheth[3]研究发现黑素细胞活性的增加对黄褐斑的影响要比黑素细胞数量的增多更为显著。
黑素细胞分布于人体多种组织器官,其中以皮肤表皮最为多见,是合成和分泌黑素的重要场所。黑素细胞通过树突向周围角质形成细胞提供黑素,形成一个表皮黑素单位。在黑素细胞中酪氨酸进入黑素小体,在酪氨酸酶(TYR)的作用下经有多种生化反应最终转变为黑素,再由树突转运至皮肤角质形成细胞。肌动蛋白F-actin作为细胞骨架结构,可以调节树突的伸长和缩短。而RhoA、Rac1调节F-actin重排,有实验研发现,活化细胞中Rac1可使黑素树突的延伸并生长[4];Braga[5]等研究发现,抑制Rac1的活化可使细胞接触点处E钙黏蛋白水平下降,证明Rac1可促进黑素细胞与角质形成细胞黏附,对黑素的转运起到协同促进作用。
祛斑因子B成分为白茶提取物(主要活性成分为茶多酚),祛斑因子A是在祛斑因子B的基础上添加玫瑰花及玳玳花的活性提取物。现代药理研究发现,茶多酚是一种高效的抗氧化剂,天然高效,具有抗氧化、抗过敏、抗紫外线辐射、保健美容的功效[6]。汪建[7]等观察茶多酚经皮吸收可显著抑制皮肤酪氨酸酶的活性。玫瑰花性温,味属甘微苦,归肝、脾经,具有疏肝解郁,活血调经,润肠通便,解郁安神之功效,是皮肤科治疗黄褐斑常用中药。玳玳花味甘,微苦,疏肝和胃,理气解郁。二者共用,更收疏肝解郁之功。现代药理学研究发现,玫瑰中富含维生素C、鞣质、原花青素、黄酮类等多酚类化合物,具有良好的抗氧化、清除自由基及清除色素沉着的作用[8]。玳玳花,是多种保健茶饮的主要成分,其有效成分以黄酮类及多种挥发醇类物质为主,具有抗氧化作用[9]。
本实验结果显示,与空白血清对照组比较,各含药血清组对黑素细胞增殖无影响;祛斑因子A高、中、低剂量及祛斑因子B可降低黑素细胞中黑素含量、抑制酪氨酸酶活性,且与维生素C、太太美容口服液效果相当;各含药血清组均能降低酪氨酸酶mRNA的表达。据此可推测,祛斑因子A、B对酪氨酸酶活性的抑制作用机制除了通过抑制酪氨酸酶mRNA的表达从而减少其合成量之外,还可能与药物中有效成分对酪氨酸酶有竞争性抑制作用相关。此外,祛斑因子A、B还可抑制黑素细胞GTP-RhoA和GTP-Rac1蛋白的表达,其抑制作用优于太太美容口服液组,但较维生素C组的抑制作用弱,而祛斑因子A低、中剂量组及祛斑因子B对黑素细胞转运抑制率均高于维生素C组,可推测祛斑因子A低剂量及祛斑因子B除了抑制黑素细胞树突生长及黏附功能外,对黑素转运还有其他抑制途径的可能。
综上所述,祛斑因子A、B可降低酪氨酸酶活性,进而降低黑素含量,并能抑制树突结构蛋白GTP-RhoA和GTP-Rac1的表达,从而抑制黑素小体转运。因此,祛斑因子能够通过减少黑素生成及转运两种途径来抑制黑素在表皮的分布,从而具有防治黄褐斑的作用。
| [1] |
张君涛, 王平, 刘爱峰, 等. 中药含药血清制备方法的研究概述[J]. 中华中医药杂志, 2015, 30(11): 4006-4009. |
| [2] |
Halaban R.Culture of Melanocytes from Normal, Benign, and Malignant Lesions.In: Fragner RP, Feshney RI, eds.Cultu re of human tumor cells[M].New York: Wiley, 2004: 288-318.
|
| [3] |
Sheth VM, Pandya AG. Melasma:a comprehensive update:partI[J]. Am Acad Demmtol, 2011, 65(4): 689-698. DOI:10.1016/j.jaad.2010.12.046 |
| [4] |
Wang WQ, Wu JF. Narrow-band UVB radiation promotes dendrite formation by activating Rac1 in B16 melanoma cells[J]. Molclin Doncol, 2013, 1(7): 858-862. |
| [5] |
Braga VMM, Del MA, Machesky L, et al. Regulation of cadherin fuction by Rho and Rac Modulation by Junction Maturation and Cellular Context[J]. Molecular Biology of the Cell, 1999, 10(1): 9-22. |
| [6] |
张双双, 方芳. 茶多酚(TP)与皮肤病治疗的研究进展[J]. 复旦学报, 2015, 42(2): 273-278. DOI:10.3969/j.issn.1672-8467.2015.02.023 |
| [7] |
汪建, 杨长福, 王和生, 等. 茶多酚经皮给药对小鼠皮肤中酪氨酸酶活性的影响[J]. 中药药理与临床, 2013, 29(4): 82-83. |
| [8] |
俞秀红. 玫瑰花的保健功能与其应用的研究进展[J]. 福建农业科技, 2016, 4(17): 46-48. |
| [9] |
庞海月, 黄黉坦, 郑永标, 等. 玳玳花黄酮提取物抗肝癌细胞氧化损伤作用探究[J]. 食品研究与开发, 2018, 39(15): 167-171. DOI:10.3969/j.issn.1005-6521.2018.15.032 |
2. Shanghai Seventh People's Hospital, Shanghai 422700, China;
3. Xuzhou Hospital of Traditional Chinese Medicine, Xuzhou 221000, China
 2019, Vol. 36
2019, Vol. 36