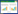文章信息
- 谭佳威, 白洁, 田湾湾, 洪婷婷, 梁军, 钟琳瑛, 张琦, 刘彩凤, 陆洋, 杜守颖
- TAN Jiawei, BAI Jie, TIAN Wanwan, HONG Tingting, LIANG Jun, ZHONG Linying, ZHANG Qi, LIU Caifeng, LU Yang, DU Shouying
- 白芍药材的质量属性研究及产地评价
- Study on quality attributes and origin evaluation of Paeonia lactiflora
- 天津中医药, 2019, 36(5): 504-510
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(5): 504-510
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.05.22
-
文章历史
- 收稿日期: 2019-01-03
仲景之方,组方严谨,疗效卓越,其组方法度与临床疗效堪称后世方剂的典范,为历代医家所称赞。其中《伤寒论》是医学史上的集大成之作,是中医经典的核心组成部分。《伤寒论》共载药215种,芍药配伍组方使用频率高达56次,芍药的使用频率在单味药中排名第5。现行《伤寒论》教材全书所提及的名方共115方,其中含芍药的有33方,芍药用量频次最高的为3两,占15方。在这15方中,除去1个散方外,共14个汤方,其中加水煎煮至3升的用法共涉及11首。由于受历史时期的限制,汉代芍药并无赤白之分,后世医家对芍药究竟是用赤芍还是白芍的争论从未停息过。笔者认为既然汉代芍药混用,就不能有所偏倚,排除另外一种芍药的可能性,所以应根据具体的方具体分析。以目前笔者正在研究的经典名方真武汤说明,真武汤证为肝脾肾三阴同病,芍药酸敛入肝,可调养厥阴肝木,使肝木条达疏泄的功能得以恢复,从而达到敛阴和营,缓急止痛,柔肝调气,利小便等主治功效,据此推断真武汤中的芍药指现今之白芍[1-5]。
白芍是毛茛科植物芍药Paeonia lactiflora Pall.的干燥根[6],具有养血敛阴、柔肝止痛、平抑肝阳等功效[7]。白芍中含有白芍总苷、鞣质、三萜类、挥发油等化学成分[8],现代研究表明,白芍总苷是白芍中最具代表性的活性成分,具有抗炎、镇痛、保肝,对心肌缺血再灌注损伤的保护和抗氧化等药理作用[9-12]。白芍主产于安徽、浙江、四川、山东等地[13],受土壤、气候及生态环境等影响,药材品质存在一定的差异性[14]。本研究首先测定影响白芍药材关键质量的成分芍药苷含量,评判药材是否符合药典标准。然后采用水回流提取法,参考上述提及的频次最高的参数(白芍剂量为3两≈41.4 g,溶剂用量为3升≈600 mL[15]),摸索并建立白芍药材水煎液的特征图谱,结合出膏率,通过化学计量学和成分分析开展不同产地白芍药材的质量属性研究,为白芍药材的产地评价提供参考。借着国家对中药经典名方的重视及其发展的春风,此项研究为含白芍的经方研发提供新的实验依据,有一定的实用性。
1 仪器与试药 1.1 仪器Thermo Fisher U3000高效液相色谱仪(DAD检测器,CM 7.2色谱工作站);赛多利斯BT 125D(赛多利斯科学仪器(北京)有限公司);电子分析天平赛多利斯BSA 224S电子分析天平(赛多利斯科学仪器(北京)有限公司);JM-B10002电子天平(余姚市纪铭称重校验设备有限公司);DZF-6051型真空干燥器(北京利康达圣科技有限公司);KQ5200DA型数控超声波清洗器(昆山市超声仪器有限公司);MH-250调温型电热套(北京科伟永兴仪器有限公司)。
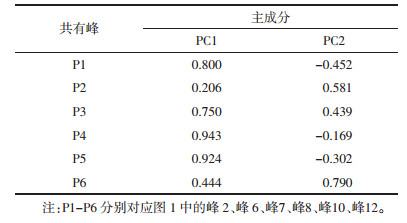
1.2 试药白芍药材由神威药业集团有限公司自采及购买,见表 1,经北京中医药大学中药学院鉴定系张媛教授鉴定为毛茛科植物芍药Paeonia lactiflora Pall.的干燥根。夏、秋二季采挖,初加工方法为:洗净,除去头尾和细根,置沸水中煮后除去外皮或去皮后再煮,干燥方法为:晒干。所有样品的生长年限均在两年左右。
芍药苷对照品(购自中国食品药品检定研究院,批号110736-201741);没食子酸(购自上海源叶生物科技有限公司,CAS:149-91-7);(+)-儿茶素(购自中国食品药品检定研究院,批号877-200001);(-)-儿茶素(购自中国食品药品检定研究院,批号878-200102);芍药内酯苷(购自上海源叶生物科技有限公司,CAS:39011-90-0);鞣花酸(购自上海源叶生物科技有限公司,CAS:476-66-4);苯甲酸(购自上海源叶生物科技有限公司,CAS:65-85-0);苯甲酰芍药苷(购自上海源叶生物科技有限公司,CAS:38642-49-8);磷酸(Fisher公司,色谱纯);乙腈(Fisher公司,色谱纯);水(杭州娃哈哈集团有限公司),其他试剂均为分析纯。
2 白芍中指标性成分芍药苷的含量测定方法及结果 2.1 色谱条件的建立[6](参考2015版《中国药典》一部白芍药材项下)色谱柱为Thermo AcclaimTM 120 C18色谱柱(250 mm×4.6 mm,5 μm);流动相是乙腈-0.1%磷酸溶液(14:86);检测波长为230 nm;柱温为30 ℃;流速是1.0 mL/min;进样量是10 μL。
2.2 对照品溶液的制备取芍药苷对照品适量,精密称定,加甲醇制成每1 mL含46.17 μg的对照品溶液。
2.3 供试品溶液的制备取本品中粉约0.1 g,精密称定,置50 mL量瓶中,加稀乙醇35 mL,超声处理(功率240 W,频率45 kHz)30 min,放冷,加稀乙醇至刻度,摇匀,滤过,取续滤液进行HPLC分析。每批药材平行制备2个样品,共42个样品。
2.4 样品测定精密称取21批白芍药材中粉粉末,分别按照“2.3”项下方法制备供试品溶液,按“2.1”项下的色谱条件进行测定,结果见表 2。由结果可知,除S16(广西灵山)中芍药苷含量太低(仅0.19%),其余样品中芍药苷的含量均不低于1.6%,符合药典标准。四川中江、安徽亳州、湖南、浙江磐安4个产地药材中芍药苷的含量远高于药典标准,以芍药苷含量为考察指标,这4个产地的白芍药材质优。
|
通过多次对色谱条件的调节,从峰的数量、峰形、分离度、响应值、出峰时间等进行综合考虑,最终确立色谱条件为:Thermo AcclaimTM 120 C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-0.1%磷酸溶液(B),洗脱梯度如下:0~7 min,3% A等度;7~29 min,3~14% A;29~32 min,14% A;32~44 min,14%~18% A;44~59 min,18%~27% A;59~70 min,73%~40% A;检测波长为230 nm;柱温为30 ℃;流速为1.0 mL/min;进样体积为20 μL。
3.2 对照品溶液的制备取芍药苷对照品适量,精密称定,加甲醇制成1 mL含46.17 μg的对照品溶液。
3.3 供试品溶液的制备将白芍药材切成1~2 mm规格的片或小块,精密称取6.9 g于250 mL圆底烧瓶中,精密加入100 mL水,加热回流70 min后放冷,摇匀后用纱布过滤,滤液加水定容至100 mL量瓶中,稀释1倍后,将稀释水液离心(10 000 r/min,5 min),取上清液滤过,用续滤液进行HPLC分析。(参照前言部分,药材取样量和加水用量进行了同比例缩小处理)。
3.4 方法学考察 3.4.1 精密度实验取S1号白芍药材,按照“3.3”项下方法制备供试品溶液,按“3.1”项下的色谱条件,连续进样6次进行测定,以芍药苷的保留时间和峰面积为参照,分别对各共有峰的相对保留时间及相对峰面积进行统计。结果显示,各共有峰的相对保留时间的RSD在0.01%~0.03%,相对峰面积的RSD在0.09%~1.07%,采用国家药典委员会“中药色谱指纹图谱相似度评价系统(2012版本)”软件进行处理,6次测定的图谱与对照图谱的相似度为1,说明该仪器精密度良好。
3.4.2 重复性实验取S1号样品平行制备供试品溶液6份,测得各共有峰的相对保留时间RSD在0.01%~0.12%,共有峰的相对峰面积RSD在0.16%~3.93%,6次测定的图谱与对照图谱的相似度为1,说明所用方法重复性良好。
3.4.3 稳定性实验取S1号样品制备供试品溶液1份,分别在0、3、6、9、12、24 h进行测定,测得各共有峰的相对保留时间RSD在0.01%~0.05%,共有峰的相对峰面积RSD在0.22%~4.95%,6次测定的图谱与对照图谱的相似度为1,说明该样品在24 h内稳定。
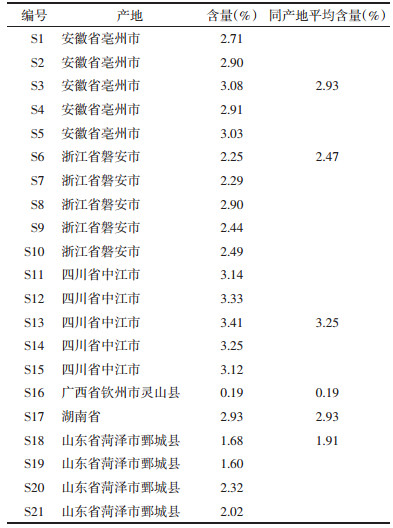
3.5 不同产地白芍药材水煎液特征图谱的评价 3.5.1 相似度评价及成分鉴别将6个产地21批次白芍药材的数据采用国家药典委员会“中药色谱指纹图谱相似度评价系统(2012版本)”软件进行处理,将S1设置成参照图谱,选择对照图谱生成方式为“中位数”法,设定时间窗宽度为0.1 min,系统根据多批次样品色谱图的共有模式生成对照图谱R,以图谱中峰面积最大且稳定的成分芍药苷为对照峰,对白芍样品共有模式中已标定的6个共有峰进行计算,计算出21批白芍药材特征图谱与对照图谱R的相似度分别为:0.932,0.977,0.990,0.995,0.921,0.985,0.989,0.998,0.962,0.989,0.999,0.998,0.999,0.998,0.989,0.856,0.991,0.913,0.929,0.829,0.993,见图 1。除S16和S20之外,其余样品与对照图谱间的相似度均大于0.9,说明安徽亳州、浙江磐安和四川中江、部分山东鄄城及湖南产地的白芍药材相似度良好。安徽亳州、浙江磐安与四川中江产地内的白芍质量均一,湖南产地与这3个产地的药材质量接近;广西灵山与部分山东鄄城产地的白芍样品质量较为接近,与其他产地药材有一定差异;而4批山东鄄城产地内的白芍质量差异较大。
|
| 标红数字所对应的峰代表共有峰,标蓝数字所对应的峰代表非共有峰 图 1 21批白芍药材的HPLC特征图谱 Fig. 1 HPLC characteristic spectra of 21 batches of extract of Paeonia lactiflora |
使用相关标准物质的比对,结合成分的吸收光谱,通过比较与分析,对白芍药材水煎液中的成分进行鉴定,详情见表 3。

|
分析如下:从共有峰来看,S16中的峰2、7、8、10和12的面积很小(峰2的相对峰面积为0.02%,其余批次的平均相对峰面积占0.79%;峰7的相对峰面积为2.55%,其余批次的平均相对峰面积为30.98%;峰8的相对峰面积是0.14%,其他批次的平均相对峰面积占1.12%;峰10的相对峰面积是3.13%,其余批次的平均相对峰面积为25.79%;峰12的相对峰面积为0.25%,其余批次的平均相对峰面积是1.47%);S20中的峰6的面积很大(峰6的相对峰面积是22.64%,其余批次平均的相对峰面积是5.94%)。
从非共有峰角度,S16中的峰3面积很大(峰3的相对峰面积是63.57%,其余批次平均的相对峰面积是5.13%);S20中的峰3面积较大(峰3的相对峰面积是3.30%),峰4面积很大(峰4的相对峰面积是6.44%,其余批次平均的相对峰面积占0.34%)。
基于共有峰与非共有峰的相对峰面积比较的结果,进一步论证了S16和S20这两个批次样品确实与其他样品存在差异。
3.5.2 聚类分析聚类分析(HCA)是在不清楚分为几类才合适的情况下,采用已收集的资料,借助数理统计方法找出研究对象合适的归类方法,是一种研究怎么将样品或变量分类的手段[16]。本研究运用SPSS 25软件,以白芍药材中6个共有峰峰面积为原始数据,将其峰面积相对于称样量量化后,进行Q型聚类分析。采用组间联接法,以余弦距离法作为样品间距离计算方法进行系统聚类分析,聚类结果见图 2。由结果可知,当21批样品分成两类时,S16和S20聚为一类,其余样品聚到一类;当21批样品分成三类时,S16和S20分为一类,S18和S19聚成一类,其余样品聚为一类。结果表明,即使是同一产地所产白芍,质量也不尽相同。这与相似度评价结果基本一致。
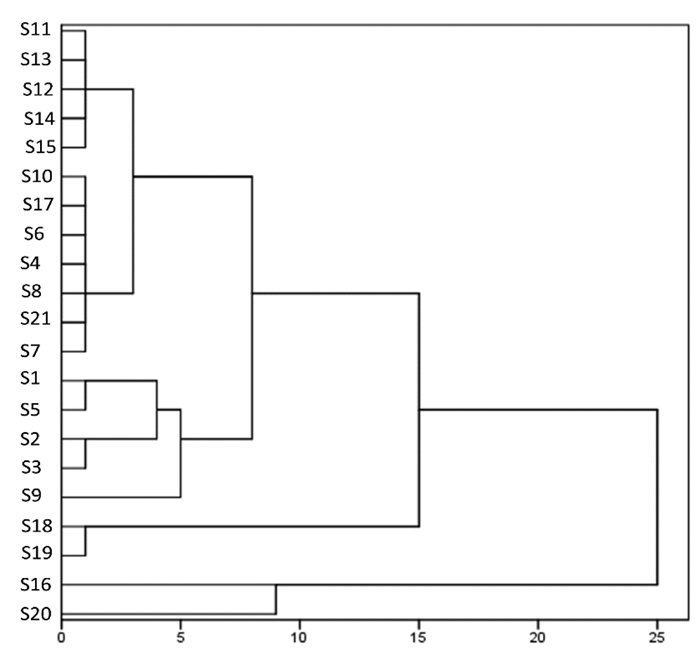
|
| 图 2 系统聚类树状图 Fig. 2 Dendrogram for the systematic clustering |
在对多指标进行研究分析时,多个数指标及它们之间的相互关系致使分析工作较困难,主成分分析法(PCA)是一种通过降维技术,用少数几个具有代表的综合性指标,根据贡献率的大小代替多个原始变量,从而达到简化多指标分析的目的,是一种化繁为简的多元统计分析方法[17-18]。对21批白芍药材特征图谱中量化的各共有峰峰面积标准化处理后,借助SPSS 25软件对所得的6个共有峰进行主成分分析,求出相关矩阵的特征值及其方差。按照主成分对应的特征值应大于1的提取原则,本研究共提取了两个主成分,累积贡献率达到77.703%,表明这两个主成分能代表6个共有峰在21批样品中的大部分信息。其中PC1的特征值为3.184,方差贡献率为53.059%;PC2的特征值为1.479,方差贡献率为24.644%。主成分载荷矩阵见表 4。
在上表中,6个共有峰对应影响主成分的6个变量,主成分载荷矩阵反映了各变量对主成分的贡献大小和作用方向。特征向量的数值和符号代表变量在主成分中的权重,权重越大,表明该化合物在药材主成分分析中的作用越大[19]。由表可得:共有峰峰2、峰7(芍药苷)、峰8和峰10(苯甲酸)对PC1的影响很大,而PC1相比于其他主成分在说明不同产地白芍药材特征图谱的信息中起关键作用。以PC1和PC2的得分向量分别作为横、纵坐标对21个样本作主成分得分图(图 3)。通过结果得知:S1~S15、S17~S19、S21样品分布较近,说明安徽亳州、浙江磐安和四川中江、部分山东鄄城及湖南产地的白芍药材的质量接近;S16(广西灵山)和S20(山东鄄城的其中一批)离群较远,分布相对独立,其质量与其他产地药材质量相差较大。主成分分析结果与相似度评价、聚类分析结果相符。
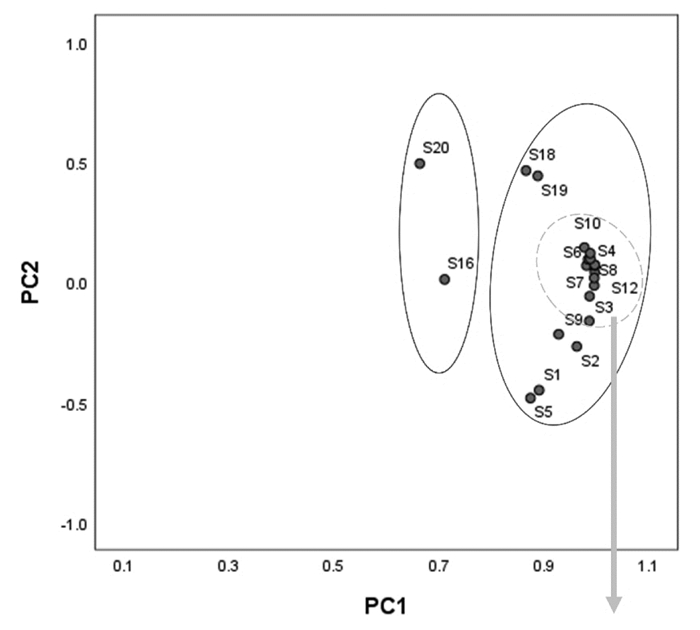
|
| 图 3 主成分得分图 Fig. 3 PCA score figure |
将白芍药材切成1~2 mm规格的片或小块,精密称取6.9 g于250 mL圆底烧瓶中,精密加入100 mL水,加热回流70 min后用300目尼龙筛网趁热过滤,所得滤液用蒸发皿收集并置于水浴锅上,加热浓缩成稠膏状,再将其置于真空干燥器中,60 ℃干燥60 h,取出称质量,计算出膏率。
4.2 出膏率的测定结果21批白芍样品平均出膏率为14.94%,整体出膏率水平在12.53%~16.19%范围内,相对稳定且集中,为含白芍的复方制剂成型提供了重要保障。其中安徽亳州的出膏率最高(16.19%),浙江磐安的出膏率最低(12.53%),其他产地的白芍药材出膏率处于平均值左右。以出膏率为考察指标,在这6个产地中,安徽亳州的药材品质最佳。
5 研究总结与讨论 5.1 优质白芍药材的产地考察本研究证明广西灵山的白芍药材中芍药苷含量过低,达不到药典标准,且通过化学计量学分析其质量与其他产地质量的差异较大,此产地的白芍品质差。历史上,安徽亳州、四川中江、浙江磐安和山东菏泽是白芍的主产区[20],这4个产地的白芍质量相对较优,尤其是前3个产地,在本实验中已得到进一步证明。对于4个主产区药材,本研究发现山东菏泽鄄城的白芍中芍药苷含量相比其他3个产地的要少,其图谱与对照图谱相比相似度值较低,与其他3个主产区的白芍有一定差异,且山东鄄城同一产地内的白芍质量相差较大。湖南产地的药材品质较好,但毕竟不是白芍主产区,此产地白芍药材的产量不大。结合药材质量与产量等因素综合考虑,在研究其经典名方时,对于白芍药材的来源可选取安徽亳州、四川中江和浙江磐安3个产地。
5.2 同产地药材的差异性探讨基于山东鄄城同一产地的药材品质差异较大这一研究结果,应从源头规范药材的种植与生产,确保含白芍的制剂成品质量的均一稳定性。从成分角度考虑,发现这4批山东鄄城产地的白芍药材中芍药苷亚硫酸酯的含量较高。有研究证明芍药苷亚硫酸酯和芍药苷的含量呈负相关,这可能与白芍本身的质量差异相关,但也可能是由于这几批药材在产地粗加工过程中采用了二氧化硫熏蒸的方法[21-22]。这有待进一步考察与商榷,如果因前者而起,应加强对其种质的保护和恢复;如因后者导致,则需在其生产加工上进行规整,在市场流通方面加强监管,严格执行法定的限量标准,进一步完善白芍质量标准,保证白芍药材的安全与有效性。
5.3 流动相体系和检测波长的选取说明本实验主要对色谱条件中的流动相体系和检测波长进行考察。分别考察了乙腈-水、乙腈-0.1%磷酸溶液与甲醇-0.1%磷酸溶液3种流动相体系,结果发现以乙腈-水为流动相,在有机相比例较低的阶段,色谱图中有一段出现“鼓峰”,基线波动很大;以甲醇-0.1%磷酸溶液为流动相,样品中成分洗脱所需时间太长,且峰形相对较差;三者中以乙腈-0.1%磷酸溶液为流动相的图谱效果最佳,因此选择它为流动相体系。对210~300 nm波长段中整十的波长进行考察,发现在230 nm波长下,图谱所呈现的信息更全面,响应值较高,且基线较为平稳,故选择230 nm作为检测波长。
5.4 白芍药材的提取方法说明白芍是经典名方真武汤水煎液中成分最多的一味药,本研究首先按照药典方法进行白芍中指标性成分芍药苷的含量测定,然后基于《古代经典名方中药复方制剂物质基准的申报资料要求(征求意见稿)》的思路,采用水回流提取法,通过白芍药材水煎液特征图谱和出膏率开展质量属性研究。明确白芍水煎液中一些重要的活性物质,结合化学计量学对白芍药材的产地进行深入研究。采用水回流法,一是考虑临床用药以水为媒介,二是考虑回流法具有提取效率高,且节约溶剂与药材等优势。
5.5 白芍水煎液中不稳定成分的探讨白芍药材水回流提取后的即时颜色是明亮的黄色,随着放置时间的延长,白芍水液的颜色逐渐加深,从黄色过渡到棕色,最后逐渐变为棕黑色。经液相检测,在可见光区并未检测到色谱峰,结合文献分析可知引起此现象的原因是白芍中有鞣质类成分存在,易被氧化,比如:没食子酸、鞣花酸等。没食子酸和鞣花酸在水液中不稳定,没食子酸随着放置时间的延长其含量呈下降趋势;鞣花酸随放置时间延长,含量反而呈现上升趋势;五没食子酰葡萄糖在50%热乙醇溶液中的提取率最大,而在水中的提取率较低,所以在图谱中此成分的峰面积较低,且有部分药材检测不到五没食子酰葡萄糖的色谱峰。这是成分的分解和成分间转化的结果,此类成分在白芍水液或含白芍的复方煎剂中不宜作为共有峰[23]。苯甲酸可由苷类成分水解生成,在延长煎煮时间后发现,苷类物质的含量会降低,而苯甲酸的含量反而有所增加。
| [1] |
李宇航. 《伤寒论》方药剂量与配伍比例研究[M]. 北京: 人民卫生出版社, 2015.
|
| [2] |
刘萍. 芍药、白芍、赤芍的历代本草考证浅析[J]. 中华中医药杂志, 2018, 33(12): 5662-5665. |
| [3] |
刘玉莹, 杨军. 经方中芍药的运用[J]. 中国民族民间医药, 2016, 25(20): 4-5. |
| [4] |
车晓璐, 刘凤斌. 真武汤中芍药作用疑析[J]. 新中医, 2011, 43(12): 134-135. |
| [5] |
王东升, 赵鸣芳. 也谈真武汤中芍药的意义[J]. 中华中医药杂志, 2018, 33(1): 53-55. |
| [6] |
国家药典委员会.中华人民共和国药典[S].一部.北京: 中国医药科技出版社, 2015.
|
| [7] |
高学敏. 中药学[M]. 北京: 中国中药出版社, 2017.
|
| [8] |
崔虹, 朱佳茜, 冯秋芳, 等. 中药白芍化学成分及生物活性研究进展[J]. 海峡药学, 2017, 29(9): 1-5. DOI:10.3969/j.issn.1006-3765.2017.09.001 |
| [9] |
刘芬. 白芍总苷对急性化学性肝损伤小鼠的保护作用研究[J]. 中药药理与临床, 2015, 31(4): 100-102. |
| [10] |
左志燕, 詹淑玉, 黄嬛, 等. 白芍总苷保肝作用的药动学和药效学研究进展[J]. 中国中药杂志, 2017, 42(20): 3860-3865. |
| [11] |
刘芬, 詹文红. 白芍总苷体外抗氧化活性研究[J]. 现代药物与临床, 2015, 30(2): 132-135. |
| [12] |
史晴晴, 黄宁, 郭洋洋. 白芍总苷对脑缺血大鼠学习记忆能力及海马CA1区神经元的保护作用[J]. 中国现代中药, 2018, 20(4): 415-421. |
| [13] |
朱广伟, 李西文, 陈士林. 白芍饮片标准汤剂质量标准研究[J]. 世界中医药, 2016, 11(5): 753-757. |
| [14] |
康廷国. 中药鉴定学[M]. 北京: 中国中医药出版社, 2014.
|
| [15] |
黄英杰.《伤寒论》用药剂量及其相关问题的研究[D].北京: 北京中医药大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10026-2007077832.htm
|
| [16] |
孙振球, 徐勇勇. 医学统计学[M]. 北京: 人民卫生出版社, 2018.
|
| [17] |
杨冰月, 李敏, 施佳, 等. 半夏及其炮制品姜半夏HPLC特征指纹图谱系统性研究[J]. 中草药, 2014, 45(5): 652-658. |
| [18] |
陈晓红, 岳显可. 基于聚类分析和主成分分析浙产覆盆子HPLC指纹图谱研究[J]. 中国中医药科技, 2018, 25(3): 350-354. |
| [19] |
曾滟棱, 谭宁, 高艳, 等. 不同产地土贝母中皂苷类成分的HPLC特征图谱及3种主要皂苷的含量测定[J]. 药物评价研究, 2018, 41(10): 1816-1822. |
| [20] |
查良平, 杨俊, 彭华胜, 等. 四大产地白芍的种质调查[J]. 中药材, 2011, 34(7): 1037-1040. |
| [21] |
王赵, 陈玉武, 王琼, 等. 硫熏白芍的质量评价[J]. 国中药杂志, 2014, 39(16): 3074-3077. |
| [22] |
严倩茹, 邬伟魁. 白芍饮片的质量现状与质量控制方法研究进展[J]. 药物评价研究, 2015, 38(2): 229-232. |
| [23] |
黄月纯, 魏刚, 刘翠玲, 等. 白芍HPLC特征指纹图谱的稳定性考察[J]. 中药新药与临床药理, 2010, 21(3): 281-284. |
 2019, Vol. 36
2019, Vol. 36