文章信息
- 石旭柳, 乔淼, 伍明江, 张洪敏, 丁丽琴, 邱峰
- SHI Xuliu, QIAO Miao, WU Mingjiang, ZHANG Hongmin, DING Liqin, QIU Feng
- 痛风和高尿酸血症动物模型研究进展及代谢通路分析
- Overview of animal models of gout and hyperuricemia and metabolic pathway analysis
- 天津中医药, 2019, 36(5): 511-515
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(5): 511-515
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.05.23
-
文章历史
- 收稿日期: 2018-11-15
2. 天津中医药大学天津市现代中药重点实验室, 天津 301617
痛风属于中医“痹症”范畴,其病因病机分为湿热论、痰浊论、瘀毒论和湿热、痰浊、瘀毒互结论,多涉及脾胃、肝、肾、三焦。痛风是嘌呤代谢发生障碍,致使体内尿酸含量增高,并出现积蓄沉淀的代谢性疾病,在临床上主要有高尿酸血症、累及肾脏引发的痛风性肾病、反复发作性痛风性关节炎。美国风湿性关节炎协会修订血清尿酸含量可用于痛风诊断[1],且该值具性别差异[2],男性≥ 416.0 μmol/L(70 mg/L)和女性≥ 357.0 μmol/L(60 mg/L)可确诊高尿酸血症,为痛风的风险因素之一[3]。2000—2014年中国大陆高尿酸血症的患病率为13.3%(男性为19.4%,女性为7.9%)[4]。
在全球范围内,痛风患病率逐步增长[5-6],高尿酸血症在中国成人中的校正患病率可达8.4%[7]。一般来说,痛风和高尿酸血症发病率有年龄、性别相关性,男性发病率多为女性的2~6倍[6],且与2型糖尿病、代谢综合征、慢性肾病及心血管疾病[8-10]等关联密切,累及多个系统,严重影响人类健康。因此,选择适合的动物模型进行相关研究已显得至关重要。笔者对痛风和高尿酸血症动物模型进行总结,同时,结合代谢组学研究得到的模型组与痛风和高尿酸血症患者差异物,采用Metaboanalyst 3.5(MetPA)(http://www.metaboanalyst.ca/)进行Pathway分析,比较高尿酸血症动物模型组与临床患者代谢通路的异同,以助于选择更接近临床发病特点的动物模型,进一步为痛风和高尿酸血症发病机制及抗痛风中药开发等研究提供依据。
1 痛风和高尿酸血症动物模型 1.1 直接补充尿酸或尿酸前体法诱导痛风模型直接体内补充尿酸或增加尿酸前体物质的摄入,致使嘌呤代谢障碍,导致其终产物尿酸水平异常,当血清尿酸超过一定饱和溶解度后,可有结晶体蓄积于软组织,如趾关节、踝关节等,出现炎性反应,发展成痛风性关节炎。
1.1.1 尿酸钠盐晶体(MSU)诱导局部痛风性关节炎模型痛风性关节炎已成为临床最常见的炎性关节炎[11],其特征是在关节或其他组织滑液中有MSU沉淀[12]。在动物实验中通过直接向关节部注射尿酸,增高动物体内尿酸水平,造成尿酸晶体在局部沉积,诱发动物痛风性关节炎模型。
Pineda等[13]研究发现,在42只兔膝上随机注射50 g/L MSU或别嘌呤醇晶体悬浮液,对照组用磷酸盐缓冲液做同等处理,其中对照组21只兔膝,MSU组12只,别嘌呤醇晶体组9只在第1、3和7天进行超声评估、滑液和组织病理学分析,结果显示MSU组关节中出现点状聚集体,而在对照组和别嘌呤醇晶体组中未发现,该研究表明,MSU诱发急性关节炎兔模型有效地复制了人类急性痛风性炎症。Santos等[14]给Wistar大鼠关节腔注射50 μL MSU 1.25 mg诱发痛风性炎症,以考察格列本脲3 mg/kg或地塞米松8 mg/kg对大鼠关节损伤感染、水肿及白细胞浸润炎性反应的作用。通过给每只大鼠的脚踝关节注射MSU晶体(100 g/L溶于生理盐水)诱导痛风性关节炎模型,同时采用核磁共振方法测定了模型组血浆中差异物有Leucine、Lysine、Lactate、Glutamine、Glucose[15]。费洪新等[16]在昆明小鼠后足右侧足底皮下注射2.5%尿酸钠溶液0.05 mL,同时在小鼠后足右侧背侧足趾部注射等量的尿酸钠溶液,足趾注射部出现肿胀,且没有液体溢出提示造模成功,采用该模型考察车前子对炎性反应的作用。
采用MSU注射法能够诱发兔子、大鼠、小鼠等实验动物局部痛风性关节炎,该模型为外源性注入MSU介质,易于操作,能在多种动物上复制局部痛风性关节炎,可用于局部痛风性关节炎药物的筛选;借助外部方法直接给予大量的尿酸引起MSU在关节局部沉积,比人类长期因嘌呤代谢途径紊乱引发尿酸沉积所致的痛风性关节炎更迅速。
1.1.2 补充高蛋白、高嘌呤等尿酸前体饮食诱导高尿酸血症动物模型酵母粉或酵母提取糊造价低,且富含蛋白、核酸和维生素B等,这些物质在降解过程中会产生嘌呤和嘧啶。高酵母饮食会干扰嘌呤代谢途径,诱导黄嘌呤氧化酶,增强其活性,加速黄嘌呤向尿酸转化,致使血尿酸水平升高,与人类高蛋白饮食引发的高尿酸血症相似,接近临床发病。
酵母提取糊按30 g/kg剂量(0.5% CMC-Na混悬)灌胃予以昆明小鼠,每天1次持续14日,小鼠血尿酸水平增加到(135.5±29.2)μmol/L,诱发其高尿酸血症[17]。灌胃给予小鼠30 g/kg剂量的酵母膏和300 mg/kg氧嗪酸钾,造模14 d后,发现血清尿酸和尿素氮水平均显著升高,同时肾组织病理切片可见肾小管上皮细胞脱落[18]。Chen等[1]按7.5 g/kg剂量灌胃给SD大鼠10%酵母浸提物饮食,每天1次持续35日,发现酵母浸提物组大鼠血尿酸水平显著增高,确定建立高尿酸血症模型。同时,借助代谢组学分析方法比较模型组和对照组,从中筛选出高尿酸血症相关差异物有Urate、Lactate、Pyruvate、Ornithine、Ribonate、Galactonate、Aspartate、Proline、Glutamine、Serine、Pyroglutamate、Glucose。然而,酵母粉灌胃体积大,易造成实验动物损害,甚至有研究显示[19]采用酵母法造模会出现实验动物死亡。
通过给予高蛋白、高嘌呤、高胆固醇等饮食也可诱发高尿酸血症。给予鸡高蛋白高钙饲料,复制出鸡痛风模型,该模型与人类高尿酸血症代谢水平机制相似[20]。马莹莹等[21]灌胃给大鼠高胆固醇脂肪乳剂(LE),同时设有高嘌呤饲料组(HPD)和对照组,造模6周后LE组和HPD组血尿酸水平都有显著升高,确定高尿酸血症;停止给LE后,各组大鼠恢复正常喂食,两周后HPD组血尿酸恢复至正常水平,而LE组血尿酸仍处于较高水平,可见高胆固醇脂肪乳剂可诱导较稳定持久的大鼠高尿酸血症模型。以700 mg/kg的剂量灌胃给予大鼠牛肉汤,持续8日可引起尿酸水平的增加,确定大鼠高尿酸血症[22]。牛肉汤中富含嘌呤类,这些物质在体内可被氧化为尿酸,尿酸含量骤增,易转为高尿酸血症。
1.2 氧嗪酸钾诱导高尿酸血症动物模型氧嗪酸钾是一种尿酸氧化酶抑制剂,可降低尿酸氧化酶活性,导致尿酸分解减少,造成短时间内体内尿酸蓄积增多。一般采用尿酸氧化酶抑制剂时常常联合高嘌呤饮食,一方面促进尿酸产生导致其在体内水平增高,另一方面由于受尿酸氧化酶抑制剂的影响使尿酸分解减少。进而从“增加来源”和“减少去路”两个方面提高尿酸含量,维持实验动物高尿酸血症。
持续28日灌胃SD大鼠腺嘌呤0.1 g/kg氧嗪酸钾1.5 g/kg,得到高尿酸血症模型[23]。Zhang[24]给小鼠腹腔注射300 mg/kg剂量的氧嗪酸钾(CMC-Na混悬);或连续7日腹腔注射250 mg/kg氧嗪酸钾可诱发高尿酸血症[25],并且通过该模型血清样本分析筛选出差异物有Creatinine、Hypoxanthine、Phenylalanine、Uric acid、Hippuric acid、Tryptophan、Indolelactic acid、Kynurenine、Citric acid、Inosine、5-Aminoimidazole ribotide。通过腹腔注射200 mg/kg氧嗪酸钾,可使ICR小鼠血清尿酸、尿素氮和肌酐的水平显著性增加[26]。同时有文献报道[27],连续7日灌胃给予大鼠2 g/kg的氧嗪酸钾也会造成实验动物高尿酸血症。
高尿酸血症动物相关研究常采用氧嗪酸钾和其他几种造模条件联合的方法来复制实验动物模型。利用代谢组学方法研究秦皮对高尿酸血症大鼠的治疗作用[28],采用联合造模方法,给予大鼠氧嗪酸钾100 mg/kg、腺嘌呤200 mg/kg和酵母提取物10 g/kg,持续4周复制高尿酸血症模型,并从中鉴定差异物有Leucine、3-Hydroxybutyrate、Taurine、Arginine、Aspartate、Lactate、Citrate、Glycogen、Glutathione、Phenylalanine、Tryptophan。腹腔注射给予Wistar大鼠黄嘌呤和氧嗪酸钾300 mg/kg,每日两次持续13日,检测血清尿酸和肌酐含量,采用联合造模诱导高尿酸血症[29]。
1.3 真菌产物诱导高尿酸血症动物模型啤酒的饮用为痛风和高尿酸血症的常见发病因素之一[30]。啤酒作为酵母发酵产物,其中含有乙醇和部分真菌抗原细胞壁和细胞内容物,还有大量的真菌代谢物和尿酸[31],采用酵母粉或酵母膏诱导实验动物模型,可能与之存在一定关联。
有研究显示其他真菌产物也会引起高尿酸血症,在给予鸡的饲料中按200~600 μg/g添加卵孢霉素,喂食3周,会诱发内脏病变和关节痛风;按400~600 μg/g添加卵孢霉素,第1周开始在内脏、肌肉、胆囊内以及心包膜尿酸盐浓度增高出现尿酸沉积[32]。Kubena等[33]在小鸡饲料中加入赭曲霉素和丹宁酸,喂养26日,赭曲霉素组和赭曲霉素联合丹宁酸组均出现显著血清尿酸水平升高,以及慢性肾损伤症状。有研究显示[34],给予猕猴黄曲霉素饮食,在炎性细胞周围会有尿酸盐结晶析出。可见,饮食摄入某些真菌代谢产物存在引发高尿酸血症可能。
1.4 药物诱导高尿酸血症动物模型临床上在使用某些药物治疗疾病时,可能会出现血尿酸升高这一不良反应,常见药物如呋塞米、吡嗪酰胺(PZA)、乙胺丁醇、环孢素[35-38]等。采用相关药物诱发实验动物高尿酸血症,有助于发现药物引起血尿酸升高的机制,利于改善药源性高尿酸血症。模型复制简单、易行,且有一定的药物针对性。
Zhao等[39]借助基于1H-NMR的代谢组学方法对给药PZA的大鼠进行研究显示,以2.0 g/kg剂量每天灌胃大鼠PZA,持续28日,结果显示血尿酸明显增加,并且由氧化应激相关的标志物可以确定肝脏黄嘌呤氧化酶的活性增强,进而证明PZA扰乱肝脏中嘌呤代谢,诱发动物高尿酸血症。以100 mg/kg和250 mg/kg每天分别灌胃大鼠腺嘌呤和乙胺丁醇,连续7日,血尿酸显著增高,确立模型[40]。该方法也可用于小鼠动物模型复制[41],灌胃给小鼠腺嘌呤150 mg/kg和乙胺丁醇250 mg/kg持续14日,血尿酸、肌酐和尿素氮均与对照组呈现显著性差异。
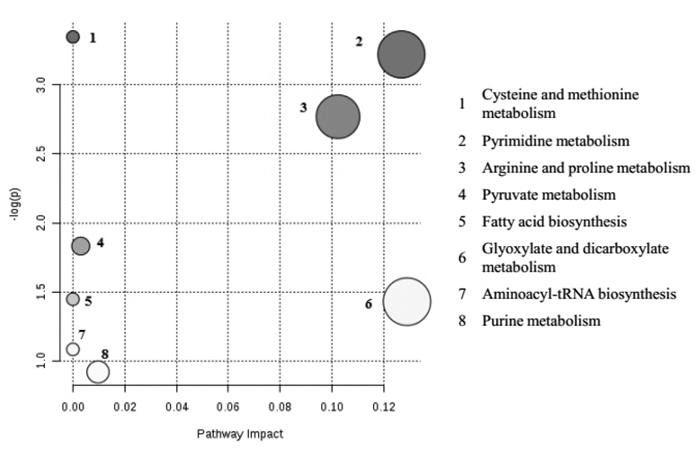
2 痛风和高尿酸血症代谢通路分析多种模型复制方法已被痛风和高尿酸血症研究者成熟运用,其中用于代谢组学研究的模型主要有尿酸钠诱发大鼠痛风性关节炎模型[15](a)、氧嗪酸钾诱导大鼠高尿酸血症模型[25](b)、酵母粉诱导大鼠高尿酸血症模型[1](c)、高嘌呤饮食联合诱导大鼠高尿酸血症模型[28](d),并确定出模型组生物标志物。同样,借助代谢组学分析方法,对痛风、高尿酸血症患者和健康对照者开展的研究也有文献报道[42],鉴定相关生物标志物有L-Homocysteic acid、4-Thiapentanoic acid、5-Methylthioribose、D-(+)-Glyceric acid、Dihydrolipoic acid、Deoxyuridine monophosphate、L-Proline、N-Acetyl-L-citrulline、Oxalic acid、Phosphocreatine、Palmitoleic acid、S-Lactoylglutathione、Thymidine-5'-monophosphate、Uric acid。采用MetPA对患者生物标志物进行Pathway分析,结果及通路如图 1所示。
|
| 图 1 痛风和高尿酸血症患者代谢通路分析 Fig. 1 Analysis of metabolic pathways in patients with gout and hyperuricemia |
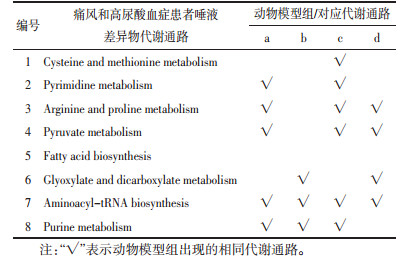
依据鉴定出a、b、c、d动物模型的标志物,采用相同代谢通路分析方法,分别得到各模型代谢通路。基于痛风和高尿酸血症患者代谢通路结果,分别比较各动物模型与患者代谢通路的异同,见表 1。
|
结合表 1发现,酵母粉诱导大鼠高尿酸血症模型与患者生物标志物分析得出的代谢通路匹配6个,匹配数目最多,除酵母粉富含多种食物来源外,还可能由于酵母粉常用作酵母发酵的来源,而酵母通过发酵作用多用于酿制啤酒[31];酵母粉诱导高尿酸血症模型可能与中医湿热论中“饮食失慎,嗜酒、肥甘厚味”所致高尿酸血症机制相近,研究湿热内蕴,痹阻经络所致痛风和高尿酸血症时[43],可考虑选用此模型复制方法。大鼠痛风性关节炎模型的代谢通路,与患者5个通路一致,可见尿酸钠诱导痛风性关节炎在一定程度上接近临床痛风性关节炎,研究开发抗痛风性关节炎药物时,可考虑采用该造模方法。氧嗪酸钾和高嘌呤联合饮食诱导高尿酸血症模型与患者通路比较,分别匹配上3个和4个,氧嗪酸钾作为尿酸氧化酶抑制剂,通过抑制尿酸分解诱导高尿酸血症,啮齿类动物体内存在尿素酶,与人类在尿酸代谢途径上存有差异[44],其可能为该模型代谢通路匹配数量比前两者少的原因;但该模型操作简单易行,易于复制;联合高嘌呤饮食增加体内尿酸来源,维持其在体内的高尿酸水平,进行降酸药物相关研究时,可考虑采用该模型。
3 结语随着人们生活水平的提高,受“肥甘厚味,饮食不节”饮食习惯和遗传等因素的影响,痛风和高尿酸血症发病率日益增长。为寻找防治痛风和高尿酸血症的药物,多种痛风和高尿酸血症的实验动物模型已用于药物筛选:尿酸钠诱导实验动物痛风性关节炎,方法简单,操作易行;氧嗪酸钾诱导高尿酸血症模型,简便灵敏;酵母粉诱导高尿酸血症模型,与人类嘌呤代谢紊乱机制相似。近年来代谢组学已运用到痛风和高尿酸血症的研究中,借助其鉴定出的差异物,进行代谢通路分析。结合动物模型组与痛风和高尿酸血症患者代谢通路的对比结果,有助于从分子层面深入分析模型组是否接近患者疾病状态,选择与疾病代谢通路相关联的动物模型进行复制,为研究痛风和高尿酸血症中医病因病机、药源性高尿酸血症以及抗痛风中药开发等提供合理实验方法和科学依据。
| [1] |
Chen J, Zhou J, Wei S, et al. Effect of a traditional Chinese medicine prescription Quzhuotongbi decoction on hyperuricemia model rats studied by using serum metabolomics based on gas chromatography-mass spectrometry[J]. J Chromatogr B, 2016, 1026(15): 272-278. |
| [2] |
Albrecht E, Waldenberger M, Krumsiek J, et al. Metabolite profiling reveals new insights into the regulation of serum urate in humans[J]. Metabolomics, 2014, 10(1): 141-151. |
| [3] |
许春杰, 韩冬柏, 刘晓宇, 等. 基于剂量-反应关系的体力活动与血尿酸水平关系及性别差异研究[J]. 中国全科医学, 2018, 21(12): 1432-1436. DOI:10.3969/j.issn.1007-9572.2018.00.080 |
| [4] |
Rui L, Cheng H, Di W, et al. Prevalence of hyperuricemia and gout in mainland China from 2000 to 2014:a systematic review and Meta-analysis[J]. Biomed Research International, 2015(15): 1-12. |
| [5] |
Smith E, Hoy D, Cross M, et al. The global burden of gout:estimates from the Global Burden of Disease 2010 study[J]. Ann Rheum Dis, 2014, 73(8): 1470-1476. |
| [6] |
Kuo C F, Grainge M J, Zhang W, et al. Global epidemiology of gout:prevalence, incidence and risk factors[J]. Nat Rev Rheumatol, 2015, 11(11): 649-662. |
| [7] |
Liu H, Zhang XM, Wang YL, et al. Prevalence of hyperuricemia among Chinese adults:a national cross-sectional survey using multistage, stratified sampling[J]. J Nephrol, 2014, 27(6): 653-658. |
| [8] |
Marin M, Maalouf NM. Effects of pharmacological reversal of hyperuricemia on features of the metabolic syndrome in patients with gouty arthritis[J]. Journal of Investigative Medicine, 2018, 1-7. |
| [9] |
Kochman P, Stomp R T. Gout, hyperuricemia and chronic kidney disease:New treatment possibilities[J]. Polish Annals of Medicine, 2016, 23(2): 195-201. |
| [10] |
Wijnands J M, Viechtbauer W, Thevissen K, et al. Determinants of the prevalence of gout in the general population:a systematic review and meta-regression[J]. Eur J Epidemiol, 2015, 30(1): 19-33. |
| [11] |
Zhang QB, Qing YF, He YL, et al. Association of NLRP3 polymorphisms with susceptibility to primary gouty arthritis in a Chinese Han population[J]. Clinical Rheumatology, 2017, 37(1): 1-10. |
| [12] |
Ma T, Liu X, Cen Z, et al. MicroRNA-302b negatively regulates IL-1β production in response to MSU crystals by targeting IRAK4 and EphA2[J]. Arthritis Research & Therapy, 2018, 20(1): 34-44. |
| [13] |
Pineda C, Fuentesgómez A J, Hernándezdíaz C, et al. Animal model of acute gout reproduces the inflammatory and ultrasonographic joint changes of human gout[J]. Arthritis Res Ther, 2015, 17(1): 37-45. |
| [14] |
Santos R M, Oliveira S M, Silva C R, et al. Anti-nociceptive and anti-edematogenic effects of glibenclamide in a model of acute gouty attack in rats[J]. Inflamm Res, 2013, 62(6): 617-625. |
| [15] |
Han B, Huang H Z, Li Z, et al. Therapeutic effects of Chinese medicine herb pair, Huzhang and Guizhi, on monosodium urate crystal-induced Gouty Arthritis in rats revealed by anti-inflammatory assessments and NMR-Based Metabonomics[J]. Evid-Based Compl Alt, 2016, 2016(4): 1-12. |
| [16] |
费洪新, 韩玉生, 廖婷, 等. 车前子对小鼠急性痛风性关节炎的影响[J]. 黑龙江科学, 2014, 5(5): 9-11. DOI:10.3969/j.issn.1674-8646.2014.05.002 |
| [17] |
Amat N, Umar A, Hoxur P, et al. Traditional Uighur Medicine Karapxa decoction, inhibits liver xanthine oxidase and reduces serum uric acid concentrations in hyperuricemic mice and scavenges free radicals in vitro[J]. BMC Complement Altern Med, 2015, 15(1): 1-8. |
| [18] |
裴忆雪, 刘永杰, 张笛, 等. 建立高尿酸血症性肾损害小鼠模型的实验研究[J]. 中国比较医学杂志, 2018, 28(9): 46-55. DOI:10.3969/j.issn.1671-7856.2018.09.008 |
| [19] |
孔锡容, 张光荣, 杨曦. 尿酸性肾病动物模型十年研究概况[J]. 中国中西医结合肾病杂志, 2007, 8(9): 557-558. DOI:10.3969/j.issn.1009-587X.2007.09.027 |
| [20] |
何泳龙, 青玉凤, 周京国. 高尿酸血症及痛风性关节炎动物模型及其中药复方治疗概况[J]. 川北医学院学报, 2015(4): 574-578. DOI:10.3969/j.issn.1005-3697.2015.04.40 |
| [21] |
马莹莹, 吴玉兰, 朱恩伟, 等. 脂肪乳剂模拟"饮食不节"致大鼠高尿酸血症模型[J]. 中国中药杂志, 2015, 40(10): 2009-2013. |
| [22] |
Dewi A R, Nur'Aini I, Bahri IS, et al. Antihyperuricemic activity of ginger flower (Etlingera elatior Jack.) extract in beef broth-induced hyperuricemic rats (Rattus norvegicus)[C]. AIP Conference Proceedings, 2016, 1755(1): 140012.
|
| [23] |
Guo Y, Jiang Q, Gui D, et al. Chinese Herbal Formulas Si-Wu-Tang and Er-Miao-San Synergistically Ameliorated Hyperuricemia and Renal Impairment in Rats Induced by Adenine and Potassium Oxonate[J]. Cell Physiol Biochem, 2015, 37(4): 1491-1502. |
| [24] |
Zhang GB, Ren SS, Wang BY, et al. Hypouricemic effect of flaccidoside Ⅱ in rodents[J]. J Nat Med, 2017, 71(1): 329-333. |
| [25] |
Jiang T, Qian J, Ding J, et al. Metabolomic profiles delineate the effect of Sanmiao wan on hyperuricemia in rats[J]. Biomed Chromatogr, 2017, 31(2): 1-23. |
| [26] |
Huang CC, Lou BS, Hsu FL, et al. Use of urinary metabolomics to evaluate the effect of hyperuricemia on the kidney[J]. Food Chem Toxicol, 2014, 74: 35-44. |
| [27] |
巢传琦, 雷雪萍, 范春林, 等. 东革阿里提取物对氧嗪酸钾致高尿酸血症大鼠尿酸的影响[J]. 中药材, 2017, 3: 712-714. |
| [28] |
Wang Y, Zhao M, Xin Y, et al. H-NMR and MS based metabolomics study of the therapeutic effect of cortex fraxini on hyperuricemic rats[J]. J Ethnopharmacol, 2016, 185(5): 272-281. |
| [29] |
Xu C, Chen W, Liu S, et al. Study the treatment effect of polygonum cuspidatum for hyperuricemia in rats using UPLC-ESI-QTOF/MS metabolomics approach[J]. Anal Methods, 2015, 7(16): 6777-6784. DOI:10.1039/C5AY00403A |
| [30] |
沈宁.饮酒与痛风发作风险相关性的Meta分析[D].杭州: 浙江大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10335-1016283717.htm
|
| [31] |
Costantini AV. The fungal etiology of gout and hyperuricemia:the antifungal mode of action of colchicine[J]. Biomedical Reviews, 1992, 1: 47-52. |
| [32] |
Pegram RA, Wyatt RD. Avian gout caused by oosporein, a mycotoxin produced by chaetomium trilaterale[J]. Poult Sci, 1981, 60(11): 2429-2440. |
| [33] |
Kubena LF, Phillips TD, Creger CR, et al. Toxicity of ochratoxin A and tannic acid to growing chicks[J]. Poult Sci, 1983, 62(9): 1786-1793. |
| [34] |
Bourgeois CH, Shank RC, Grossman RA, et al. Acute aflatoxin B1 toxicity in the macaque and its similarities to Reye's syndrome[J]. Lab Invest, 1971, 24(3): 206-216. |
| [35] |
赵雪娇. 一例慢性心力衰竭患者服用呋塞米致高尿酸血症分析[J]. 临床合理用药杂志, 2014, 7(10): 167-168. |
| [36] |
Pham AQ, Doan A, Andersen M. Pyrazinamide-induced hyperuricemia[J]. J Clin Pharm Ther, 2014, 39(10): 695-697. |
| [37] |
Louthrenoo W, Hongsongkiat S, Kasitanon N, et al. Effect of antituberculous drugs on serum uric acid and urine uric acid excretion[J]. J Clin Rheumatol, 2015, 21(7): 346-348. |
| [38] |
邓姗姗, 朱明志, 拔敏. 环孢素A与环磷酰胺治疗特发性膜性肾病的临床研究[J]. 中国现代药物应用, 2018, 12(14): 125-127. |
| [39] |
Zhao H, Si ZH, Li MH, et al. Pyrazinamide-induced hepatotoxicity and gender differences in rats as revealed by a 1H NMR based metabolomics approach[J]. Toxicol Res, 2017, 6(1): 17-29. |
| [40] |
Zhou Q, Yu DH, Liu SM, et al. Total saponins from Discorea nipponica makino ameliorate urate excretion in hyperuricemic rats[J]. Planta Med, 2014, 80(15): 1259-1268. |
| [41] |
Meng Z, Yan Y, Tang Z, et al. Anti-hyperuricemic and nephroprotective effects of rhein in hyperuricemic mice[J]. Planta Med, 2015, 81(4): 279-285. |
| [42] |
Cui L, Liu J, Yan X, et al. Identification of novel metabolite biomarkers for gout using capillary ion chromatography with mass spectrometry[J]. Anal Chem, 2017, 89(21): 11737-11743. |
| [43] |
赵计轩, 张榜, 崔炎. 当代名老中医诊辨痛风经验总结[J]. 时珍国医国药, 2017(3): 748-750. |
| [44] |
何宏明, 冯育林, 张武岗, 等. 不同方法建立高尿酸血症动物模型研究进展[J]. 江西中医药, 2015, 46(12): 72-75. |
2. Tianjin State Key Laboratory of Modern Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2019, Vol. 36
2019, Vol. 36