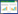文章信息
- 李津津, 张雪竹
- LI Jinjin, ZHANG Xuezhu
- 滋水涵木通络法治疗肝肾不足型斑秃疗效及Th17/Treg相关机制研究
- Study of clinical efficacy of Zishui Hanmu Tongluo method on liver and kidney deficiency patients with alopecia areata and mechanisms associated with Th17/Treg
- 天津中医药, 2019, 36(6): 568-571
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(6): 568-571
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.06.12
-
文章历史
- 收稿日期: 2018-12-18
斑秃是皮肤科常见病,表现为突然发生的局限性毛发脱落。在中医古籍中,斑秃常被称为“油风”,由肝肾不足、气血亏虚等原因引起,肝肾不足是其主要病因。西医认为该病与精神因素、免疫功能、遗传原因等有关[1]。近期研究提示,斑秃是T淋巴细胞介导的器官特异性自身免疫性疾病,患处可见T细胞浸润及炎症因子的释放,导致毛囊破坏、毛发脱落[2]。辅助T细胞17(Th17)及调节T细胞(Treg)均为新近发现的CD4+T细胞亚群。两者起源相同,但功能却相互拮抗。Th17促进炎症反应,通过分泌白介素(IL)-17、IL-6、肿瘤坏死因子-α(TNF-α)等炎症因子在炎症和自身免疫性疾病中发挥重要作用[3]。而Treg能抑制炎症反应,通过控制免疫应答的强度,防止过度免疫所致的组织损伤来维持机体的免疫稳态[4]。Th17和Treg之间功能的失衡与多种自身免疫性疾病密切相关。
笔者采用滋水涵木通络法治疗肝肾不足型斑秃,临床效果良好。本文拟从Th17/Treg功能角度,探讨滋水涵木通络法治疗肝肾不足型斑秃的机制,为促进中药疗法进一步推广应用提供依据。
1 材料与方法 1.1 实验材料总RNA提取试剂盒、逆转录试剂盒(All-in-one First-Strand cDNA Synthesis Kit)、荧光定量聚合酶链式反应(PCR)反应试剂盒均购自北京康为世纪有限公司。酶联反应吸附(ELISA)试剂盒购自德国IBL公司。所用仪器为ABI7500型荧光定量PCR仪、MD酶标仪等。
1.2 一般资料66例研究病例均来自天津中医药大学第一附属医院皮肤科门诊。其中男30例,女36例,年龄18~55岁,平均年龄38.61岁。
1.3 诊断标准西医诊断标准:参照《中药新药临床研究指导原则》“中药新药治疗秃发症的临床研究指导原则”,标准如下:1)突然或短期内头发片状脱落,单发或多发。2)脱发区皮色正常,无明显炎症反应。3)脱发区皮肤未见萎缩及瘢痕。中医证型诊断标准:参照《中医外科学》中的辨证分型标准[5]。肝肾不足证:患者平日毛发质量偏黄或偏白,突然成片状脱发,以中青年患者为主,常伴有心情抑郁,烦躁,工作生活紧张,易怒,腰膝酸软,眩晕耳鸣,易疲劳,舌红苔薄白,脉弦细。
1.4 纳入标准1)年龄在18~60周岁,性别不限。2)符合诊断标准。3)自愿接受本治疗方案并签署知情同意书。
1.5 排除标准1)不符合纳入标准的患者。2)真菌性脱发、化疗性脱发、药物性脱发、女性产后脱发、症状性脱发、内分泌性脱发(如甲状腺功能亢进、甲状腺功能低下、性腺功能减退、甲状旁腺功能低下、垂体功能低下、糖尿病等)。3)合并心脑血管病、血液系统疾病、肝脏肾脏疾病、免疫性疾病、恶性肿瘤及精神疾病等基础疾病。4)不按规定时间服药及复诊者,影响疗效或安全性判断者,资料不全或无法判定疗效者。5)哺乳期或妊娠期妇女。
1.6 剔除标准1)依从性差,无法正常完成临床观察者。2)不按时服用药物者。3)不按时复诊者。4)私自服用或外用其他药物影响疗效判断者。5)突发其他疾病必须终止治疗者。6)自动停止治疗或因故失访者。
1.7 研究方法将符合纳入标准的66例受试者,给予口服本院自拟滋水涵木通络汤剂(熟地黄30 g,山茱萸10 g,制何首乌30 g,菟丝子10 g,杜仲10 g,黄精10 g,五味子10 g,枸杞子15 g,鸡血藤30 g,女贞子10 g,墨旱莲10 g,桑椹10 g,天麻10 g,葛根10 g,桑寄生10 g,丹参15 g,柴胡10 g,郁金10 g,珍珠母20 g,泽泻10 g,甘草6 g),每日1剂,水煎服,持续12周,期间不给予任何外用药物治疗。用药前及服药12周后采集静脉血,并进行疗效评价。同时采集30名年龄、性别匹配的正常人外周血,作为正常对照,以评价用药前后患者外周血相关指标的变化。
1.8 疗效评定标准参照卫生部1997年发布的《中药新药临床研究指导原则》中关于脱发的疗效判定标准[6]。
1.8.1 主要观察项目观察患者毛发的密度、粗细、色泽、油腻、再生情况以及拉发试验。1)脱发区新生毛发密度与健发区无差别0分;稍较健发区稀疏1分,较健发区稀疏2分,明显较健发区稀疏3分。2)脱发区新生毛发粗细与健发区无差别0分,稍较健发区细软1分,较健发区细软2分,明显较健发区细软3分。3)脱发区新生毛发色泽色黑0分,色褐1分,色灰或黄2分,色白3分。4)脱发区新生毛发再生情况100%,不脱0分;大于70%且小于95%,不脱1分;大于30%且小于70%,不脱2分;小于30%或仍脱落3分。轻拉发试验,阴性0分,阳性1分。
1.8.2 疗效评价临床痊愈:毛发停止脱落,脱发区毛发全部长出,其分布密度、粗细、色泽与健发区相同,疗效指数>90%;显效:毛发停止脱落,脱发区毛发再生率达70%以上,其密度、粗细及色泽均接近健发区,60% < 疗效指数≤90%;有效:毛发停止脱落,脱发区毛发再生率达30%以上,包括毳毛及白发长出,30% < 疗效指数≤60%;无效:脱发再生不足30%或仍继续脱落,疗效指数≤30%。
1.9 PCR法测定血中维甲酸相关核孤儿受体γt(RORγt)和叉头框蛋白(Foxp3)mRNA的水平取健康人及患者新鲜血液1.5 mL,依试剂盒说明书提取总RNA,将2 μL总RNA逆转录为cDNA。将cDNA加入到含有上下游引物、荧光染料的反应体系中,进行扩增和检测。引物由上海生工合成。Foxp3的引物序列为5’-CACCCAGGAAAGACAGCAACC-3’和5’-GCAAGAGCTCTTGTCCATTGA-3’;RORγt的引物序列为5’-ACCTCCACTGCCAGCTGTGTGCTGTC-3和5’TCATTTCTGCACTTCTGCATGTAGACTGTCCC-3’;GAPDH引物序列为5’-ACCACAGTCCATGCCATCAC-3’和5’-TCCACCACCCTGTTGCTGTA-3’。PCR扩增条件为:95 ℃预变性5 min;95 ℃ 10 s、50 ℃ 20 s、72 ℃ 20 s,进行40个循环。反应结束,2-△△CT法分析结果,计算目的基因相对于参比基因GAPDH的表达情况。
1.10 酶联免疫吸附(ELISA)法测定细胞因子水平依试剂盒说明书,检测血清中Th17相关细胞因子IL-17A和Treg相关细胞因子转化生长因子β1(TGF-β1)的水平。
1.11 统计方法使用SPSS 19.0软件进行数据分析。计量资料以均数±标准差(x±s)表示,组内比较采用配对样本t检验;组间比较采用独立样本t检验。计数资料组间比较采用χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 患者治疗前后积分比较健康人及患者年龄、性别无统计学差异,组间具有可比性,见表 1。所有患者均完成12周的临床试验观察,治疗前后的积分分别为(11.85±2.08)分和(3.30±0.94)分,两者比较有显著性(P < 0.01)。提示滋水涵木通络汤剂能有效治疗斑秃。
经治疗,多数患者脱发区长出新生毛发,色泽棕黑,较为致密。患者中有14例痊愈,32例显效,18例有效,2例无效,总有效率为96.97%。
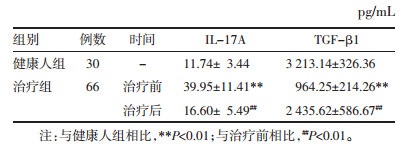
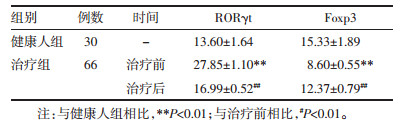
2.3 患者治疗前后RORγt和Foxp3 mRNA水平的变化与健康人相比,患者治疗前RORγt mRNA水平明显升高(P < 0.01);而Foxp3 mRNA水平明显降低(P < 0.001)。经过治疗,患者RORγt和Foxp3 mRNA水平均改善,与治疗前相比有显著性差异(P < 0.01),见表 2。
|
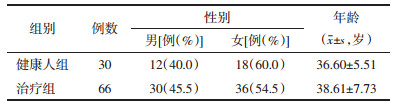
与正常人相比,患者血清中IL-17A水平显著升高(P < 0.01);而TGF-β1水平明显下降(P < 0.01)。经过治疗,患者血清中IL-17A和TGF-β1水平均有显著性差异,与治疗前相比有显著性差异(P < 0.01),见表 3。
斑秃在中医学属于“油风脱发”范畴,可发生于任何年龄,但以青壮年居多,可逐渐自愈,亦能反复发作,随长随落,经久不愈。临床上针对斑秃的病因病机(肝肾不足、血热风燥、气滞血瘀、气血亏虚等),治以滋补肝肾、益气补血、活血祛风等法。此外,也有针灸治疗斑秃的报道。斑秃是中医优势病种,中药治疗不良反应小,成本低,安全性好,长期治疗患者易于接受。但是外用药容易挥发,针刺治疗需要病人每日前来就诊,患者依从性差。因此,采用方剂口服治疗是较为合适的治疗方法。
临床斑秃患者多数表现出平素头发焦黄或花白,发病时呈大片均匀脱落,伴头昏耳鸣,目眩,腰膝酸软,舌淡,苔薄白,脉细数等肝肾不足的现象。肾藏精,肾中精气的盛衰是机体生、长、壮、老、已的根本,机体齿、骨、发的生长状态是观察肾中精气的外候。肾精化生元气,元气可外达肌腠皮毛,具有温煦和激发皮肤毛发生长的功能。肝主疏泄,当肝失疏泄,气机郁结时,导致全身气血运行不畅,毛发营养的供应受阻。血营养全身组织和器官,同样对毛发起营养作用,血的运行,必须要在气的推动下,上注于肺,行于经脉之中,均匀布散于全身。“发为血之余”,血气旺盛,则毛发也旺盛,因此在临床采用滋水涵木通络法对斑秃加以治疗。“滋水”即补益肾精,“涵木”即寓补肝于补肾之中。主在补肾,协调在肝肾。经络是人体气血运行的通路,能将营养物质输布到全身各个组织器官。方中熟地黄、制何首乌、鸡血藤为君药,旨在滋补肾精,濡养肝血,疏通脉络。山茱萸、菟丝子、杜仲、黄精、枸杞子、女贞子、墨旱莲、桑椹、桑寄生、丹参为臣药,共同辅助君药,增强其滋肾养肝通络之功效。五味子、珍珠母、泽泻、柴胡、郁金为佐药。天麻、葛根、甘草为使药。因肝肾不足容易导致肝阳偏亢,肝肾不足也会影响心脾导致血脉运行差,因此方中添加了平肝通络之品,在注重补益肝肾的同时,还侧重平肝阳、通经络,临床应用取得良好疗效。
近年研究显示,斑秃是T细胞介导的器官特异性自身免疫性疾病,患处可见T细胞浸润及炎症因子的释放,导致毛囊破坏、毛发脱落[2]。Th17和Treg细胞均为新近发现的CD4+T细胞亚群。两者起源相同,但功能却相互拮抗。Th17促进炎症反应,通过分泌IL-17、IL-6、TNFα等炎症因子在炎症和自身免疫性疾病中发挥重要作用[3]。其中IL-17最为重要,机体适应性免疫系统通过IL-17和先天免疫系统相联系,促进炎症反应过程。IL-17能诱导IL-6、TNF-α等炎症因子大量释放,引起组织浸润和破坏;并与IL-6、TNF-α等产生协同作用,放大炎症效应。RORγt是Th17重要的转录因子,能促进Th17增殖分化并调节Th17的功能。而Treg能抑制炎症反应,通过控制免疫应答的强度,防止过度免疫所致的组织损伤来维持机体的免疫稳态[4]。Treg不仅直接抑制效应T细胞的活化增殖及IL-2、γ干扰素(IFNγ)等炎症因子的分泌;还通过表达TGF-β等抗炎因子来抑制效应T细胞的活性。Foxp3是Treg细胞的关键转录因子,对Treg功能的维持有重要作用。Th17和Treg两者之间功能的失衡是多种自身免疫性疾病及炎性疾病发生发展的关键原因。研究显示,斑秃患者血清Th17水平较高,而Treg水平较低[7];脱发处毛囊周围有Th17细胞浸润[8];而Treg细胞明显减少[9]。本研究结果也发现,患者血液中RORγt mRNA表达和致炎因子IL-17A的浓度较正常人升高,而Foxp3 mRNA和抗炎因子TGF-β1水平下降。提示患者体内Th17细胞功能增强,而Treg细胞功能下降,体内环境处于免疫调节失衡状态。经药物治疗后,上述情况得以好转。说明滋水涵木通络法治疗斑秃能降低患者体内过度活化的免疫反应,减轻局部炎症损伤,起到保护毛囊、抑制脱发的作用。
综上,斑秃的发病可能与Th17/Treg细胞间功能失衡有关,滋水涵木通络法通过调节患者体内Th17/Treg细胞的免疫功能及与两者相关的致炎与抗炎因子水平,来抑制过度活化的免疫炎症反应,进而促进毛发生长。
| [1] |
赵辨. 临床皮肤病学[M]. 第3版. 南京: 江苏科学技术出版社, 2001: 947.
|
| [2] |
Ito T. Recent advances in the pathogenesis of autoimmune hair loss disease alopecia areata[J]. Clinical and Developmental Immunology, 2013, 1-6. |
| [3] |
Yosef N, Shalek AK, Gaublomme JT, et al. Dynamic regulatory network controlling TH17 cell differentiation[J]. Nature, 2013, 496(7446): 461-468. DOI:10.1038/nature11981 |
| [4] |
Josefowicz SZ, Lu LF, Rudensky AY. Regulatory T cells:mechanisms of differentiation and function[J]. Annual review of immunology, 2012, 30: 531-564. DOI:10.1146/annurev.immunol.25.022106.141623 |
| [5] |
李曰庆. 中医外科学[M]. 北京: 中国中医药出版社, 2003: 212-214.
|
| [6] |
中华人民共和国卫生部.中药新药临床研究指导原则[S].北京: 中国医药出版社, 1997: 94
|
| [7] |
Han YM, Sheng YY, Xu F, et al. Imbalance of T-helper 17 and regulatory T cells in patients with alopecia areata[J]. The Journal of dermatology, 2015, 42(10): 981-988. DOI:10.1111/jde.2015.42.issue-10 |
| [8] |
Tanemura A, Oiso N, Nakano M, et al. Alopecia areata:infiltration of Th17 cells in the dermis, particularly around hair follicles[J]. Dermatology, 2013, 226(4): 333-336. |
| [9] |
Castela E, Le Duff F, Butori C, et al. Effects of low-dose recombinant interleukin 2 to promote T-regulatory cells in alopecia areata[J]. JAMA dermatology, 2014, 150(7): 748-751. DOI:10.1001/jamadermatol.2014.504 |
 2019, Vol. 36
2019, Vol. 36