文章信息
- 马铭华, 王一洲, 赵强
- MA Minghua, WANG Yizhou, ZHAO Qiang
- 伸筋易骨法调控软骨细胞内钙离子浓度干预细胞代谢的机制研究
- Mechanisms study of Shenjin Yigu method regulated calcium ion concentration in chondrocyte to intervene cell metabolism
- 天津中医药, 2019, 36(6): 591-594
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(6): 591-594
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.06.18
-
文章历史
- 收稿日期: 2019-02-21
膝骨性关节炎(KOA)是临床最常见的退行性骨关节疾病,初期以关节滑膜病变为主,随着滑膜内环境失稳和关节应力重构的不断发生,细胞外基质被破坏,进而影响软骨细胞的生长环境[1]。软骨组织是由软骨细胞和细胞外基质组成的一种致密结缔组织,软骨基质内包含有大量的Ⅱ型胶原纤维和蛋白多糖,这两种生物分子使软骨组织具备足够的粘弹性,同时也形成了软骨细胞特殊的代谢环境[2]。体内环境下,软骨细胞的增殖分化非常缓慢,软骨细胞通过细胞膜表面的离子通道和框架蛋白响应关节内微应力环境调控细胞分泌基质的功能[3],而钙离子(Ca2+)作为第二信使是连接细胞内外的重要信息素。前期研究发现[4],软骨细胞内L型、P/Q型电压依赖性钙通道蛋白亚单位Cav1.2、Cav1.3、Cav1.4、Cav2.1的表达受应力环境调控。本研究通过激光共聚焦显微镜和膜片钳技术继续深入挖掘推拿手法调控L型电压依赖性钙通道影响软骨细胞内Ca2+浓度,促进细胞合成代谢的机制,为此类物理治疗发挥作用的可能机制提供依据。
1 材料和方法 1.1 试剂DMEM(Hyclone公司,美国);TRYPSIN 0.25% EDTA、双抗(Gibco公司,美国);FBS(ExCell公司,中国)Ⅱ型胶原酶、5-溴脱氧尿嘧啶核苷、Trypsin(Sigma公司,美国);CsCl(Amresco公司,美国);L-Aspartic acid potassium salt、EGTA(Fluka Biochemika公司,美国);Ca2+探针(索莱宝公司,中国)。
1.2 仪器设备BZY-DG007型鼠兔跑台(东莞博之远生物科技发展有限公司,中国);BY-80C型医用离心机(北京白洋医疗器械公司,中国);PC-100型微电极拉制器(Narishige公司,日本);低温离心机(Eppendorf公司,德国)MC1000e三维手动微操纵器(SD公司,美国)Digidata 1322A型AID-DIA转换器(Axon公司,美国);pCLAMP 9.0软件(Sigma公司,美国)。
1.3 分组及处理(6.23±0.51)月龄雌性日本大耳白兔50只[SYXK(京)2014-0003],平均体质量(3.17±0.31) kg,运用改良的Hulth造模法[5]模拟应力失常诱导的KOA,编号并随机均分为5组,造模成功后,治疗组以伸筋易骨法治疗,对照组以关节腔注射玻璃酸钠注射液治疗,假手术组在胫骨内侧髁内上打开2 cm左右创口,钝性分离直至暴露关节腔后,不做处理,闭合关节腔,并逐层缝合,假手术组、模型组造模成功后与空白组及其他各组同条件饲养,治疗结束后取材,机械-酶法分离软骨细胞[6]。
1.4 治疗方法治疗方法如下[7]:1)应用自制固定器将兔仰卧位固定,指揉法作用于足阳明胃经、足少阳胆经、足太阳膀胱经各约5 min。2)以点按法作用于血海、梁丘、犊鼻、足三里、阳陵泉、委中、承山穴,每穴1 min。3)以指推法从髂前上棘自上而下推至髌骨上缘,操作9遍。4)屈髋屈膝90°,以摇法顺时针操作9遍;将髋关节外展至极限,行膝关节拔伸法,直至膝关节伸直,操作9遍。4)沿膝关节内外侧从前至后行擦法1 min,结束手法。上述手法1次/日,共治疗21 d。对照组治疗方法如下:1)应用自制固定器将兔仰卧位固定,术区常规消毒备皮。2)髌旁入路,造模侧膝关节注入玻璃酸钠注射液1 mL。3)屈伸膝关节数次以使药液充分覆盖关节,纱布蒙盖注射区。上述治疗每周1次,共治疗3周。
1.5 激光共聚焦显微镜检测细胞Ca2+浓度将分离的原代软骨细胞放入培养孔,预置细胞爬片,待第2天镜下观察细胞部分贴壁后进行以下操作:1)向Fluo-4,AM/DMSO溶液中加入16.5 mg Pluronic F127(Pluronic F127可以防止Fluo-4,AM在HBSS中聚合并能帮助其进入细胞)。2)用HBSS稀释Fluo-4,AM溶液,制备4 μmol/L的Fluo-4,AM工作液。3)吸出培养基至剩余约50 μL,加入约1 mL PBS,清洗细胞孔。剩余约50 μL磷酸盐缓冲液(PBS),再次加入1 mL PBS清洗。4)尽量移去上清,迅速将Fluo-4,AM工作液加入培养孔(约100 μL),在37 ℃培养30 min。5)加入5倍体积的含有1%胎牛血清的HBSS中和,再继续培养40 min。6)用HBSS洗涤3次。7)37 ℃下培养10 min,制作临时装片,然后用显微镜进行荧光Ca2+检测。激发波长494 nm,发射波长516 nm。
1.6 软骨细胞电生理检测将分离好的原代软骨细胞悬浮于配置好的培养液中,培养液底部放置5片载玻片,培养箱中静置预爬片,取出载玻片,镜下选取贴壁良好、形态正常的软骨细胞进行检测。通过pClampex9.2软件进行软骨细胞离子通道电流的采集。将拉置好的微电极灌入预调PH为7.2的电极液(CsCl 125 mmol/L、TEA-Cl 10 mmol/L、MgCl2 1 mmol/L、EGTA 10 mmol/L、Mg-ATP 5 mmol/L、HEPES 5 mmol/L)并连接在显微镜的探头上,此时电阻在2-4 MΩ之间。将负载目标细胞的载玻片置于事先配置好的细胞外液中(N-methyl-D-glucamine 140 mmol/L、MgCl2 1 mmol/L、CaCl2 1.8 mmol/L、HEPES 10 mmol/L、glucose 10 mmol/L),下降电极进入液面并在与细胞接触前补偿尖端电位。形成高阻封接(>1 GΩ)后,负压抽吸破膜,形成全细胞构型,在电压钳模式下进行刺激和记录。钙电流(ICa)的记录:钳制电位从-40 mV以10 mV为阶跃至70 mV,测定200 ms的电流稳态值;实验过程由计算机软件pClamp9.2(Axon Instrument)控制数-模转换器完成采集和分析。
1.7 统计学方法所有数据输入SPSS 19.0软件进行分析,计数资料用均数+标准差(x±s)表示,组间比较采用单因素方差,组间两两比较采用LSD法,P < 0.05为差异有统计学意义。
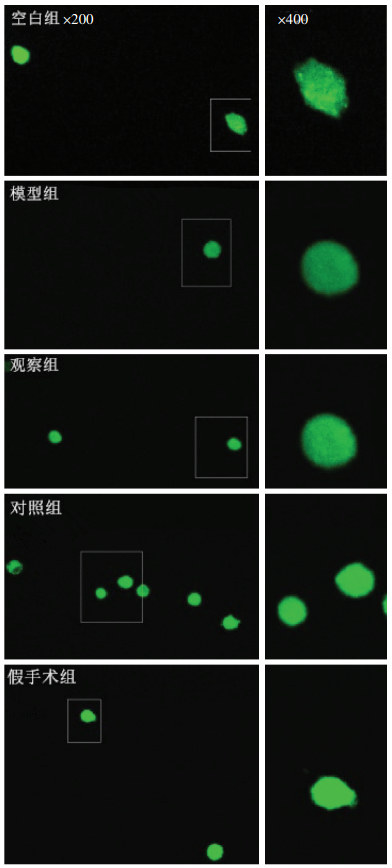
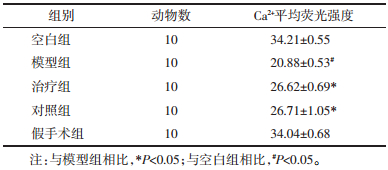
2 结果各组软骨细胞内Ca2+平均荧光强度比较见图 1、表 1。由图 1可见,激光共聚焦荧光Ca2+检测中细胞内Ca2+呈绿色荧光染色,模型组与空白组、假手术组相比荧光强度较暗,治疗组和对照组荧光强度较模型组略强,但较空白组和假手术组稍暗。表 1可知,模型组与空白组的Ca2+平均荧光强度值,有显著性差异(P<0.05),对照组与模型组的Ca2+平均荧光强度值比较有显著性差异(P<0.05),治疗组与模型组的Ca2+平均荧光强度值比较具有显著性差异(P<0.05),对照组与治疗组的Ca2+平均荧光强度值比较无统计学意义(P>0.05)。提示膝关节应力失常会影响原代软骨细胞Ca2+的跨膜转运,减少细胞内的Ca2+浓度,伸筋易骨法和玻璃酸钠关节腔注射可促进Ca2+内流,增加软骨细胞内的Ca2+浓度。
|
| 图 1 各组软骨细胞染色强度(激光共聚焦显微镜,免疫荧光染色,×200、×400) Fig. 1 Staining intensity of chondrocytes in each group (laser confocal microscopy, immunofluorescence staining, × 200, ×400) |
|
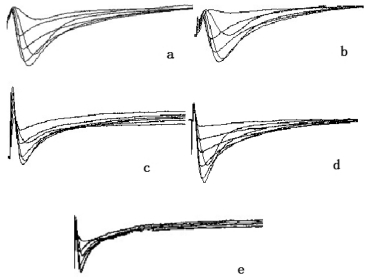
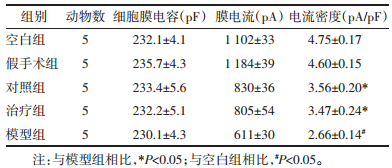
各组软骨细胞L型钙通道电流密度见图 2、表 2。各组软骨细胞L型钙通道电流由膜片钳检测形成不同电流密度的轨迹图,由图 2可见,模型组与空白组、假手术组相比电流密度较低,治疗组和对照组电流密度较模型组高,但较空白组和假手术组低。由表 2可知,模型组与空白组软骨细胞L型钙通道电流密度有显著性差异(P<0.05),对照组与模型组软骨细胞L型钙通道电流密度有显著性差异(P<0.05),治疗组与模型组软骨细胞L型钙通道电流密度有显著性差异(P<0.05),对照组与治疗组软骨细胞L型钙通道电流密度无统计学意义(P>0.05)。提示膝关节应力失常会抑制软骨细胞L型钙通道的活性,降低Ca2+内流,进而影响软骨细胞的合成代谢,伸筋易骨法和玻璃酸钠关节腔注射能够通过活化L型钙通道,提高软骨细胞膜对Ca2+通透性,增加软骨细胞内Ca2+浓度,启动Ca2+依赖的合成代谢相关蛋白,改善关节软骨细胞的分泌功能,调节软骨和细胞外基质的应力重构。
|
| a.模型组;b.假手术组;c.治疗组;d.对照组;e.模型组 图 2 兔软骨细胞L型钙通道电流轨迹图(-40-50 mV) Fig. 2 Current trajectory of L-type calcium channel in rabbit chondrocytes(-40-50 mV) |
|
关节应力失常会抑制软骨细胞L型钙通道的活性,降低Ca2+内流,造成细胞内钙耗竭,影响软骨细胞分泌和合成代谢[8]。伸筋易骨法和玻璃酸钠关节腔注射均能够活化L型钙通道,提高软骨细胞膜对Ca2+通透性,增加软骨细胞内Ca2+浓度。结合前期研究基础,推测伸筋易骨法通过调节关节周围软组织性能,降低细胞表面应力集中,软骨外基质的结构形态改变将力学信号传导至细胞表面,并影响软骨细胞周围阳离子浓度,提高软骨细胞膜的静息膜电位[9],活化软骨细胞表面L型钙通道。伸筋易骨法调节下肢整体应力,改善关节微应力环境,从远期疗效考虑其效果优于玻璃酸钠关节腔注射。
4 讨论KOA的病因目前尚未明确,但关节软骨的结构和性能改变是KOA发生、发展和关节应力重构中最重要的一环。有研究表明[10],应力的强度、频率、载荷方式均会影响软骨细胞的生理功能,提升关节周围肌肉、韧带、滑膜等软组织的力学性能,成为保护软骨组织的重要途径。
伸筋易骨法是赵强主任以筋骨并重为手法核心创制的一套KOA手法操作方案,伸筋易骨法重点选用足阳明胃经、足太阴脾经及两经穴点进行手法刺激,达到健脾益胃、化食为能的作用,脾气充盛,则能筋伸骨正。手法操作通过揉、㨰等手法作用于股直肌、股二头肌等浅部肌群,通过点、按法作用于腱-骨结合部以刺激深部肌群,同时弹拨肌腹增加筋膜间血液的流速,运用摇法、拔伸法等运动关节类手法刺激滑膜、韧带。整套手法以膝关节周围软组织作为作用靶点,以恢复关节应力环境为目的,发挥调筋治骨的作用。
近年来,笔者通过动物实验逐步挖掘该手法的作用特点和内涵,综合前期研究笔者认为,伸筋易骨法通过调节膝关节周围软组织性能,改善关节微应力环境,调控软骨细胞表面离子通道,增加细胞内Ca2+浓度,激活下游合成代谢相关蛋白,缓解KOA患者软骨组织的损伤。未来笔者将更进一步对推拿手法等物理治疗的力学-生物信号转导机制进行挖掘,为退行性骨关节病的防治研究作出贡献。
| [1] |
Yao N, Chen N, Xu XM, et al. Protective effect of Shenmai injection on knee articular cartilage of osteoarthritic rabbits and IL-1β-stimulated human chondrocytes[J]. Exp Ther Med, 2017, 13(6): 3013-3020. DOI:10.3892/etm.2017.4349 |
| [2] |
Nasi S, Ea HK, So A, et al. Revisiting the role of interleukin-1 pathway in osteoarthritis:interleukin-1α and -1β, and NLRP3 inflammasome are not involved in the pathological features of the murine menisectomy model of osteoarthritis[J]. Front Pharmacol, 2017, 8: 282. DOI:10.3389/fphar.2017.00282 |
| [3] |
Whasil L, Holly A. Leddy, et al. Synergy between Piezo1 and Piezo2 channels confers high-strain mechanosensitivity to articular cartilage[J]. Proc Natl Acad Sci USA, 2014, 111(47): E5114-E5122. DOI:10.1073/pnas.1414298111 |
| [4] |
王一洲, 赵强. 屈膝点按叩揉法调控L型电压依赖性钙通道影响软骨细胞代谢的机制研究[J]. 天津中医药, 2017, 34(4): 262-265. |
| [5] |
Hulth A, Lindberg L, Telhag H. Experimental osteoar thritis in rabbits[J]. Acta Orthop Scand, 1970, 41(5): 522-530. DOI:10.3109/17453677008991540 |
| [6] |
赵强, 王一洲. 兔膝关节骨性关节炎模型的建立及软骨细胞的分离、培养[J]. 天津中医药, 2013, 30(3): 168-170. |
| [7] |
赵强, 王一洲. 伸筋易骨法治疗膝关节骨性关节炎临床观察[J]. 天津中医药, 2014, 31(5): 275-277. |
| [8] |
Pedersen SF, Owsianik G, Nilius B. TRP channels:an overview[J]. Cell Calcium, 2005, 38(5): 233-252. |
| [9] |
Rebecca L, Katie EA, Gareth B. The Role of the Membrane Potential in Chondrocyte Volume Regulation[J]. J Cell Physiol, 2011, 226(11): 2979-2986. DOI:10.1002/jcp.22646 |
| [10] |
Responte DJ, Lee JK, Hu JC, et al. Biomechanics-driven chondrogenesis:from embryo to adult[J]. The FASEB Journal, 2012, 26(9): 3614-3624. DOI:10.1096/fj.12-207241 |
 2019, Vol. 36
2019, Vol. 36