文章信息
- 张书春, 代紫阳, 王亚, 夏娟, 杜梦凡, 姚纹
- ZHANG Shuchun, DAI Ziyang, WANG Ya, XIA Juan, DU Mengfan, YAO Wen
- 黄芪甲苷抑制IKK/NF-κB炎症通路减轻高糖诱导的H9c2心肌细胞损伤
- Astragaloside Ⅳ attenuates high glucose-induced H9c2 cardiomyocyte injury by inhibiting IKK/NF-κB inflammatory pathway
- 天津中医药, 2019, 36(6): 599-602
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(6): 599-602
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.06.20
-
文章历史
- 收稿日期: 2019-01-02
2. 华北理工大学中医学院, 唐山 063210
糖尿病是一种多病因引起的以高血糖为特征的内分泌代谢性疾病。高血糖还可通过诱导、加重炎症反应、氧化应激等机制在糖尿病诸多并发症的发生、发展过程中占重要地位。糖尿病性心肌病是一种常见的糖尿病心血管并发症,是独立于高血压性心脏病、冠状动脉粥样硬化性心脏病的心肌损害性疾病。研究显示炎症反应在糖尿病心肌损害的发生、发展过程中起重要的作用[1]。其中,在糖尿病心肌损伤相关动物、细胞模型中存在大量炎症细胞因子如白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)的分泌及炎症相关信号分子如核转录因子-κB(NF-κB)等的过度激活,持续存在的炎症反应最终导致心肌损害的发生[2-4]。黄芪甲苷是中药黄芪所含有的重要有效化学成分之一,具有明确的降糖、调脂作用[5],且通过抗氧化应激、抗炎、抗细胞凋亡等机制对心血管系统具有广泛的保护作用[6]。本研究旨在观察黄芪甲苷对高糖诱导H9c2心肌细胞损伤的保护作用,并从IκB激酶(IKK)/NF-κB炎症相关通路探讨其作用机制。
1 材料与仪器 1.1 细胞株大鼠胚胎心脏组织来源的H9c2细胞株,购自中科院上海细胞库。
1.2 实验用药黄芪甲苷购自辽宁生物医药科技有限公司。
1.3 试剂DMEM高糖、低糖培养基(GIBCO公司),胰蛋白酶(SIGMA公司),胎牛血清(GIBCO公司),噻唑蓝(MTT)细胞增殖及细胞毒性检测试剂盒(碧云天生物技术研究所),TNF-α、IL-6(南京建成生物工程研究所),兔抗大鼠IKK-β、NF-κB、p-NF-κB(Ser536)、TNF-α(Cell Signaling公司),辣根过氧化物酶标记山羊抗兔免疫球蛋白G(IgG)、辣根过氧化物酶标记山羊抗小鼠IgG、BCA蛋白浓度测定试剂盒(碧云天生物技术研究所)。
1.4 仪器37 ℃二氧化碳孵箱,上海易亮医疗器械有限公司;超净工作台,江苏苏州净化设备公司;冷冻离心机,德国SIGMR Laborzentrifugen;酶标仪,奥地利TECAN公司;JY200C电泳仪,北京君意东方电泳设备有限公司;半干转运系统,BIO-RAD公司。
2 方法 2.1 细胞培养37 ℃、5%CO2条件下孵育H9c2细胞,给予10%FBSDMEM(低糖,5.5 mmol/L)培养基培养,待细胞生长融合约覆盖皿底面积80%时进行传代。无血清低糖DMEM培养基培养细胞24 h,使各组细胞生长同步化后再进行下一步实验。
2.2 MTT法检测细胞活性细胞贴壁生长48 h,吸弃每孔原培养基,加入新培养基100 μL,再加入MTT溶液10 μL,置细胞于培养箱内继续孵育4 h。每孔加入DMSO 150 μL,于细胞培养箱继续孵育细胞15 min,使用酶标仪测定吸光度OD值(波长570 nm)。
2.3 高糖诱导心肌细胞损伤模型的建立根据文献研究[7]及预实验的实验结果,以高糖(33.3 mmol/L)培养基处理H9c2心肌细胞24 h建立心肌细胞损伤模型。
2.4 黄芪甲苷对细胞活力的影响选择对数生长期H9c2心肌细胞,胰酶消化后重悬细胞,进行细胞计数,以2 000个细胞/孔的密度接种于96孔细胞培养板。黄芪甲苷(20、40、80 μmol/L)预处理6 h,再加入高糖培养基24 h,MTT法检测细胞活性。
2.5 分组及处理正常对照组:给予10%FBS低糖DMEM培养基培养;高糖对照组:给予10% FBS高糖DMEM培养基培养;高糖+黄芪甲苷低剂量组:黄芪甲苷(20 μmol/L)预处理6 h,再给予10% FBS高糖DMEM培养基培养;高糖+黄芪甲苷中剂量组:黄芪甲苷(40 μmol/L)预处理6 h,再给予10% FBS高糖DMEM培养基培养;高糖+黄芪甲苷高剂量组:黄芪甲苷(80 μmol/L)预处理6 h,再给予10% FBS高糖DMEM培养基培养。
2.6 酶联免疫吸附(ELISA)法检测TNF-α和IL-6的含量待细胞生长融合约覆盖皿底面积80%时,按照分组给予不同处理后,收集培养基作待测标本,按照ELISA试剂盒说明书进行操作,测定出细胞培养液中TNF-α和IL-6的含量水平。实验重复5次。
2.7 Western Blot检测IKK、NF-κB、p-NF-κB(Ser536)、TNF-α水平吸弃各组细胞培养液上清,加入IP细胞裂解液冰上裂解30 min,刮取细胞,离心15 min(4 ℃,12 000 r/min)。BCA法测定细胞蛋白浓度。制备分离胶(10%)和浓缩胶(5%)。上样总蛋白100 μg,加入电泳缓冲液,设定电泳电压及时间(浓缩胶:80 V,40 min;分离胶:150 V,1 h)。再将蛋白转移至PVDF膜上(52 mA,2 h)。5%脱脂奶粉封闭1 h,加入相应一抗(IKK、NF-κB、p-NF-κB(Ser536)、TNF-α、GAPDH),4 ℃过夜。洗膜后孵育HRP标记的山羊抗兔或山羊抗小鼠第二抗体,室温2 h。再次洗膜后,ECL显色,暗室内曝光。结果用Image J软件分析,计算蛋白条带灰度值,目的蛋白表达水平用目的蛋白与内参蛋白的灰度比值来表示。
2.8 数据处理应用SPSS 23.0统计软件对数据进行分析,实验所得数据采用均数±标准差(x±s)表示,各组间比较采用单因素方差分析,组间两两比较方差齐者选用LSD法,方差不齐者选用Dunnett’s T3法。以P<0.05为差异有统计学意义。
3 结果 3.1 不同浓度黄芪甲苷对各组细胞存活率的影响与正常对照组相比,高糖对照组的细胞存活率明显下降(P<0.05);与高糖对照组相比,高糖+黄芪甲苷(20、40、80 μmol/L)各组的细胞存活率有所提高,且黄芪甲苷对细胞存活率的提高效果呈剂量依赖性。在黄芪甲苷药物治疗组中,高糖+黄芪甲苷高剂量组(80 μmol/L)组的细胞存活率最高(P<0.05)。见表 1。
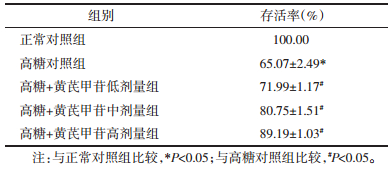
|
与正常对照组相比,高糖对照组细胞培养液上清中TNF-α和IL-6的含量均明显增加(P<0.05);与高糖对照组相比,高糖+黄芪甲苷(20、40、80 μmol/L)各组的TNF-α和IL-6在细胞培养液上清中的含量均有所降低(P<0.05),且降低效果呈黄芪甲苷剂量依赖性,以高糖+黄芪甲苷高剂量组(80 μmol/L)下降最为显著(P<0.05)。见表 2。
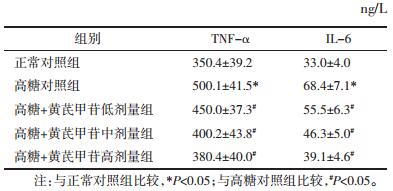
|
与正常对照组比较,高糖对照组H9c2细胞IKK-β蛋白表达增加显著(P<0.05),NF-κB蛋白表达无明显变化(P>0.05),但NF-κB磷酸化水平显著增加(P<0.05),TNF-α蛋白表达明显升高(P<0.05)。黄芪甲苷各处理组H9c2细胞IKK-β蛋白表达下降(P<0.05),NF-κB磷酸化水平减弱(P<0.05),TNF-α蛋白表达明显降低(P<0.05),且各指标变化呈现黄芪甲苷剂量依赖性,以黄芪甲苷高剂量组改变最为明显(P<0.05)。见表 3、图 1。
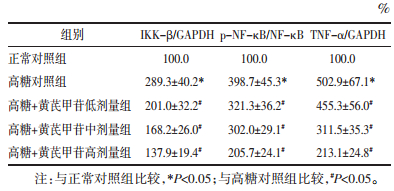
|
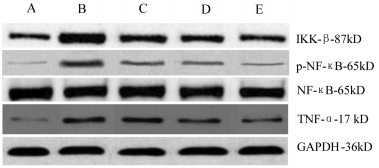
|
| A:正常对照组,B:高糖对照组,C:高糖+黄芪甲苷低剂量组,D:高糖+黄芪甲苷中剂量组,E高糖+黄芪甲苷高剂量组 图 1 黄芪甲苷对H9c2细胞IKK-β,NF-κB,p-NF-κB,TNF-α蛋白表达的影响 Fig. 1 Effect of astragaloside IV on protein expressions of IKK-β, NF-κB, p-NF-κB and TNF-α in H9c2 cells |
糖尿病性心肌病是一种发生于糖尿病患者的特异性心肌病变,可造成糖尿病患者心力衰竭,具有较高的死亡率。糖尿病以慢性高血糖为特征,高糖刺激与炎症状态密切相关[8],而炎症是糖尿病心肌损害的发生机制之一,亦有诸多研究表明抗炎可以有效减轻糖尿病心肌损害[9-10]。其中,TNF-α可引发炎症和细胞损伤,最终导致心肌纤维化[11]。在糖尿病心肌病大鼠模型中,抑制TNF-α可以减少心肌纤维化,改善心脏功能[12]。本实验高糖孵育H9c2心肌细胞24 h建立细胞损伤模型,细胞活力明显下降,细胞培养液上清中的炎症因子如TNF-α、IL-6水平明显升高,细胞内TNF-α的蛋白表达亦增高,提示高糖诱导的心肌细胞损伤与炎症反应密切相关。
NF-κB是广泛存在于机体内的核转录因子,是介导炎症因子释放的关键性转录因子[13]。当细胞处于静息状态时,NF-κB与抑制性蛋白IκB以复合体的形式存在,处于未激活、无活性状态;当细胞受到多种因素刺激后,IκB激酶复合体(IKK)中的催化亚基IKK-β将IκB磷酸化并使之降解,从而NF-κB被磷酸化激活。磷酸活化的NF-κB转移至细胞核内,与特定靶基因结合并调控靶基因转录,释放IL-6、TNF-α等相关炎症因子[14]。而TNF-α、IL-6等炎症因子的释放可反馈性作用于NF-κB,使之处于持续激活状态,进而持续的炎症状态造成心肌损伤[15]。本实验高糖诱导的心肌细胞损伤模型中IKK-β蛋白表达增加,NF-κB磷酸活化水平加强,提示IKK/NF-κB炎症相关通路过度激活。
黄芪甲苷是黄芪的主要活性成分之一,其降糖、治疗糖尿病并发症的药理作用明确[16-17]。黄芪甲苷可增强心肌收缩力,改善心肌能量代谢,抑制心室肥厚、心肌纤维化及心肌细胞凋亡,保护血管内皮细胞,降血压,对心血管系统具有广泛的保护作用[18-20]。然而糖尿病心肌损害的发病机制十分复杂[21],黄芪甲苷究竟是通过哪些路径来保护心肌细胞避免其受高血糖损害还需进一步探索。本实验结果显示,给予H9c2心肌细胞黄芪甲苷预处理6 h可以明显增强高糖孵育条件下的心肌细胞活力,降低细胞培养液上清TNF-α、IL-6水平,减弱细胞内TNF-α的蛋白表达,并明显抑制过度激活的IKK/NF-κB炎症相关通路。
综上所述,高糖刺激诱导IKK/NF-κB炎症通路的级联反应过度激活参与糖尿病心肌损伤的发生、发展过程。黄芪甲苷呈剂量依赖性对糖尿病心肌损害具有明显的防治作用,各项异常指标的改善情况以黄芪甲苷高剂量组(80 μmol/L)最为显著,其可能机制是与降低IKKβ的蛋白表达,下调NF-κB的磷酸活化水平,从而抑制了IKK/NF-κB炎症通路的过度激活,继而降低了TNF-α、IL-6相关炎症因子水平有关。
| [1] |
Pan Y, Wang Y, Zhao Y, et al. Inhibition of JNK phosphorylation by a novel curcumin analog prevents high glucose-induced inflammation and apoptosis in cardiomyocytes and the development of diabetic cardiomyopathy[J]. Diabetes, 2014, 63(10): 3497. DOI:10.2337/db13-1577 |
| [2] |
张一弛.糖尿病大鼠心肌损伤的炎性机制及葛根素的干预作用研究[D].济南: 济南大学, 2012.
|
| [3] |
储全根, 王玲, 张凯, 等. 抵当汤调控NF-κB通路干预DM大鼠心肌炎症反应的机制[J]. 中国实验方剂学杂志, 2018, 24(1): 109-113. |
| [4] |
Xu W, Chen J, Lin J, et al. Exogenous H2S protects H9c2 cardiac cells against high glucose-induced injury and inflammation by inhibiting the activation of the NF-κB and IL-1β pathways[J]. International Journal of Molecular Medicine, 2015, 35(1): 177-186. DOI:10.3892/ijmm.2014.2007 |
| [5] |
韩冬. 黄芪甲苷对实验性糖尿病大鼠降糖、调脂和抗氧化作用的研究[J]. 现代中西医结合杂志, 2016, 25(4): 360-364. DOI:10.3969/j.issn.1008-8849.2016.04.006 |
| [6] |
李香华. 黄芪甲苷在心血管疾病中的作用[J]. 心血管病学进展, 2011, 32(1): 132-136. DOI:10.3969/j.issn.1004-3934.2011.01.038 |
| [7] |
胡丽贞, 李雅杰, 薛宏凤, 等. 莱菔硫烷对高糖诱导心肌细胞线粒体损伤的保护作用[J]. 哈尔滨医科大学学报, 2013, 47(3): 197-200. DOI:10.3969/j.issn.1000-1905.2013.03.001 |
| [8] |
韦之富, 雷自立, 郭姣. 高血糖症的炎症机制研究进展[J]. 今日药学, 2017(5): 358-360. |
| [9] |
董世芬, 张胜威, 洪缨, 等. 二甲双胍和罗格列酮对实验性糖尿病心肌病模型大鼠心脏保护作用研究[J]. 世界科学技术-中医药现代化, 2013(8): 1688-1694. |
| [10] |
廖荣华.罗格列酮对高糖微环境下H9c2心肌细胞的影响[D].贵阳: 贵州医科大学, 2018.
|
| [11] |
Duerrschmid C, Crawford JR, Reineke E, et al. TNF receptor 1 signaling is critically involved in mediating angiotensin-Ⅱ-induced cardiac fibrosis[J]. Journal of Molecular & Cellular Cardiology, 2013, 57(4): 59-67. |
| [12] |
Rajesh M, Mukhopadhyay P, Bátkai S, et al. Cannabidiol attenuates cardiac dysfunction, oxidative stress, fibrosis, and inflammatory and cell death signaling pathways in diabetic cardiomyopathy[J]. Journal of the American College of Cardiology, 2010, 56(25): 2115-2125. DOI:10.1016/j.jacc.2010.07.033 |
| [13] |
王晓晨, 吉爱国. NF-κB信号通路与炎症反应[J]. 生理科学进展, 2014, 45(1): 68-71. |
| [14] |
Bujak M, Frangogiannis NG. The role of Interleukin-1 in the pathogenesis of heart disease[J]. ArchivumImmunologiae Et Therapiae Experimentalis, 2009, 57(3): 165-176. DOI:10.1007/s00005-009-0024-y |
| [15] |
Frangogiannis NG. Regulation of the Inflammatory response in cardiac repair[J]. Circulation Research, 2012, 110(1): 159-73. DOI:10.1161/CIRCRESAHA.111.243162 |
| [16] |
尤良震, 林逸轩, 方朝晖, 等. 黄芪甲苷治疗糖尿病及其并发症药理作用研究进展[J]. 中国中药杂志, 2017, 42(24): 4700-4706. |
| [17] |
曹琼丹, 杨育红, 唐富天, 等. 黄芪甲苷对高糖诱导的乳鼠心肌细胞氧化应激的影响[J]. 中药药理与临床, 2015(5): 27-30. |
| [18] |
陈靖宇, 陈铁龙. 黄芪甲苷对心肌细胞保护作用的研究进展[J]. 中西医结合心脑血管病杂志, 2016, 14(9): 980-983. DOI:10.3969/j.issn.1672-1349.2016.09.018 |
| [19] |
李昌盛, 戴河柳, 杨贤义, 等. 黄芪甲苷对心力衰竭模型大鼠心肌细胞凋亡及P-Cx43表达影响的实验研究[J]. 临床和实验医学杂志, 2018(12). |
| [20] |
Li XH, Wang HX. Effect of astragalosideⅣ in cardiovascular disease[J]. Advances in Cardiovascular Diseases, 2011, 32(1): 132-136. |
| [21] |
赵凌云, 田绍前, 刘晓红, 等. 糖尿病心肌病的发病机制[J]. 中国糖尿病杂志, 2013, 21(6): 571-573. DOI:10.3969/j.issn.1006-6187.2013.06.029 |
2. North China University of Science and Technology, Tangshan 063210, China
 2019, Vol. 36
2019, Vol. 36
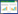


 ,
,