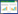文章信息
- 赵丽雅, 胡宏英, 任利彬
- ZHAO Liya, HU Hongying, REN Libin
- 灯盏花素对庆大霉素所致急性肾损伤的保护作用及机制研究
- Protective effect and mechanism study of Breviscapine on acute kidney injury induced by gentamicin
- 天津中医药, 2019, 36(6): 603-607
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(6): 603-607
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.06.21
-
文章历史
- 收稿日期: 2019-01-28
急性肾损伤(AKI)是指肾功能短期内急剧下降而导致电解质紊乱、酸碱失衡的一种临床危急重症,具有多种诱发因素,临床上各种肾毒性药物及造影检查、放化疗等均是AKI的诱因[1],其中庆大霉素连续治疗7 d以上的患者并发AKI的发病率达20%左右[2-3],极大地增加了治疗风险,因此研究能够有效抑制或缓解庆大霉素所致肾损伤的药物具有重要的临床意义。肾炎康复片具有健脾补肾、益气养阴、利水消肿等功效,是临床上治疗肾脏相关疾病的常用中成药制剂,也用于肾功能损伤新型药物研究的阳性对照药物[3]。灯盏花素(Bre)是中国传统中药灯盏花的主要活性成分,既往研究发现灯盏花素对造影剂所致急性肾损伤[4]、顺铂所致急性肾损伤[5]均具有一定的保护作用,但灯盏花素是否对庆大霉素致AKI影响的文献报道尚不多见,本实验将对这一问题进行研究分析。
1 材料与方法 1.1 实验动物健康清洁级雄性Wistar大鼠(8周龄,230~250 g)购自河北省实验动物中心(SCXK(冀)2013-1-003)。适应性饲养1周后进行实验,饲养环境:恒温25 ℃、相对湿度60%,光照12 h:12 h。
1.2 试验药物与试剂灯盏花素片(广州彼迪药业有限公司,规格:20mg/片,批号:20170924);肾炎康复片(天津同仁堂集团股份有限公司,规格:0.48 g/片,批号:170410);硫酸庆大霉素注射液(河南润弘制药股份有限公司,规格:2 mL:80 mg(8万单位),批号:20180203)。24 h尿蛋白量(Pro)、N-乙酰-β-氨基葡萄糖苷酶(NAG酶)、尿素氮(BUN)、血肌酐(Scr)、肿瘤坏死因子-α(TNF-α)、巨噬细胞炎症蛋白-2(MIP-2)、单核细胞趋化蛋白-1(MCP-1)检测试剂盒购自深圳迈瑞生物医疗电子股份有限公司(批号:20171126、20171209、20170930、20171025、20170826、20171118、20171031);超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)测定试剂盒(北京博奥森生物技术有限公司,批号:171022、180106、171219);肾损伤分子-1(KIM-1)抗体购自碧云天生物技术有限公司(批号:201711016)。
1.3 实验仪器卓越310型全自动生化分析仪(武汉精诚伟业医疗设备有限公司);FA25型匀浆机(上海洽姆仪器科技有限公司);iMark型酶标仪(美国Bio-Rad公司);UV-1200紫外-可见光分光光度计(上海美谱达仪器有限公司);CUT4062型石蜡切片机(德国SLEE公司);BI-2000医用图像分析系统。
1.4 分组、造模与给药取120只实验用清洁级Wistar大鼠按随机数字表法,随机分为正常对照组、模型对照组、肾炎康复片[800 mg/(kg·d),阳性药对照组]、灯盏花素低[6 mg/(kg·d)]、中[12 mg/(kg·d)]、高[24 mg/(kg·d)]剂量组,每组均20只。造模方法[3, 6]:造模前12 h禁食、自由饮水,除正常对照组,其余各组大鼠连续7 d腹腔注射给予庆大霉素(140 mg/kg·d)。药物配制:精确称量灯盏花素并加入适量生理盐水(0.9%氯化钠溶液),配制浓度为12 mg/mL的灯盏花素溶液,并依次稀释配制浓度为6、3 mg/mL的灯盏花素溶液;取适量肾炎康复片、研碎后加入适量生理盐水以配制浓度为400 mg/mL的肾炎康复片溶液。各组均于造模第1天开始给药,灯盏花素各剂量组和肾炎康复片组分别取适当浓度药液、以2 mL/(kg·d)剂量灌胃给药,正常对照组和模型对照组分别以2 mL/(kg·d)剂量给予生理盐水;疗程均为14 d。
1.5 标本采集治疗完成后,收集各大鼠24 h尿液,-20 ℃冻存待检;麻醉后经腹主动脉取血(不抗凝),4 ℃低温静置1 h后离心(转速:1 500 r/min,时间:10 min)取血清,-20 ℃冻存待检;取两侧肾脏组织,生理盐水冲洗表面血液并用滤纸擦拭干净后,-80 ℃冻存待检。
1.6 指标检测测定24 h排尿量、生化分析法测定Pro、比色法测定尿NAG酶活性;苦味酸比色法测定血Scr含量,二乙酰肟法测定BUN含量;称量体质量和两侧肾脏质量,计算肾脏指数,肾脏指数=两侧肾脏质量/体质量。取左侧肾脏,于4%多聚甲醛-生理盐水溶液固定72 h后依次进行石蜡包埋、切片处理,通过免疫组织化学(IHC)染色检测肾脏组织KIM-1蛋白表达,采用Image Pro plus图像分析系统测定切片平均光密度值(OD值);通过HE染色进行病理学检查并行损伤评分[7]:1)肾小球病变评分:结构正常为0分,少数变大或缩小为1分,部分变大或缩小为2分,大多数变大或缩小为3分(出现玻璃样变也为3分)。2)肾小管病变评分:结构正常为0分,根据近曲小管细胞出现空泡变性数量,少量为1分、中量为2分、大量为3分。3)肾间质病变评分:结构正常为0分,根据肾小管萎缩程度,轻度为1分、中度为2分、重度为3分。4)炎性病变评分:结构正常为0分,小灶状炎症病变为1分,片状炎细胞浸润且个别肾小管坏死为2分,大片炎细胞浸润且少量肾组织坏死为3分;病变积分=∑各部位病变评分。取右侧肾脏,加入适量预冷(4 ℃)生理盐水、在4 ℃环境中进行研磨匀浆,制备浓度为10%的组织匀浆液,4 ℃离心(转速:3 000 r/min,时间:10 min)取上清液,采用TBA法测定MDA含量、羟胺法测定SOD活性、比色法测定CAT活性,采用酶联免疫吸附法通过酶标仪测定脏组织MIP-2、MCP-1、TNF-α含量。
1.7 统计学处理运用统计学软件SPSS 17.0进行数理分析,计量资料以均数±标准差(x±s)方式表示,多组间均数比较采用单因素方差分析,进一步两两比较采用LSD检验。P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠排尿量、24 h Pro、尿NAG酶活性和血BUN、Scr含量测定与正常对照组相比,模型对照组大鼠排尿量、24 h Pro、尿NAG酶活性和血BUN、Scr含量均显著升高(P < 0.01);与模型对照组比较,发现经灯盏花素中、高剂量或肾炎康复片治疗14 d能够显著降低庆大霉素致AKI大鼠排尿量、24 h Pro、NAG酶活性并降低血BUN、Scr含量(P < 0.05或P < 0.01);AKI高剂量组与肾炎康复片比较,各指标差异均无统计学意义(P>0.05),见表 1。
|
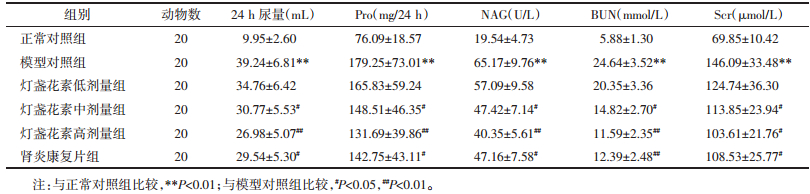
与正常对照组相比,模型对照组大鼠体质量显著降低、肾脏质量和肾脏指数显著升高(P < 0.01);与模型对照组相比,发现经灯盏花素中、高剂量或肾炎康复片治疗14 d能够显著降低庆大霉素致AKI大鼠肾脏质量和肾脏指数(P < 0.05或P < 0.01),灯盏花素高剂量组体质量显著降低(P < 0.05);与肾炎康复片组相比,灯盏花素高剂量组大鼠肾脏指数显著降低(P < 0.05),见表 2。
|
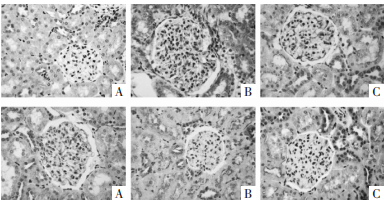
与正常对照组相比,模型对照组大鼠肾脏组织KIM-1蛋白表达明显上调、OD值显著升高(P < 0.01);而与模型对照组相比,灯盏花素各剂量组和肾炎康复片组大鼠肾脏组织KIM-1蛋白表达均呈不同程度下调,其中灯盏花素中、高剂量组OD值显著降低(P < 0.05或P < 0.01);与肾炎康复片组比较,灯盏花素高剂量组OD值显著降低(P < 0.05),见图 1、表 3。
|
| A-正常对照组;B-模型对照组;C-灯盏花素低剂量组;D-灯盏花素中剂量组;E-灯盏花素高剂量组;F-肾炎康复片组 图 1 各组大鼠肾脏组织KIM-1蛋白表达测定结果(IHC,×400) Fig. 1 Expression of KIM-1 protein in renal tissue of rats in each group(IHC, ×400) |
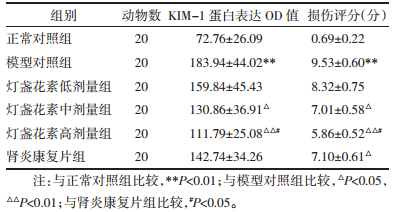
|
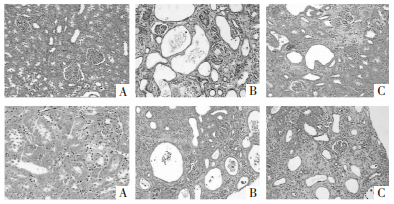
空白对照组大鼠肾小球、肾小管结构及细胞形态均未见异常;较正常对照组,模型对照组大鼠肾脏组织呈现明显的病理性改变,表现为肾小球数量减少、囊腔比例增大,肾小管出现结构异常、细胞坏死,间质呈纤维化病变,大量炎性细胞浸润等;较模型对照组,灯盏花素各剂量组和肾炎康复片组大鼠肾脏组织上述病理性改变呈不同程度改善,其中以灯盏花素高剂量组效果最为显著,见图 2。对各组病理切片进行损伤评分:与正常对照组比较,庆大霉素所致AKI大鼠肾脏组织评分显著升高(P < 0.01);与模型对照组比较发现,经灯盏花素中、高剂量或肾炎康复片治疗14 d能够显著降低庆大霉素致AKI大鼠肾脏组织损伤评分(P < 0.05或P < 0.01);与肾炎康复片组比较,灯盏花素高剂量组大鼠肾脏组织评分显著降低(P < 0.05),结果见表 3。
|
| A-正常对照组;B-模型对照组;C-灯盏花素低剂量组;D-灯盏花素中剂量组;E-灯盏花素高剂量组;F-肾炎康复片组 图 2 各组大鼠肾脏组织病理学检查结果(HE,×400) Fig. 2 Pathological changes of renal tissue of rats in each group(HE, ×400) |
与正常对照组相比,模型对照组大鼠肾脏组织SOD、CAT活性显著降低且MDA含量显著升高(P < 0.01);而与模型对照组相比,发现经灯盏花素中、高剂量或肾炎康复片治疗14 d能够显著提高SOD、CAT活性并降低MDA含量(P < 0.05或P < 0.01);肾炎康复片组MDA含量显著降低(P < 0.05或P < 0.01);与肾炎康复片组比较,灯盏花素高剂量组大鼠CAT活性显著升高且MDA含量显著降低(P < 0.05),见表 4。
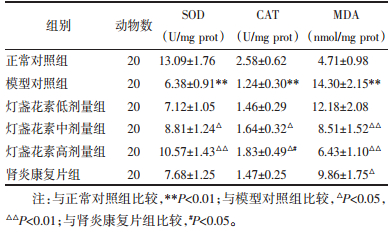
|
如表 5所示,与正常对照组相比,模型对照组大鼠肾脏组织MIP-2、MCP-1、TNF-α含量均显著升高(P < 0.01);而与模型对照组相比,发现经灯盏花素中、高剂量或肾炎康复片治疗14 d能够显著降低庆大霉素致AKI大鼠MIP-2、MCP-1、TNF-α含量(P < 0.05或P < 0.01);灯盏花素高剂量组与肾炎康复片比较,各指标差异均无统计学意义(P>0.05)。
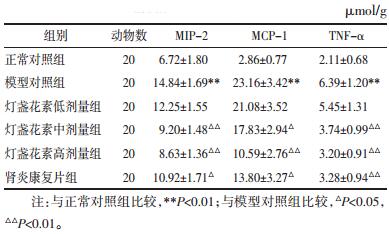
|
庆大霉素是氨基糖苷类抗菌药物的代表性药物,其对革兰阴性菌、肠球菌等感染疗效显著而广泛应用于临床,但庆大霉素容易引发肾功能损伤,有研究报道庆大霉素连续治疗7 d以上的患者并发AKI的发病率达20%左右[2],引起医药工作者的普遍关注。而庆大霉素所致AKI主要表现为BUN、Scr升高[8]。
灯盏花素是一种具有多种生物学活性的黄酮类化合物,是中国传统中药灯盏花的主要活性成分。本研究采用连续7 d腹腔注射给予庆大霉素[140 mg/(kg·d)]的方法制备庆大霉素致AKI大鼠模型,于造模第1天开始给予灯盏花素进行干预,实验结果显示,经灯盏花素干预14 d能够有效降低庆大霉素致AKI大鼠排尿量、24 h Pro水平,降低血BUN、SCr水平,抑制肾水肿、降低肾脏指数,抑制肾组织损伤、降低损伤评分,抑制肾小球、肾小管细胞超微结构病变,并且灯盏花素高剂量组对肾脏指数的改善及对肾组织损伤的抑制作用优于肾炎康复片组,提示灯盏花素具有抑制庆大霉素致AKI大鼠肾组织损伤、改善其肾功能的药理学作用。
NAG酶是一种广泛存在于各组织器官溶酶体中的特异性小管酶,肾小管上皮细胞含量丰富,其分子量较大(130 000~140 000道尔顿),生理状态下不能通过肾小球膜,只有当膜通透性遭到破坏的病理状态下才能释放到尿液中,因此尿NAG酶活性水平能够间接反映肾小管损伤程度。KIM-1是评价肾小管损伤的重要标志物,本实验研究结果显示,庆大霉素致AKI大鼠尿NAG酶活性升高、肾组织KIM-1表达上调,而经灯盏花素治疗14 d能够显著降低尿NAG酶活性并下调KIM-1蛋白表达,并且灯盏花素高剂量组对KIM-1蛋白表达的影响优于肾炎康复片组,说明灯盏花素具有抑制庆大霉素致AKI大鼠肾组织损伤的作用。
庆大霉素导致AKI的作用机制比较复杂,目前尚无定论,其中氧化应激损伤和炎症反应已经得到广大研究者的普遍认可[9],而灯盏花素具有显著的抗氧化作用[10]。体内氧自由基代谢失衡而多度蓄积是导致机体氧化应激损伤的根本机制,而肾组织抗氧化酶(SOD、CAT)活性降低是导致氧自由基代谢能力下降的主要原因[11];Kinsey GR等[12]研究报道急性肾衰竭将导致肾小管上皮细胞释放TNF-α、MCP-1、MIP-2等炎症因子而导致炎症细胞的趋化与活化,进行引发炎症反应。本实验研究结果显示,经灯盏花素治疗14 d能够显著提高庆大霉素致AKI大鼠肾组织SOD、CAT活性并降低MDA含量,降低炎症因子TNF-α、MCP-1、MIP-2水平,灯盏花素高剂量组对抗氧化酶活性和炎症细胞因子表达的影响优于肾炎康复片组,提示灯盏花素具有抑制庆大霉素致AKI大鼠氧化应激损伤和炎症反应的作用。
综上所述,灯盏花素对庆大霉素致AKI大鼠肾组织急性损伤具有一定的保护作用,其作用机理可能与灯盏花素能够改善肾功能、抗氧化、抑制炎症有关。
| [1] |
Quiros Y, Ferreira L, Sancho-Martínez SM, et al. Subnephrotoxic doses of gentamicin predispose animals to developing acute kidney injury and to excrete ganglioside M2 activator protein[J]. Kidney Int, 2010, 78(10): 1006-1015. DOI:10.1038/ki.2010.267 |
| [2] |
Srisung W, Teerakanok J, Tantrachoti P, et al. Surgical prophylaxis with gentamicin and acute kidney injury:a systematic review and meta-analysis[J]. Ann Transl Med, 2017, 5(5): 100-112. DOI:10.21037/atm |
| [3] |
向丽, 林波, 张祎, 等. 保肾颗粒对庆大霉素所致大鼠急性肾功能衰竭的保护作用[J]. 中药药理与临床, 2014, 30(4): 104-108. |
| [4] |
周懂晶, 刘玉品, 陈志远, 等. 3.0T ASL-fMRI评价灯盏花素对大鼠对比剂急性肾损伤的保护作用[J]. 暨南大学学报(自然科学与医学版), 2016, 37(3): 253-258. |
| [5] |
康红钰, 任亮, 张印坡, 等. 灯盏花素对顺铂肾损害的防治及抗氧化的实验[J]. 肿瘤防治研究, 2012, 39(2): 154-156. DOI:10.3971/j.issn.1000-8578.2012.02.009 |
| [6] |
邓虹珠, 金伟军, 廖锡麟, 等. 急性肾功能衰竭病理模型的设计和方法[J]. 中国中药杂志, 1998, 22(1): 48-52. DOI:10.3321/j.issn:1001-5302.1998.01.023 |
| [7] |
钟瑜萍, 李海燕, 宫仁豪, 等. 大黄黄芪不同配伍比例对慢性肾衰竭大鼠24h UPQ、Scr、BUN及肾脏形态学的影响[J]. 中药药理与临床, 2016, 32(4): 63-66. |
| [8] |
Ali BH. Agents ameliorating or augmenting experimental gentamicin nephrotoxicity:some recent research[J]. Food Chem Toxicol, 2003, 41(11): 1447-1452. DOI:10.1016/S0278-6915(03)00186-8 |
| [9] |
毛哲哲, 陈奎利, 冯强, 等. 灯盏花素对大鼠肺缺血再灌注后氧化应激的影响及机制研究[J]. 中南药学, 2017, 15(1): 61-64. |
| [10] |
王景霞, 邓文伟, 齐亚灵. 丹参和川芎嗪对庆大霉素肾毒性的保护作用[J]. 中国手术学杂志, 2002, 11(2): 247-249. |
| [11] |
Lartigue A, Burlat B, Coutard B, et al. The Megavirus chilensis Cu, Zn-superoxide dismutase:the first viral structure of a typical cellular copper chaperone-independent hyperstable dimeric enzyme[J]. J Virol, 2015, 89(1): 824-832. DOI:10.1128/JVI.02588-14 |
| [12] |
Kinsey GR, Li L, Okusa AMD. Inflammation in acute kidney injury[J]. Nephron Exp Nephrol, 2008, 109(4): 102-107. DOI:10.1159/000142934 |
 2019, Vol. 36
2019, Vol. 36